PROTOMETRIE EN MILIEUX ANHYDRE : Les réactions acide-base en milieu anhydre
COURS DE CHIMIE ANALYTIQUE DEUXIEME ANNEE PHARMACIE.
PROTOMETRIE EN MILIEUX ANHYDRE : Les réactions acide-base en milieu anhydre
PLAN :
INTRODUCTION I.DEFINITION II.CHOIX DES SOLVANTS III.LES THEORIES ACIDO-BASIQUE EN MILIEU ANHYDRE IV.REACTION ACIDE-BASE DANS LES SOLVANTS INERTES V.REACTION ACIDE-BASE DANS LES SOLVANTS ACIDES
VI.
REACTION ACIDE-BASE DANS LES SOLVANTS BASIQUES VII.REACTIONS DE NEUTRALISATION
VIII.
LES INDICATEURS POUR LE DOSAGE EN MILIEU ANHYDRE XI.APPLICATIONS PHARMACEUTIQUES CONCLUSION INTRODUCTION
Tous les grands types de réactions en solution aqueuse que nous avons étudiés Peuvent se dérouler dans d’autres solvants ou mélanges de solvants.
Comme en solution aqueuse, les milieux non aqueux font l’objet d’équilibres et de cinétiques qui sont étudiées à l’aide de relations mathématiques impliquant des constantes d’équilibre, cinétiques, équations de conservation de la matière etc.
Mais il s’avère aussi que, dans certains cas, des équilibres d’un type nouveau doivent être pris en compte.
DEFINITION
La protométrie en milieu non aqueux met en jeu des réactions de neutralisation acide-base dans des solvants autres que l’eau.
Lorsque le composé à doser est insoluble dans l’eau
Lorsque la force de l’acide ou de la base est trop faible dans l’eau ⇒ le point d’équivalence difficile à mettre en évidence. (On cherchera donc à se placer dans le cas idéal de la neutralisation acide fort- base forte)
Lorsque le caractère acido-basique de la molécule à doser n’est pas suffisamment différencié en milieu aqueux : les mélanges ou des polyacides /polybases.
Avant d’entreprendre un dosage en milieu non aqueux :
évaluer la possibilité de le réaliser en milieu aqueux
CHOIX DES SOLVANTS
Exaltation des propriétés acido-basique de la molécule à doser
Dissolution du produit de la réaction
Absence de réactions secondaires entre le solvant ou le réactif titrant et la molécule à doser.
Doivent être peu toxique et peu chers.
Procédé physique: distillation, Filtration sur cotons ou papiers spéciaux, cartouches de matériaux desséchants (tamis moléculaires)
Procédé chimique: séchage avec sulfate de magnésium anhydre ( MgSO4 :le plus efficace) ; du sulfate de sodium anhydre ( Na2SO4 :agit lentement) ; ou du chlorure de calcium anhydre
( CaCl2)
LES THEORIES ACIDO-BASIQUE EN MILIEU ANHYDRE
La théorie de Bronsted
La théorie de Lewis
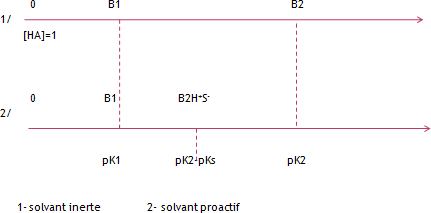
REACTION ACIDE-BASE DANS LES SOLVANTS INERTES
Un solvant inerte est:
Aprotique
Ne réagit pas sur les corps dissous
Apolaire
Pas ionisant
Pas dissociant
REACTION ACIDE-BASE DANS LES SOLVANTS ACIDES
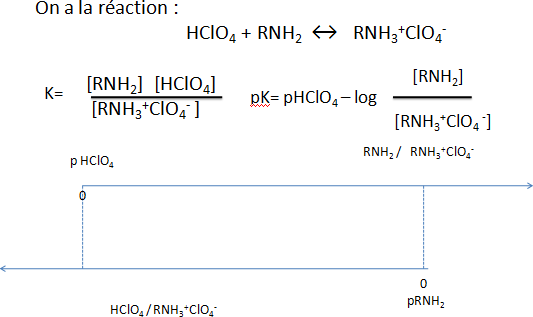
B+ HA ↔ BH+A–: paire d’ions non dissociée (sel)
REACTION ACIDE-BASE DANS LES SOLVANTS BASIQUES
pK-pKs= pHA et la position de B2 sur l’échelle de basicité correspondra à pK-pKs.
Cette valeur rend compte de la différence d’action de la base sur le solvant et l’acide, càd la différence de force entre l’acide et le solvant.


REACTIONS DE NEUTRALISATION
Dosage des acides
les acides carboxyliques (dans pyridine ou le diméthylformamide :DMF)
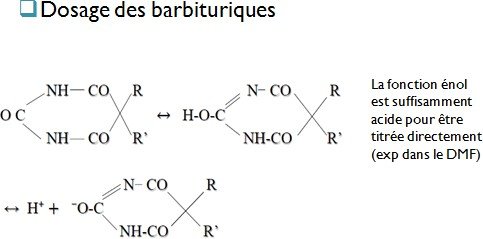
les énols, imides, sulfonamides, barbituriques (DMF ou l’acétone)
les phénols substitués par des groupements électronégatives.
Principe:
Dosage de AH par KOH dans la pyridine:
AH + C₅H₅N ⇌ A⁻C₅H₅NH⁺
A⁻C₅H₅NH⁺ + KOH → C₅H₅NH⁺OH⁻
C₅H₅N + AH + KOH → A⁻K⁺ +C₅H₅NH⁺OH⁻
Solvants:
La pyridine
Diméthylformamide (DMF)
Acétonitrile.
Acétone et autres cétones
Alcool ter-butylique
Réactif titrant:
Hydroxydes alcalins en solution dans les alcools aliphatiques:
Hydroxyde de potassium alcoolique
Hydroxyde de potassium méthanolique
Méthylates alcalins (CH3OMe)
Méthylate de sodium et méthylate de potassium
Sels d’ammoniums quaternaires:
Etalonnage
Acide benzoique: C6H5COOH Eq= Mr= 122,12
Acide succinique : (CH2COOH)2 Eq=Mr/2= 59,05
Acide sulfamique : NH2SO3H Eq= Mr= 97,09
Phtalate acide de potassium Eq= Mr= 204,22
Dosage des bases organiques :
Cette méthode de dosage est applicable à toutes les molécules organiques présentant un azote basique dans leur structure (amines primaires, secondaires, et tertiaires , aliphatiques, aromatiques ou hétérocycliques).
Solvant:
Acide acétique anhydre
Anhydride acétique
Acétonitrile
Benzène et toluène.
Principe :
la réaction de neutralisation se déroule en deux étapes :
Solvataion de la molécule à doser:
RNH₂ + CH₃COOH ⇌ RNH₃⁺CH₃COO⁻
Titration proprement dite:
RNH₃⁺CH₃COO⁻ + HClO₄→ RNH₃⁺ClO₄⁻ + CH₃COOH
Etalonnage
Phtalate acide de potassium
Eq= Mr= 204,22
Réactif titrant
L’acide perchlorique
Solutions d’acide perchlorique dans le 1-4 dioxane; Solutions d’HCL
dosage des sels
Les sels de bases organiques représentent une grande partie des principes actifs.
Les techniques de dosage varient suivant l’anion salifiant.
Sels d’acides de force inférieure à l’acide acétique.
Sels d’acides de force supérieure à l’acide acétique.
Ammoniums quaternaires.
Ammoniums quaternaires
Ce sont des bases qui existent seulement sous forme de sels: hydroxydes, halogénures, phosphates… X⁻NR₄⁺ :
CH₃COOH+ R₄N⁺ OH⁻ R4N+CH₃COO⁻+ H2O R4N+CH₃COO⁻ + HClO₄ → R4N+ClO₄⁻ + CH₃COOH
R₄N⁺ OH⁻ + HClO₄ → R4N+ClO₄⁻ + H2O
Sels d’acides de force inférieure à l’acide acétique.
Ce sont les propionates, maléates, benzoates, salicylates…
Directement titrables comme des bases organiques par l’acide perchlorique
Sels d’acides de force supérieure à l’acide acétique:
Sels d’acides forts halogénés et de bases organiques:
LES INDICATEURS POUR LE DOSAGE EN MILIEU ANHYDRE
Violet de gentiane: solution 0,5% m/v dans l’acide éthanoique Violet bleu vert
jaune
verdâtre
Rouge de méthyle: 0,2% m/v dans le dioxane : Jaune rouge
α-naphtolbenzéine: 0,2% m/v dans l’acide éthanoique : Jaune vert
Rouge de quinaldine: 0 ,1% dans l’éthanol (stupéfiants) : Pourpre vert pale
Bleu de thymol: 0 ,2% m/v dans le méthanol : Jaune bleu
XI.APPLICATIONS PHARMACEUTIQUES


Indication des points équivalents par Potentiométrie:
On utilise un pH-mètre ordinaire adapte à l’usage d’électrodes de verre qui possèdent une très forte résistance.
Potentiométrie à intensité nulle
Potentiométrie à intensité imposée
CONCLUSION
Les titrages en milieu non aqueux des molécules organiques à fonction acide ou basique continuent de faire l’objet de multiples applications et notamment dans le cadre de l’analyse des médicaments.
Les méthodes sont codifiées et l’on trouvera de multiples applications notamment dans toutes les pharmacopées.
