Propriétés physico-chimiques des oses
– Propriétés physico-chimiques des oses:
Propriétés physiques :
Très solubles dans l’eau, peu solubles dans l’éthanol mais plus facilement soluble dans le méthanol et la pyridine.
Propriétés spectrales :
-Les oses n’absorbent pas dans l’UV
spectre IR caractéristique.
Leur pouvoir rotatoire spécifique propriétés fondamentales identification Leur comportement chromatographique
Propriétés chimiques :
A- Stabilité chimique des oses :
→A1- milieu acide et à chaud :il y a déshydratation interne avec cyclisation de la molécule
Pentose : on obtient un furfural
Hexose : on obtient un hydroxymethyl furfural
H H
O
HO C C
OH H+ HC C- CHO + 3 H2O
H CH C
H chaud HC CH HO OH CHO
Pentose furfural
H H O
HO C C
OH
HOH2CC C- CHO + 3 H2O
H+
H CH C H
HC CH
Chaud
HOH2C HO OH CHO
Hexose hydroxymethyl furfural
Les dérives de type furfural ainsi obtenu ont la propriété de se condenser avec les phénols et amines aromatiques pour donner des complexes colorés.
Exp.
Orcinol + pentose coloration bleu violacée O.toluidine +hexose
coloration bleu vert
Résorcinol + cétose coloration rouge
Anthrone + glucose coloration bleu vert.
→A2- en milieu alcalin a froid : soit une intercoversion ou une epimerisation de l’ose.
CHO CH2OH
H ─ C ─ OH Interconversion C ═ O C C
CHO CHO
Epimerisation
H ─ C ─ OH HO ─ C
C C
→A3- en milieu alcalin et à chaud, la dégradation des oses est totales.
B- propriétés dues à la présence du groupement carboxylique :
→B-1- Réduction :
la réduction des oses donne des polyalcools
elle peut se faire par :
voie enzymatique (réversible) par des enzymes spécifiques : « réductases »
voie chimique (irréversible) soit par :
*Hydrogénation catalytique sur le noir de platine ou Nickel Raney
*action de l’hydrure de bore et de sodium (NaBH4)
⇒ En partant d’un aldose, on obtient un isomère unique
En partant d’un cétose, on obtient deux polyalcools epimére
CHO CH2OH
NaBH4
CH2OH CH2OH
D-glucose D-sorbitol
CH2OH CH2OH CH2OH
C═O
NaBH4 NaBH4
CH2OH CH2OH CH2OH
D-mannitol D-fructose D-sorbitol
→B-2- Oxydation:
*les oxydants doux tels que le Br2, I2 en milieu alcalin (OH-) et en présence de HNO3 très dilué oxydent la fonction aldéhydique des aldoses en groupement carboxyliques conduisant à des acides adoniques.
Exp.
CHO COOH
CH2OH CH2OH
D- Glucose Ac D- Gluconique
En solution aqueuse, l’acide gluconique est en équilibre avec les lactones correspondantes :
COOH
CH2OH
NB : Cette oxydation est possible par voie enzymatique :
GOD
Glucose acide gluconique
*l’oxydation plus poussée par HNO3 oxyde la fonction alcool primaire en même temps que la fonction carbonylique ; on obtient des diacides : acide glycarique ═ acides aldariques
CHO COOH
HNO3
CH2OH COOH
D-glucose Ac glucarique
L’oxydation des cétoses par le HNO3 conduit à la coupure de la molécule.
en milieu alcalin, de nombreux cations métalliques oxydent les oses (aldoses et cétoses) c’est le cas de la liqueur de Fehling (CuSO4+tartrate de Na, K +KOH) : oxydation de l’ose par l’oxyde cuivrique qui est réduit en acide cuivreux rouge.
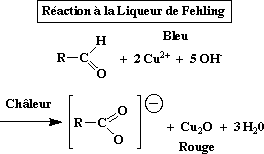
L’oxydation de la seule fonction alcool primaire conduit aux acides uroniques, Exp.
Glucose acide glucuronique
Mannose acide mannuronique
Galactose acide galacturonique
→B-3- Réactions d’addition et de substitution au niveau de la fonction carbonylique :
◈B-3-1-Action des alcools et des phénols :
L’hémiacétalisation intramoléculaire des oses limite les réactions d’addition sur la fonction carbonylique ; cette propriété est mise à profit pour protéger la fonction aldéhydique.
La liaison C─O─R ainsi créée au niveau du C1 est dite liaison osidique et les produits obtenus sont dits hétérosides.
CH2OH
(H, OH) CH3OH (H, OCH3)
O
O
(H, OC6H5)
O
C6H5OH
◈B-3-2-Action de l’acide cyanhydrique: c’est la première étape de l’allongement des oses selon la méthode de Kiliani Fischer.
◈B-3-3-Action de l’ammoniac et des amines : Conduit à des hétérosides appelés N-glycosides.
(H, NH2)
O
Glucosylamine adénosine
◈B-3-4-Action de l’acide ortho phosphorique (H3PO4):
H3PO4 réagit sur la fonction hémiacétalique des aldoses et cétoses pour donner des acides osylphosphoriques
CH2OH CH2OH
O
O
H
H3PO4
H OH
OH O – P – OH
O
α-D-glucose Acide α-D-glucosyl 1-phosphorique
◈B-3-5-Action des thiols :
En milieu acide, le groupement aldéhydique des aldoses se combine aux thiols (R-SH) pour donner des mercaptals : l’aldose fixe deux molécules (- S – R).
H O H S- C2H5
C
H
S- C2H5
C
O
C S-C2H5
2(C2H5 SH)
H+ H2O
HgCl2 (H2O)
CH2OH CH2OH CH2OH
D-glucose Diethyl-mercaptal ethyl-thioglucoside
du D-glucose
Le traitement du mercaptal par le chlorure mercurique (HgCl2) en solution aqueuse entraîne l’élimination d’un groupement (S-R) et hemiacétalisation intramoléculaire.
NB : les cétoses ne se combinent pas avec les thiols
C- propriétés dues à la présence de la fonction alcoolique :
→C-1- Estérification :
Les fonctions alcool primaires et secondaire peuvent être estérifiés par les acides minéraux:
*Esters nitriques : vasodilatateurs utilisés en thérapeutique cardiovasculaire.
*Esters sulfuriques : rencontrés dans les glycosaminoglycannes (GAG) du tissu conjonctif.
*Esters boriques : résultent de l’estérification de deux fonctions alcools voisines par une molécule H3BO3
C
OH
C
O
H3BO3
C
OH
C
O
B OH + H2O
Application analytique: Les oses ne migrant pas dans un champ électrique, mais migrent plus facilement sous forme d’esters boriques.
*Esters phosphoriques : sont d’une très grande importance biologique ; dans la cellule, les oses réagissent presque toujours sous forme d’esters phosphorique et pratiquement jamais à l’état libre.
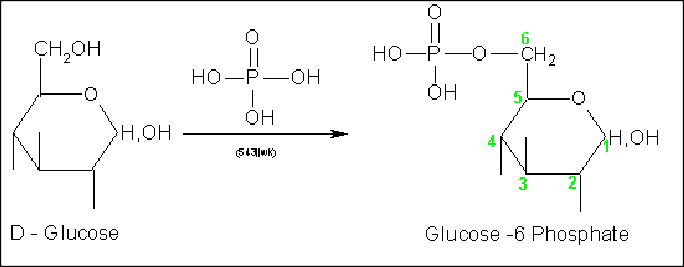
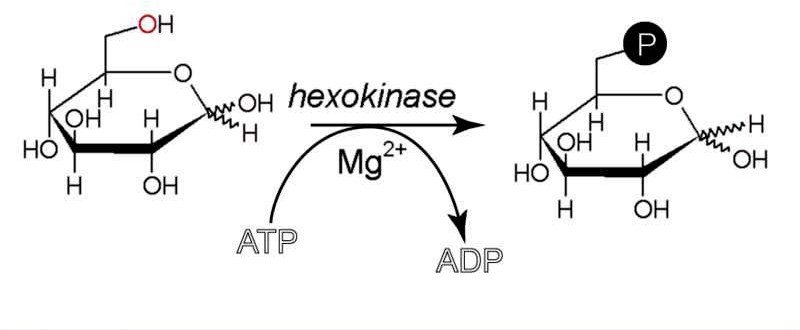
-Esters mono phosphoriques : glucose 6 phosphate
-Esters di phosphoriques : fructose 1,6 bi phosphate
-Esters mono phosphoriques cycliques : AMPc
-Esters poly phosphoriques : ATP
-Esters phosphoriques résultants de la combinaison d’une molécule H3PO4 avec deux fonctions R-OH portées par deux oses différents : cette structure est à la base de l’édifice des acides nucléiques.
→C-2-Formation d’ether-oxydes : (methylation des fonctions alcooliques) :
Les agents méthylants classiques tels que SO4 (CH3) en milieu alcalin ou ICH3 en présence de AgO agissent en substituant tous les H des groupements OH par un CH3 formant ainsi des ether-oxydes méthyliques.
L’hydrolyse acide ménagée par HCl dilué permet de régénérer la fonction aldéhydique car la liaison hémiacétalique est plus fragile que les liaisons ether-oxydes.
Le traitement de l’ose méthylé par HNO3 conduit à la rupture du cycle avec élimination des carbones ne faisant pas partie du cycle (il s’agit du C6).
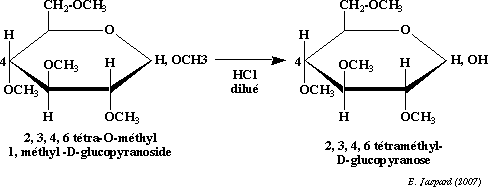
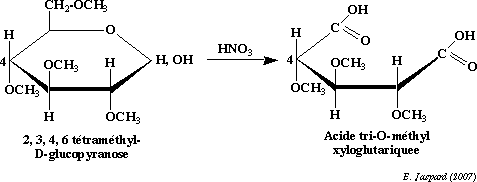
Application :
-détermination de la structure cyclique : 5 ou 6 atomes de C ainsi que l’emplacement du pont oxydique.
-détermination de l’enchaînement des oses dans les polyosides : après méthylation complète suivie d’une hydrolyse par un acide dilué, il y aura coupure des liaisons osidiques et les oses méthylés seront séparés par chromatographie (CCM, CPG, HPLC)
d- propriétés dues à l’association de la fonction alcool et la fonction carbonylique :
*Action des hydrazines substituées :
La phenylhydrazine et ses dérivés réagissent avec les oses en proportion équimolaire pour donner une hydrazone.
En présence d’un excès d’hydrazine et à chaud, on obtient une osazone.
CHO HC N—NH– C6H5 HC
NH O
+ H2N—NH—C6H5
+ H2O
+ H2N—C6H5
| CH2OH | CH2OH | CH2OH | |
| Glucose | phenyl hydrazine | phenyl hydrazone |
HC NH HC
N—NH– C6H5
N—NH– C6H5
+ 2(H2N—NH—C6H5)
CH2OH CH2OH
Osazone
Deux aldoses epimére en C2 et leur cétose correspondante donnent naissance à une même osazone.
Exp.
D-glucose, D-mannose et D-fructose.
Les osazones sont des composés jaunes qui par leurs propriétés physiques (mode de cristallisation, point de fusion, alpha spécifique….) permettent l’identification de l’ose.

