Pharmacologie expérimentale préclinique (Développement Préclinique)
Introduction :
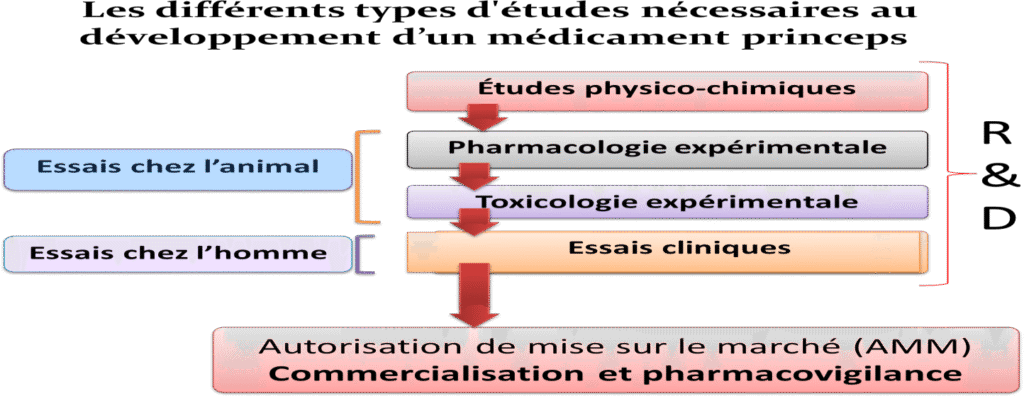
Le développement d’un médicament princeps de la molécule jusqu’à la commercialisation nécessite dix à quinze ans de recherche pour explorer tous les champs d’investigation.
Ces travaux, tests précliniques, essais cliniques et de développement industriel, sont strictement encadrés par la loi.
En industrie pharmaceutique, les termes “recherche et développement” couvrent un processus long et fastidieux.
Les étapes de recherche et développement couvrent les études réalisées entre la découverte d’une molécule et sa commercialisation.
Sur dix mille molécules testées en recherche et développement, seulement une arrivera à passer tous les stades jusqu’à la commercialisation.
Pharmacologie expérimentale
1-Définition : La pharmacologie expérimentale permet de sélectionner des molécules présentant une activité pharmacodynamique.
Le screening pharmacologique:
Définition du screening : C’est un criblage des molécules par des tests codifiés pour découvrir d’éventuelles propriétés pharmacologiques.
C’est soumettre à des essais biologiques des substances testées.
Classification
b1. Screening général : C’est une présélection systématique des molécules sur plusieurs tests physiologiques appartenant à plusieurs systèmes (cardiovasculaire, digestif ; nerveux etc.…).
Permet de découvrir les têtes de série et la constitution de chimiothèques.
b2. Screening orienté : Limité à quelques activités appartenant à quelques systèmes seulement.
Ex : recherche de l’activité anti-inflammatoire d’un dérivé non stéroïdien.
Le modèle en pharmacologie expérimentale
Définition :
Système qui vise à reproduire un effet pharmacologique en dehors du sujet original.
Exemples :
Psychotropes : rat, souris.
Anticancéreux : souris.
Anesthésiques locaux: lapin
Types de modèles :
Modèle utilisant l’animal entier
Modèle utilisant un organe isolé
Modèle utilisant une culture cellulaire
La réponse biologique en pharmacologie expérimentale :
Réponse qualitative : effet du tout ou rien.
Exemple : Souris présentant ou non des
convulsions après injection d’une substance pro convulsivante.
Réponse quantitative : réponse mesurable (durée, intensité).
Continue : graduelle (HTA chez le chien)
Discontinue : intermittente (toux chez le chat)
Evaluation quantitative de l’activité pharmacodynamique:
La dose efficace 50: DE50 : Dose qui inhibe l’apparition de 50% du symptôme de la
pathologie expérimentale induite chez les animaux de laboratoire.
Détermination :
Induction de la pathologie.
Administration de la substance médicamenteuse à l’animal.
Mesure du symptôme caractéristique de la pathologie induite.
Mesure du % d’inhibition du symptôme par rapport à un lot témoin.
% d’inhibition = (S témoin – S essai) x 100/ S témoin
S essai : intensité moyenne du symptôme dans le lot essai.
S témoin : intensité moyenne du symptôme dans le lot témoin.

Toxicologie expérimentale
Les essais pharmacologiques sont toujours suivis par des essais toxicologiques, car l’efficacité pharmacologique d’une molécule n’est pas suffisante pour justifier son éventuelle introduction en thérapeutique, en plus de celle-ci aucun effet toxique pour l’organisme ne doit se produire.
La toxicologie expérimentale est l’ensemble d’essais qui permettent d’évaluer expérimentalement sur l’animal, la sécurité d’un médicament nouveau et d’apprécier les risques qu’il présente pour l’homme.
Ces essais de toxicité se divisent en deux groupes :
Essais pré-requis : dont la réalisation est indispensable avant toute tentative
d’administration à l’homme :
Essais de toxicité par administration unique : toxicité aigue
Essais de toxicité par administration réitérée à court terme : toxicité subaiguë
Essais de mutagenèse
Essais post-requis : pour lesquels on prend le risque de les réaliser conjointement avec les essais cliniques chez l’homme :
Essais de toxicité par administration réitérée à long terme : toxicité chronique
Essais de cancérogenèse
Essais de tératogenèse (sur la reproduction)
Pour ce faire, la réglementation internationale, impose des études sur l’animal selon des protocoles bien définis, conformes aux BPL (bonnes pratiques de laboratoire) qui assureront la reproductibilité des essais.
Essais pré-requis :
Essais de toxicité par administration unique ou toxicité aigüe :
La toxicité aigüe permet l’évaluation qualitative et quantitative des phénomènes toxiques et leur évolution dans le temps suite à l’administration d’une dose unique de la ou des substances actives contenues dans le médicament.
L’étude qualitative permet de connaître les symptômes de l’intoxication aigue et leurs temps d’apparition.
L’étude quantitative (mortalité, morbidité) nous renseigne sur le niveau de dose
pouvant entraîner la mort de l’animal.
Généralement on détermine la dose minimale mortelle DMM et la dose létale 50 (DL50).
a)-Détermination de la dose minimale mortelle DMM :
C’est la dose minimale de la substance capable de tuer un animal par administration intraveineuse lente et continue.
La quantité injectée au moment de l’arrêt cardiaque est la DMM.
Cette dose permet de choisir les doses à utiliser pour déterminer la DL50.
b)-Détermination de la dose létale 50 :
Définition :
La DL50 est une estimation statistique d’une dose unique capable de tuer la moitié des animaux mis en expérience dans une même espèce animale.
Protocole expérimental :
Comme il est impossible d’obtenir immédiatement 50% de morts à partir d’un seul groupe, la méthode consiste à expérimenter sur 6 lots de 10 animaux auxquels sont administrés des doses croissantes de la substance pour que le pourcentage de mortalité varie entre 0 et 100%.
Sélection de l’espèce animale
L’essai peut être effectué sur des mammifères.
Habituellement, ce sont les rongeurs (rat ou souris) qui permettent l’extrapolation à l’homme.
voies d’administrations :
Deux voies : une qui est celle prévue en thérapeutique humaine et l’autre
garantissant une biodisponibilité absolue (IV parfois l’intra péritonéale).
doses administrées et constitution des lots :
Une gamme de 6 doses ou plus est sélectionnée.
Le rapport entre deux doses successives doit être compris entre 1.2 et 1.5.
durée d’observation : 14 jours.
Examens :
On doit noter l’heure de la mort, le nombre de morts ainsi que les symptômes observés
Une Autopsie est obligatoire pour tous les animaux morts au cours de l’essai.
On effectue alors
Des examens macroscopiques des viscères : aspect des tissus, lésion, hémorragie….
Des examens histopathologiques pour tous les organes révélant des modifications macroscopiques.
Evaluation :
L’étude de la toxicité aigüe d’un produit permet d’établir la relation entre la dose
administrée et l’intensité des effets observés ainsi que le calcul de la DL50.
Calcul de la DL50 : deux méthodes sont utilisées :
Méthode de Karber et Behrens : méthode mathématique
DL50: dose létale 50 (mg/kg)
DL50 = DL100 – ∑ ab / n
DL100 : dose létale 100
a : différence entre deux doses successives.
b : moyenne de mort entre deux doses successives.
n : nombre moyen d’animaux par lot
Méthode de Miller et Tainter : méthode graphique
Les pourcentages de mortalité en fonction du logarithme décimal des doses utilisées sont représentés sur du papier semi logarithmique, on obtient alors une courbe sigmoïde :
100%
% de Mortalité
50
DL50 Log dose
Graphe montrant la relation dose / mortalité (échelle semi logarithmique)
exploitation des résultats : Les résultats de l’essai de toxicité aigüe permettent :
Evaluation quantitative de la dose létale.
Déterminer la nature des effets toxiques aigus.
Prévoir les signes cliniques observés en cas de surdosage aigu chez l’homme.
Choisir les doses à utiliser pour les épreuves de toxicité par administration répétées.
Déterminer l’index thérapeutique IT DL50
=
DE50
Essais de toxicité par administration répétée à court terme (toxicité subaiguë) :
Protocole expérimental :
Choix de l’espèce :
On peut opérer sur deux espèces de mammifères : un rongeur, généralement c’est
le rat et un non rongeur (chien ).
Voie d’administration :
Le choix de la voie d’administration tient compte de celle prévue en thérapeutique
Doses : trois niveaux de doses sont utilisés
Dose forte : elle doit faire apparaître des symptômes de toxicité, mais insuffisante
pour tuer l’animal.
Dose faible : sans effets toxique mais produit des effets pharmacodynamiques
Dose intermédiaire : moyenne géométrique des doses précédentes.
Fréquence d’administration : administrations journalières.
Durée de l’essai : dépend du temps pendant lequel il sera donné à l’homme :
Examens :
Observations générales quotidiennes du comportement,
Contrôle de la croissance (évolution pondérale) et de la consommation alimentaire (eau et nourriture) qui sont des indices sensibles d’effets toxiques.
Explorations fonctionnelles (ECG, ophtalmologie, rénale, hépatiques…)
Examens hématologiques et biochimiques au début, milieu et fin de l’essai
Comptabilité du nombre de morts
Examens anatomopathologiques :
Exploitation des résultats :
Les données quantitatives des essais subaiguës ont pour but de déterminer :
La dose sans effet observé ou NOEL « No Observed Effect Level »
C’est la dose la plus élevée pour laquelle aucun effet toxique significatif, clinique, biologique ou anatomopathologique n’est relevé par rapport aux lots témoins
La nature et le site des effets toxiques (organes cibles).
Essais de mutagenèse :
Définition :
Une mutation correspond à une modification brusque, permanente et transmissible du génotype par changement dans le nombre ou la qualité des gènes.
But des essais de mutagenèse :
L’étude du pouvoir mutagène a pour objet de révéler ces modifications occasionnées par une substance au matériel génétique de l’individu, ayant pour effet de rendre la descendance différente de l’ascendance de façon permanente et héréditaire.
Ces essais sont exigés pour toute nouvelle molécule à cause de la relation étroite entre mutagenèse et cancérogenèse.
En effet, 95 % des cancers sont d’origine mutagène et comme l’essai de cancérogenèse est long on préfère celui de mutagenèse qui permet un screening rapide du pouvoir cancérigène.
Les différents types de mutations et les tests correspondants :
Les changements causés au patrimoine génétique peuvent se situer au niveau des gènes, des chromosomes ou du génome :
Mutation génique
Aberration chromosomique
effets sur l’ADN : Défaut de réparation de l’ADN
Description du protocole expérimental :
Les essais de mutagenèses utilisent des tests in vitro sur bactéries, levures, cellules de mammifères et des tests in vivo sur des insectes et des rongeurs :
Essais relatifs aux mutations géniques :
Une mutation génique ou ponctuelle est une addition ou perte de paires de bases (puriques ou pyrimidiques) ou substitution par une paire erronée dans la molécule d’ADN.
Nouveau gène nouvelle protéine nouveau caractère
Test in vitro pour la détection de mutation reverse : Test d’AMES (muta test)
Principe : restaure le gène muté en type sauvage :
On utilise une souche de Salmonelle typhimurium porteuse d’une mutation « His – » inapte à synthétiser l’histidine (se développe uniquement en milieu riche en histidine) dont la culture en présence d’agent mutagène conduit à un retours au type sauvage
« His+ » capable de croître en l’absence d’histidine.
Avantages :
test simple, rapide (48h), et sensible
Son pouvoir prédictif est de 70-90%
Inconvénients:
test bactérien: problème d’extrapolation.
Essais relatifs aux aberrations chromosomiques :
Recherche de dommages sur les chromosomes effet clastogène
Les mutations chromosomiques résultent d’aberration structurale (délétion, translocation, inversion) ou changement du nombre de chromosomes.
Test in vitro en métaphase sur chromosomes humains :
Ces cellules cultivées dans un milieu adéquat seront exposées à diverses concentrations de la molécule à tester en présence ou non de système de bio activation (microsome hépatique).
Après incubation, la division est stoppée en métaphase par la colchicine.
Les cellules seront examinées au microscope (caryotype) pour détecter des aberrations chromosomiques.
Essais relatifs aux effets sur l’ADN (réparation de l’ADN et recombinaisons) :
Ces processus ne sont pas des mutations par eux même mais des indicateurs de lésion
d’ADN causés essentiellement par des molécules mutagènes.
La cellule répond aux agressions par les substances chimiques, des réparations enzymatiques (polymérases) pour éliminer la partie endommagée et la remplacée par un fragment nouvellement synthétisé.
Test sur les Bactéries :
Parmi les diverses souches d’E coli certaines possèdent l’ADN polymérase I (enzyme
capable de réparer l’ADN) et d’autres en sont dépourvues.
Les agents mutagènes produisant une lésion de l’ADN, bloquent uniquement la croissance des souches dépourvues de l’enzyme.
Essais post-requis :
Essai de la toxicité répétée à long terme: (toxicité chronique) :
Intérêt:
– Compléter les informations sur la toxicité du produit.
– Déterminer les organes cibles (altérations fonctionnelles et anatomopathologiques.(
– Mise en évidence d’effets réversibles et non réversibles.
– Existence ou non d’effets cumulatifs ou retard.
– Enrichir les connaissances cliniques .
protocole:
– Espèce : rat+++/chien++/ singe.+
– Sexe : mâle – femelle (nombre égale pour chaque sexe.(
– Voie d’administration : même que la subaigue.
Durée d’administration:
rat : 2 ans
Chien / singe : 7 ans ou plus
Doses : selon résultats de la subaiguë, usage thérapeutique.
– Examens : les memes que pour la toxicité subaigue
– Résultats et exploitation des résultats:Idem subaiguë : dose sans effet .
Essai de cancérogenèse:
But:
Evaluer le potentiel cancérigène de:
molécules administrées en chronique: les Anti-HTA.
molécules suspectes lors des premiers essais toxiques.
molécules ayant une analogie structurale avec des produits cancérigènes.
Protocole:
– Espèce animale: Souris / rat /hamster
– Age: depuis le sevrage.
– Sexe: mâle – femelle.
– Doses : 3 : forte, faible et intermédiaire
Voie : celle de l’exposition chez l’homme .
– Durée: 24 mois (souris/hamster), 30 mois (rat)
– Examens:
Biologiques
Cliniques
Histopathologiques
Autopsie : Recherche de tumeurs
– Résultat: Effet du tout ou rien: pas d’effet cancérigène.
Essais de tératogenèse (essais sur la reproduction) :
Le protocole expérimentale comporte trois niveaux d’investigation: Trois segments.
Segment I: étude sur la fertilité.
Segment II: étude d’embryotoxicité et de foetotoxicité.
Segment III: étude de pré et post natalité.
Essais sur la reproduction: segment I (Etude de la fertilité)
C’est l’étude de l’impact du produit sur les gamètes (stérilité, malformation) males et femelles.
Sexe: mâles et femelles
Animal: souris/singe/rat
Protocole:
– Traitement pendant toute la durée de la gamétogenèse
– Croisement d’animaux traités avec ceux non traités
– Examens: Observation de la gravidité des femelles et observation des nouveaux nés à la recherche de malformations.
Essai sur la reproduction :segment II ( Embryotoxicité/foeto-toxicité )
Sexe : femelle
Animal : rat /souris
Proto-cole:
Traitement des femelles gravides (pendant toute l’organogenèse)
Deux jours avant la mise bas : sacrifice des femelles.
Prélèvement des utérus.
Recherche de lésions
Essai sur la reproduction : segment III( Phase pré et post- natalité):
-Sexe : femelles gestantes
-Age : mature
-Animal : rat / souris
– Protocole:
– Administration du produit quelques jours avant mise bas et pendant toute la durée de l’allaitement.
– Recherche d’éventuelles perturbations de la croissance du fœtus, et de la lactation

