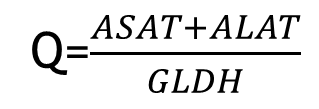Métabolisme des glucides
I-Mise en place générale
Les glucides ont différents rôle au sein de l’organisme : production énergétique ou mise en réserve, synthèse de glycoprotéines et de macromolécules (GAG, …), synthèse des nucléotides (ribose et NADPH), épuration des produits insolubles et toxiques, interrelation métabolique.
1-Schéma général de l’assimilation des glucides alimentaires
L’amidon végétal et le glycogène animal constituent la plus grande part de notre alimentation.
Tous deux sont de hauts polymères d’hydrates de carbone qui sont dégradés en glucose. En raison du rôle central du glucose dans l’organisme animal, son métabolisme figure au premier plan de ce chapitre.
La dégradation du glucose en pyruvate, la glycolyse, occupe une place importante dans la biochimie cellulaire.
Elle se déroule dans le cytoplasme de toute cellule somatique.
Le cycle de Krebs et la chaîne respiratoire vienne se greffer sur le chemin de la production d’énergie.
L’excès de glucose rejoint le métabolisme du glycogène pour une mise en réserve.
Si le glucose devait manquer à la cellule, il peut être synthétisé à partir du pyruvate lors de la gluconéogenèse.
Les polysaccharides absorbés via l’alimentation sont progressivement découpés en monosaccharides. Ils franchissent sous cette forme la barrière intestinale et parviennent dans la circulation sanguine.
La concentration sanguine moyenne en glucose est de 80-120 mg/dl.
Les monosaccharides parviennent dans le cytoplasme de leurs cellules cibles grâce à des transporteurs spécifiques.
2- Transport cellulaire du glucose
Le transport du glucose par diffusion facilitée est une étape limitante du métabolisme cellulaire.
Les isoformes de transporteurs ont des affinités variables pour le glucose et l’expression de ces isoformes a une certaine spécificité tissulaire.
En effet on trouve des isoformes ubiquitaire (GLUT 1 et 3), c’est-à-dire présentent dans tous les tissus, et des isoformes spécifiques (GLUT 2 et 4) :
GLUT 1 est principalement visible au niveau des érythrocytes et des neurones,
GLUT 2 est principalement visible au niveau des hépatocytes et des cellules β des îlots de Langerhans,
GLUT 3 est principalement visible au niveau des neurones,
GLUT 4 est principalement visible au niveau des cellules musculaire striées et des adipocytes,
GLUT 5 est principalement visible au niveau des entérocytes et des spermatozoïdes.
De manière plus localisé, il est important de comprendre les mécanismes d’absorption du glucose au niveau des entérocytes.
Au niveau de la bordure en brosse dirigée vers la lumière intestinale, le glucose rentre dans la cellule par un transporteur symport glucose-sodium.
Au pôle basal il sera ensuite pris en charge par un transporteur uniport afin de passer dans la circulation sanguine.
Le sodium quant -à lui ressortira de la cellule par une pompe sodium-potassium (Na+-K+ ATPase).
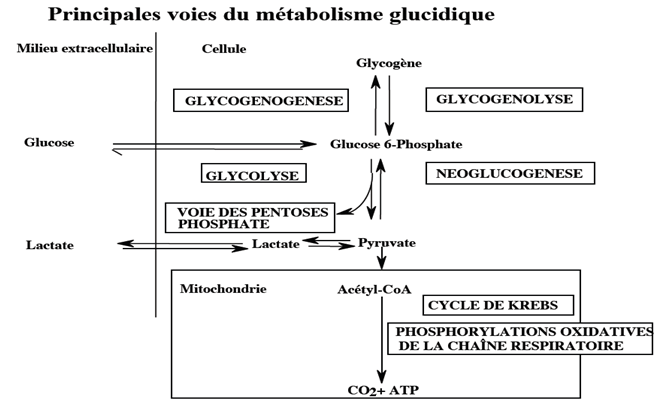
II) Catabolisme glucidique
Le catabolisme glucidique correspond à la dégradation des molécules de glucose permettant la formation de molécules riches en énergie.
1) La glycolyse (ou voie d’Embden-Meyerhof)
La glycolyse est la première chaîne du catabolisme des glucides, elle s’effectue dans le cytosol par des enzymes solubles et en anaérobie (sans apport d’oxygène).
Elle a comme fonction la synthèse de molécule riche en énergie, ainsi que la formation de pyruvate qui aura plusieurs destinées.
Cette voie métabolique produit de l’énergie libre sous forme d’ATP.
Il est à noter que tous les intermédiaires entre le glucose et le pyruvate sont phosphorylés ce qui leur confère une charge négative nette à pH 7, les empêchant ainsi de diffuser à l’extérieur de la cellule.
Les deux phases de la glycolyse :
Phase I: Investissement d’énergie (Réactions 1-5): C’est une phase préparatoire de la glycolyse.
Ici le sucre à 6 C (glucose) est phosphorylé et coupé en deux parties (3C:glycéraldéhyde 3P) avec consommation de 2 molécules d’ATP.
Phase II: Récupération d’énergie (Réactions 6-10): les deux molécules de glycéraldéhyde 3P sont converties en pyruvate avec formation de 4 molécules d’ATP.
Le rendement net est de 2 molécules d’ATP.
On a également la formation de 2 molécules de NADH qui peuvent être transformées en ATP grâce à la respiration mitochondrial.
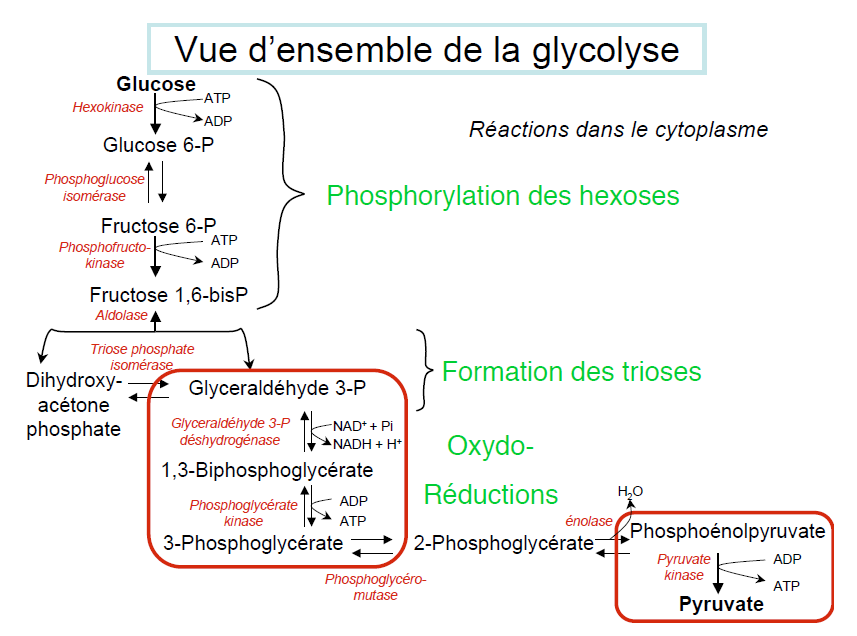
a) Les différentes étapes de la glycolyse
La glycolyse est composée de 10 grandes étapes, faisant intervenir 10 enzymes :
Réaction de transphosphorylation du glucose en glucose-6-phosphate catalysée par la glucokinase au niveau du foie ou par l’hexokinase au niveau des autres organes.
Cette réaction consomme une molécule d’ATP.
Réaction d’isomérisation du glucose-6-phosphate en fructose-6-phosphate catalysée par la 6-phosphohexose-isomérase.
Phosphofructokinase (PFK): la deuxième étape d’utilisation de l’ATP, la réaction est similaire à celle de l’hexokinase.
Attaque nucléophile du groupe C1-OH du F6P sur l’atome de phosphore γ de l’ATP complexé avec Mg++, pour donner du fructose 1-6 biphosphate.
La phosphofructokinase a un rôle très important dans la régulation de la glycolyse.
Cet enzyme forme la véritable étape d’admission dans la voie.
Réaction 4 : Aldolase– la scission du fructose (hexose) en deux trioses.
Réaction de dégradation du fructose-1,6-biphosphate en dihydroacétone-phosphate (DHAP) et en gycéraldéhyde-3-phosphate (GAP) catalysée par l’aldolase.
L’aldolase produit GAP et DHAP, mais seulement GAP est utilisé par les réactions suivantes:
il faut donc transformer DHAP en GAP: ce n’est pas trop difficile car ils sont des isomères.
Cette isomérisation est catalysée par triosephosphate-isomérase.
Réaction de phosphorylation du glycéraldéhyde-3-phosphate en 1,3-biphosphoglycérate catalysée par la glycéraldéhyde-3-phosphate-déshydrogénase.
Cet enzyme catalyse la première étape dans laquelle de l’énergie est extraite du substrat et stockée dans un co-facteur.
Dans ce cas-ci il s’agit de pouvoir réducteur et pas d’ATP.
En présence d’oxygène la respiration peut transformer l’énergie redox associée au NADH,H+ en énergie associée à la liaison phosphate de l’ATP.
La réaction d’oxydation de l’aldéhyde par le NAD+ est exergonique.
Elle est couplée à la réaction avec Pi qui forme une liaison à fort contenu d’énergie.
Cette liaison sera plus tard transférée à l’ADP pour former ATP.
L’enzyme phosphoglycérate-kinase (PGK) catalyse une réaction exergonique qui utilise comme substrat le 1,3 BPG pour réaliser la phosphorylation de l’ADP en ATP (réaction couplée).
Réaction de mutation du 3-phosphoglycérate en 2-phosphoglycérate catalysée par la phosphoglycéromutase.
Cette réaction est catalysée à travers l’intervention d’une forme phosphorylée de l’enzyme qui dans une première réaction phosphoryle la position 2 avec la formation d’un intermédiaire bisphosphorylé et puis récupère le groupe phosphate de la position 3.
Réaction de déshydrogénation du 2-phosphoglycérate en phosphoénolpyruvate catalysée par une phosphoénolpyruvate- hydratase ou énolase.
Cette réaction relargue une molécule d’H2O.
Dans la dernière étape de la chaîne, catalysée par la pyruvate-kinase, se forme du pyruvate et de l’ATP.
L’excès d’énergie est employé pour une phosphorylation au niveau du substrat.
Une molécule d’ATP est ainsi produite à partir de phosphate inorganique et ADP.
b) Bilan énergétique
La glycolyse peut être divisée en trois grandes parties :
Activation du glucose avec consommation d’énergie (2 ATP) :
Formation du glycéraldéhyde.
Synthèse du pyruvate et formation de molécules riches en énergie (4 ATP et 2 NADH, H+) :
Les deux premiers ATP du 1,3-Biphosphoglycérate au 3-Phosphoglycérate.
Les deux derniers ATP du phosphoénolpyruvate au pyruvate.
Les deux NADH, H+ du Glycéraldéhyde-3-phosphate au 1,3-Biphosphoglycérate.
Le bilan global de la glycolyse est :
Glucose + 2 ADP + 2 Pi + 2 NAD+ —–> 2 pyruvate + 2 ATP + 2 H2O + 2 NADH, H+
c) Régulation de la glycolyse
Dans les voies métaboliques, les enzymes qui catalysent des réactions irréversibles sont des sites potentiels de contrôle.
Au niveau de la glycolyse les enzymes sont régulés par trois mécanismes : les régulations par des effecteurs allostériques, les régulations par phosphorylations/déphosphorylation et l’expression des gènes de ces enzymes.
Au niveau de la glycolyse on met en évidence essentiellement trois réactions irréversibles :
La réaction de transphosphorylation du glucose en glucose-6-phosphate catalysée par la glucokinase ou l’hexokinase.
L’hexokinase est inhibée par le glucose-6-phosphate, stimulée par l’insuline et activée par l’excès d’hydrate de carbone.
Par contre la glucokinase est inhibée par le fructose-6-phosphate et activée par le glucose.
La réaction de transphosphorylation du fructose-6-phosphate en fructose-1,6-biphosphate catalysée par la 6-phosphofructokinase.
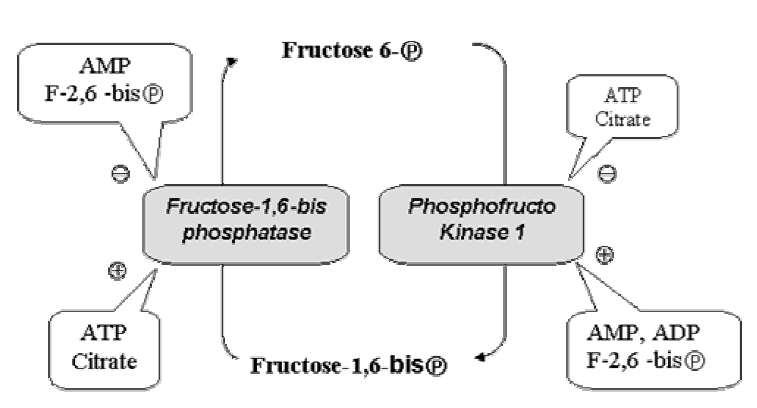
Cette enzyme est inhibée par l’ATP, le citrate, H+, le glucagon (foie) et l’adrénaline (muscle), et est activé par l’insuline et l’AMP,ADP, fructose-2-6-biphosphate(foie) et l’excès d’hydrate de carbone.
La réaction de transphosphorylation de l’acide phospho-énol-pyruvique en acide énol-pyruvique catalysée par la pyruvate-kinase.
Cette enzyme est inhibée par le pyruvate, l’alanine, l’ATP et le NADH,H+, citrate, AMPc, glucagon.
Activée par l’excès d’hydrate de carbone, fructose-1-6-biphosphate
Le F2, 6BP est un puissant activateur de la PFK-1 (sauf chez certains protistes pour lesquels il est activateur de la pyruvate kinase).
| Dans le foie, le F2,6BP est un inhibiteur de la fructose-1,6-bisphosphatase, une enzyme de la néoglucogénèse.Le citrate est un inhibiteur de la PFK-2 : il y a moins de F2,6BP synthétisé. Or ce dernier étant un activateur de la PFK-1, cela amplifie l’effet inhibiteur de la PFK-1 par le citrate. |
On retiendra globalement qu’il y a :
Inhibition de la glycolyse lorsque l’organisme est en excès d’énergie et donc par l’excès d’ATP, le citrate dont la concentration cytosolique augmente, le glucagon, l’adrénaline et l’acidose.
Activation de la glycolyse lorsque l’organisme est en déficit d’énergie et donc par l’excès d’ADP et d’AMP, l’insuline et l’alcalose.
Une alimentation équilibrée consiste, outre des protéines et des lipides, en environ 60% d’hydrates de carbone (polysaccharides).
Ceci souligne le rôle important de cette famille de molécules pour l’organisme animal.
Les hydrates de carbone permettent de produire de lénergie et des élèments de synthèse.
Ils ne sont pas essentiels et peuvent être interconvertis les uns dans les autres ou obtenus par synhèse de novo à partir d’autre composés.
Des carences temporaires peuvent ainsi être compensées sans probléme.
2) Comment utiliser d’autre sucres que le glucose dans la glycolyse ?
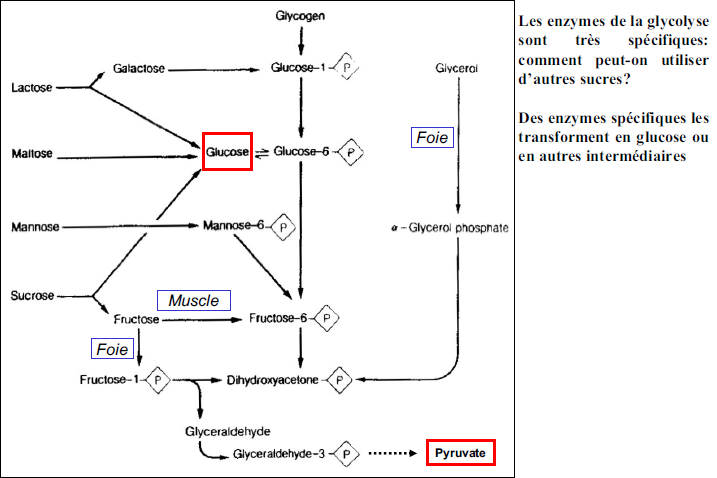
Métabolisme du fructose :
Comme l’absorption du fructose ne dépend pas de l’insuline, celui-ci est employé comme remplaçant de sucre chez les diabétiques.
La première phosphorylation conduit au fructose -1-phosphate et le fructose entre dans la glycolyse seulement au niveau du glycéraldéhyde- 3-phosphate; le gain énergétique est de 2ATP par molécule, comme dans le cas du glucose.
Une petite fraction du fructose traverse le foie et parvient non modifié dans le sang.
Le fructose est obtenu par hydrolyse du saccharose (le sucre de table, qui est un disaccharide de fructose et glucose) et il est présent lui-même dans de nombreux aliments (fruit, légumes, miel…)

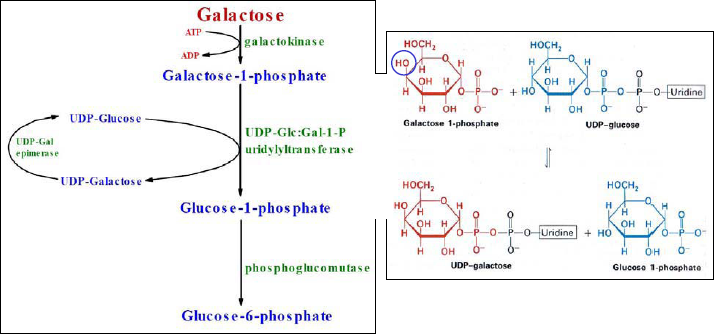
Métabolisme du galactose :
Il n’y a pas d’hydrate de carbone essentiels, tous peuvent être biosynthétisés.
Pour le fructose, le chemin réactionnel passe par le glucose et le sorbitol.
Le galactose, constituant du lactose (le sucre du lait), est nécessaire à la biosynthèse de multiples glycoprotéines et glycolipides.
Il est converti en UDP-galactose dans le foie et est utilisé sous cette forme comme élément de synthèse.
Pour servir de source d’énergie, l’UDP-galactose doit d’abord être converti en UDP-glucose (épimérisation).
Ce dernier entre ensuite dans la glycolyse.
Le galactose est obtenu par hydrolyse du lactose (le sucre du lait, qui est un disaccharide de glucose et galactose)
3) Métabolisme du pyruvate
Selon l’approvisionnement en dioxygène de la cellule, deux voies peuvent être empruntées.

| Cette réaction à la fonction de rendre disponible NAD+ pour la glycolyse quand on a besoin d’ATP, mais la vitesse de respiration n’est pas suffisante. C’est ce que se passe dans le muscle en mouvement anaérobie. Une activité lactate déshydrogénase suffisante pour éliminer le lactate n’existe que dans le foie et la musculature cardiaque. |

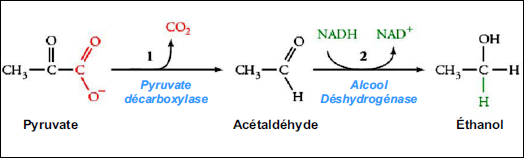
Cette réaction a aussi la fonction de rendre disponible NAD+ pour la glycolyse.
C’est ce que se passe chez la levure.
La thiamine est le coenzyme du pyruvate décarboxylase.
Le site actif de l’alcool déshydrogénase possède un ion zinc.

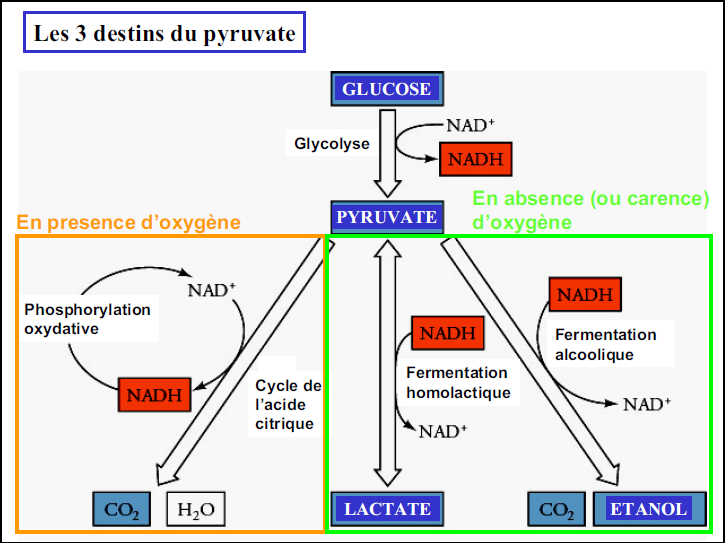
La respiration est 19 fois plus efficace que la glycolyse dans la production d’ATP.
Pourquoi donc la glycolyse?
•Parce que ça peut être 100 fois plus rapide dans la production d’ATP
•La glycolyse peut fournir de l’énergie en anaérobiose
•Ça est la première partie nécessaire pour l’oxydation complète du glucose qui fournit beaucoup d’énergie
Effet Pasteur: la levure utilise bien plus de glucose en anaérobiose qu’en aérobiose.
4) Le cycle de Krebs
La glycolyse canalise l`oxydation anaérobie du glucose vers le pyruvate, au-delà le cycle de l`acide citrique assure la relève aérobie.
Le lien entre la glycolyse et le cycle de l`acide citrique est la décarboxylation oxydative du pyruvate en Acétyl-COA qui se déroule dans la matrice mitochondriale, c’est une réaction irréversible catalysée par le complexe multienzymatique de la pyruvate déshydrogénase (PDH), qui se situe dans la mitochondrie à proximité des deux processus qui lui font suite: le cycle du citrate et la chaîne respiratoire.
Le pyruvate issu de la glycolyse diffuse à travers la membrane mitochondriale externe et parvient dans la matrice de la mitochondrie en franchissant la membrane interne via un symport à proton.
Là le complexe PDH est actif.
Il est composé de de trois enzymes: la pyruvate déshydrogénase (à ne pas confondre avec le complexe PDH), la dihydrolipoamide acétyltransférase et la dihydrolipoamide déshydrogénase.
Le transport du pyruvate dans la mitochondrie écarte le composé de l’équilibre cytosolique.
Une fois converti en acétyl-CoA, il n’y a alors plus de retour possible vers le glucose.
Lors de la première étape réactionnelle, le pyruvate se fixe à la pyruvate déshydrogénase et réagit avec son coenzyme, la thiamine pyrophosphate (TPP).
A cette occasion, un acétaldéhyde activé est formé par décarboxylation.
Il s’ensuit l’oxydation en radical acétyle grâce au lipoamide contenu dans le complexe PDH.
Au cours de cette oxydation, le radical acétyle est transféré sur un groupement thiol du lipoamide.
Le radical acétyle devient ainsi un thioester réactif qui est transféré sur le CoA par la dihydrolipoamide acétyltransférase.
Lors de cette succession de réaction, le groupement disulfure du lipoamide est devenu un groupement dithiol réduit.
Pour parachever le cycle réactionnel, une troisième enzyme, la dihydrolipoamide déshydrogénase, est indispensable.
Elle réoxyde le dithiol en disulfure en consommant du FAD.
Les électrons seront d’abord captés par le FAD et un pont disulfure catalytiquement actif de la sous-unité de la dihydrolipoamide déshydrogénase, avant d’être cédés au NAD+ dissous.
Pyruvate + NAD+ + CoA Acétyl-CoA + NADH + H+ + CO2
La conversion du pyruvate en acétyl CoA est régulée non seulement allostériquement, mais encore par phosphorylation réversible (interconversion).
Dans le premier cas, des composés mitochondriaux sont des effecteurs efficaces du processus de régulation.
La deuxième possibilité de régulation est la phosphorylation/ déphosphorylation de la PDH.
L’activité du complexe PDH est régulée par l’intermédiaire de deux enzymes: La PDH kinase phosphoryle une sous-unité du complexe PDH est la fait ainsi passé dans un état inactif.
Tous les composés qui activent la PDH kinase, et inhibent ce faisant le complexe PDH, sont caractéristiques d’un bon approvisionnement énergétique de la cellule.
A l’inverse, la PDH phosphatase déphosphoryle la sous unité et permet la production d’acétyl-CoA.
DCA= Dichloroacétate
| Inhibition par : | Activation par | |
| Allostériquement | ATP,NADPH,H+, acétyl- CoA | ADP, NAD+, CoA |
| Interconversion:PDH kinase (phosphorylation)b) PDH phosphatase (déphosphorylation) | Pyruvate | ATP,NADPH,H+ acétyl- CoACa2+, Mg2+ |
Le déroulement du cycle du citrate a été étudié par Hans Krebs qui a obtenu pour ce travail le prix Nobel en 1953.
Il l’a identifié comme étant la séquence réactionnelle cyclique la plus importante pour le catabolisme oxydatif des protéines, des lipides et des hydrates de carbone.
Le cycle de Krebs (ou cycle tricarboxylique ou cycle de l’acide citrique) est la plateforme énergétique de la cellule, continuant le catabolisme des glucides après la glycolyse.
Il se réalise dans la matrice mitochondriale et se fait exclusivement en aérobie.
Attention, les érythrocytes (globules rouges) ne possèdent pas d’organites et donc pas de mitochondrie qui est indispensable à la réalisation du cycle de Krebs.
De cette manière ils utilisent uniquement l’énergie produite par la glycolyse, le pyruvate sera quant à lui transformé en acide lactique.
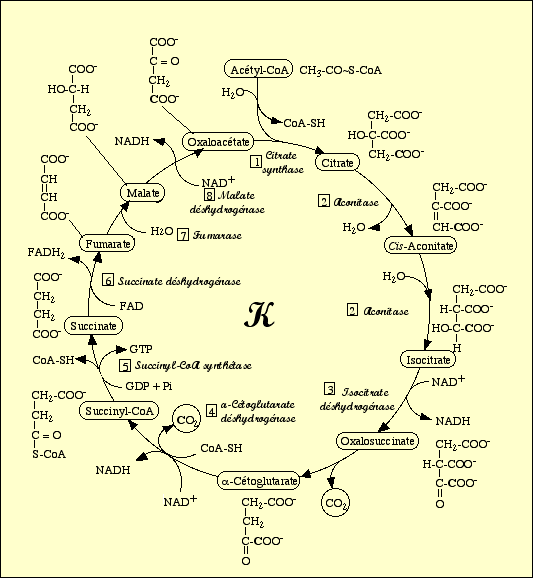
a) Les différentes étapes du cycle de Krebs
Le cycle est composé de 9 grandes étapes, faisant intervenir 8 enzymes :
Réaction de condensation de l’acétylcoenzyme A (ACoA) et de l’oxaloacétate en citrate catalysée par la citrate-synthase.
Cette réaction nécessite une molécule d’H2O et relargue une molécule de CoA-SH.
Réaction d’isomérisation du citrate en isocitrate catalysée par l’aconitase.
Réaction de déshydrogénation de l’isocitrate en oxalosuccinate catalysée par l’isocitrate-déshydrogénase.
Cette réaction permet la formation de NADH, H+ à partir de NAD+.
Réaction de β-décarboxylation non oxydative de l’oxalosuccinate en α-cétoglutarate.
Cette réaction entraîne un dégagement de CO2.
Réaction de α-décarboxylation oxydative de l’α-cétoglutarate en succinyl-CoA catalysée par l’α-cétoglutarate-déshydrogénase.
Cette réaction nécessite une molécule de CoA-SH et entraîne un dégagement de CO2 ; elle permet également la formation de NADH, H+ à partir de NAD+.
Réaction de transphosphorylation du succiny-CoA en succinate catalysée par la succinate-thiokinase.
Cette réaction nécessite une molécule de phosphate et relargue une molécule de CoA-SH ; elle permet également la formation de GTP à partir de GDP.
Réaction de déshydrogénation du succinate en fumarate catalysée par la succinate-déshydrogénase.
Cette réaction permet la formation de FADH2 à partir de FAD.
Réaction d’hydratation du fumarate en malate catalysée par la fumarase.
Cette réaction nécessite une molécule d’H2O.
Réaction de déshydrogénation du malate en oxaloacétate catalysée par la malate-déshydrogénase.
Cette réaction permet la formation de NADH, H+ à partir de NAD+.
b) Bilan du cycle de Krebs
Comme dit précédemment, en aérobie l’acétylcoenzyme A entre dans le cycle de Krebs.
Un tour de cycle, c’est-à-dire l’utilisation d’une molécule d’acétylcoenzyme A permet la formation :
3 NADH, H+ qui permettront théoriquement la formation de 3 ATP chacun au niveau de la chaîne respiratoire (2,5 ATP en réalité), et donc au total la formation de 9 ATP (7,5 ATP en réalité).
1 FADH2 qui permettra théoriquement la formation de 2 ATP au niveau de la chaîne respiratoire (1,5 ATP en réalité).
1 ATP.
acétyl CoA + 3 NAD+ + coenzyme Q + GDP (ou ADP) + Pi + 2 H2O —> CoASH + 3 NADH + coenzyme QH2 + GTP (ou ATP) + 2 CO2 + 2 H+
De cette manière une molécule d’acétylcoenzyme A permet la formation théorique de 12 ATP (10 ATP en réalité).
c) Régulation du cycle de Krebs
Trois réactions du cycle de Krebs sont irréversibles.
Ces réactions sont catalysées par des enzymes à régulation allostérique.
Pour ces 2 raisons (énergétique et catalytique), ces trois réactions constituent des points de contrôle du flux global du cycle de Krebs.
Ces enzymes sont :
le citrate synthase qui catalyse la première réaction du cycle de Krebs. le citrate inhibiteur compétitif de l´oxaloacetate,
l’isocitrate déshydrogénase.
Cette enzyme est inhibée par l’excès d’ATP et NADH+ et activée par le NAD et le FAD.
Exemple dans le cas de Esherichia coli : l’enzyme est régulée par [phosphorylation – déphosphorylation] catalysée par une kinase /phosphatase bifonctionnelle.
le complexe de l’α-cétoglutarate déshydrogénase qui catalyse une réaction, analogue à celle du complexe de la pyruvate déshydrogénase.
Cette enzyme est activée par le calcium.
Elle est inhibée par le succinyl-CoA et le NADH.
D’autre part la régénération d’oxaloacétate est nécessaire pour que le cycle de Krebs fonctionne à flux constant.
En effet l’oxaloacétate joue un rôle dans un certain nombre de métabolisme, son apport régulier au cycle de Krebs est permis par les acides aminés.
Le cycle de Krebs est d’une part un carrefour du métabolisme énergétique et d’autre part le point de départ de nombreuses biosynthèses : acides aminés, glucose, hème, acides gras et cholestérol.
Certain acides aminés peuvent être synthétisés à partir des acides α-cétoniques correspondants. Cette réaction est catalysée par des transaminases.
Le glutamate est ainsi produit par transamination à partir de l’α-cétoglutarate.
L’oxaloacétate peut être utilisé par la gluconéogenèse en cas de carence en glucose.
Via la navette malate, il passe de nouveau de la mitochondrie vers le cytoplasme pour y être dégradé en phosphoénolpyruvate.
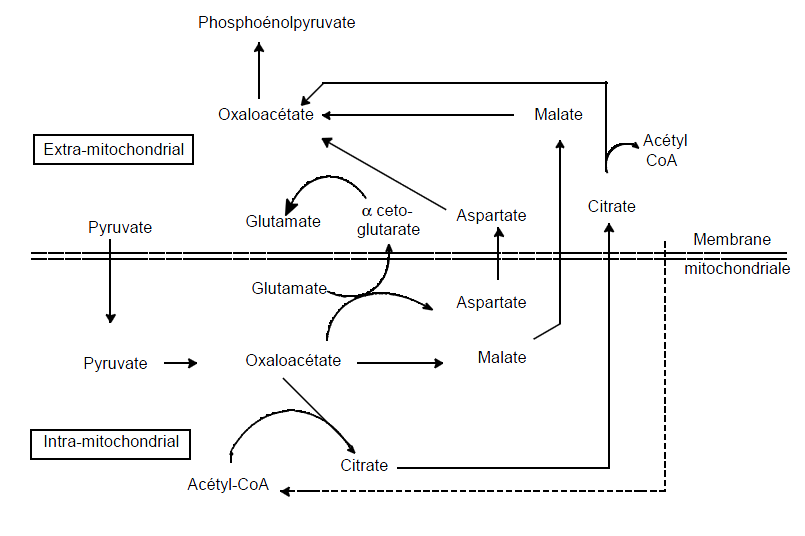
La synthèse des acides gras et du cholestérol repose aussi sur l’acétyl-CoA.
Toutefois, comme ces deux synthèse ont lieu dans le cytoplasme, un système de transport doit intervenir.
Pour ce faire, un détour par le citrate est nécessaire.
L’acétyl-CoA est transformé en citrate après réaction avec l’oxaloacétate.
Un transporteur d’acides tricarboxyliques fait ensuite passer le citrate de la mitochondrie vers le cytoplasme.
Là, il est à nouveau décomposé en oxaloacétate et acétyl-CoA et peut ainsi participer aux deux synthèses.
L’oxaloacétate est alors réduit en malate et, via la navette malate, transporté vers la mitochondrie.
L’acide δ-aminolévulinique, précurseur de l’hème, est synthétisé à partir du squelette en C4 du succinyl-CoA et de laglycine.
Ceci se passe encore à l’intérieur de la mitochondrie, la suite de la synthèse de l’hème a toutefois lieu dans le cytoplasme.
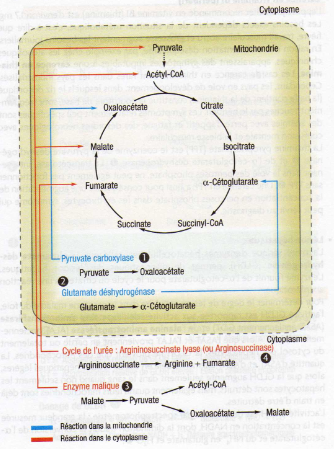
Réactions anaplérotiques :
Quand des composés intermédiaires sont continuellement retirés du cycle du citrate, celui-ci doit à nouveau être réapprovisionné.
Des réactions anaplérotiques assurentla continuité du cycle.
Elles permettent d’éviter un manque de composés intermédiaires dans la mesure où elles contribuent à fournir les composés correspondants.
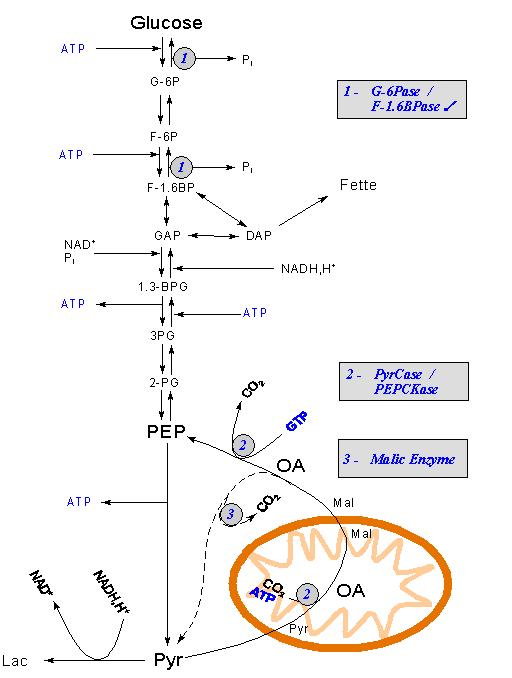
Une de ces réactions anaplérotiques est catalysée par la pyruvate carboxylase. Elle est à la croisée de la gluconéogenèse et du cycle du citrate.
Lors de cette réaction, le pyruvate est transformé en oxaloacétate qui selon les besoins set, soit à la synthèse de glucose, soit à la production d’énergie dans le cycle du citrate.
Des manques en α-cétoglutarate peuvent être compenses par la glutamate déshydrogénase.
Celle-ci catalyse la désamination du glutamate.
Ce faisant le glutamate est oxydé en α-cétoglutarate.
La réduction associée produit de l’ammoniac et du NADH, H+.
Des composés intermédiaires peuvent également parvenir au cycle du citrate depuis le cytoplasme.
L’enzyme malique produit du pyruvate à partir du malate par décarboxylation.
Le pyruvate parvient dans la mitochondrie grâce à un symport à protons.
Là, il est soit décarboxylé en acétyl-CoA, soit transformé en oxaloacétate pour redonner du malate par action de la malate déshydrogénase.
Chacun des composés intermédiaires peut à nouveau prendre part au cycle du citrate.
Le fumarate, est produit lors de la synthèse de l’urée à partir d’ammoniac et d’aspartate.
Au cours du cycle de l’urée, l’aspartate réagit avec la citrulline pour former l’arginosuccinate.
Le fumarate est libéré lors de la transformation de l’arginosuccinate en arginine.
Cette réaction a lieu dans le cytoplasme.
III) Bilan énergétique du catabolisme glucidique
1) En anaérobie
Bilan de la glycolyse : formation de 2 ATP et de 2 NADH, H+ (qui seront utilisés dans la formation du lactate).
2) En aérobie
Bilan de la glycolyse : formation théorique de 8 ATP.
Bilan du catabolisme du pyruvate : formation de 3 ATP par molécule de pyruvate en théorie et donc de 6 ATP en théorie pour une molécule de glucose.
Bilan du cycle de Krebs : en théorie 12 ATP par molécule d’acétylcoenzyme A et donc en théorie 24 ATP pour une molécule de glucose.
Le bilan global théorique de la dégradation d’une molécule de glucose en aérobie est donc de 38 ATP qui ne sont pas immédiatement mobilisable car la majorité des ATP formés proviennent de la phosphorylation oxydative.
Il est important de préciser ici que certains ouvrages parlent d’un bilan global théorique de 36 ATP ; cette différence est explicable par le type de navette utilisée (Phosphorylation oxydative).
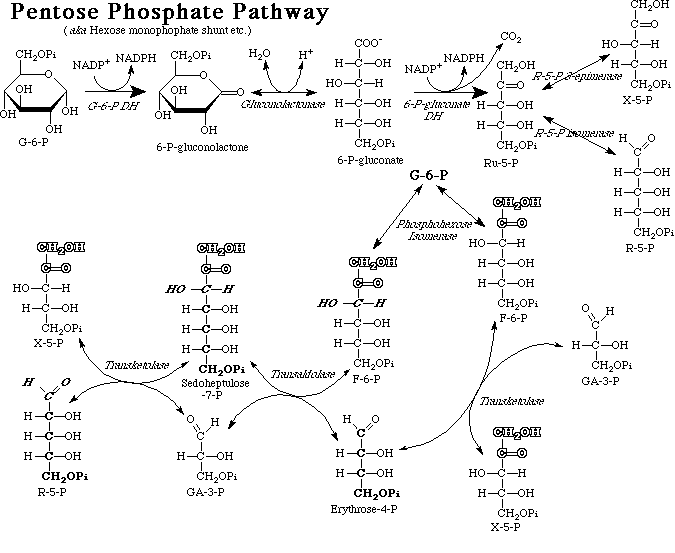
5) La voie des pentoses-phosphates
Le cycle des pentoses-phosphates (ou voie du phosphogluconate) est une voie de dégradation du glucose, se réalise en parallèle à la glycolyse et permet la formation de NADPH, H+ pour les réactions de biosynthèse(en particulier, lors de la synthèse des acides gras et des stéroïdes).
Cette voie est présente essentiellement dans le cytosol des cellules des glandes mammaires, du tissu adipeux, du foie et du cortex surrénal.
Outre le NADPH, la voie des pentoses phosphates produit du ribose 5-phosphate précurseur de la synthèse des nucléotides, des acides nucléiques et de coenzymes.
Le glucose 6-phosphate est à la fois le substrat de la voie des pentoses phosphates et celui de la glycolyse ; le choix relatif entre ces deux voies dépend des exigences cellulaires ponctuelles en énergie métabolique (ATP) et en précurseurs biosynthétiques.
La voie des pentoses phosphates se divise en deux parties :
– un segment oxydatif irréversible,
– un segment non oxydatif réversible.
Le segment oxydatif
Le glucose 6-phosphate est transformé en ribulose 5-phosphate avec production de deux NADPH et d’un CO2.
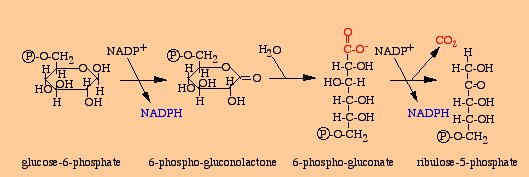
La première étape est une réaction d’oxydo-réduction catalysée par la glucose 6-phosphate déshydrogénase, la deuxième est une hydrolyse catalysée par une gluconolactonase.
La troisième, catalysée par la 6-phosphogluconate déshydrogénase, est une réaction d’oxydo-réduction suivie d’une décarboxylation spontanée.
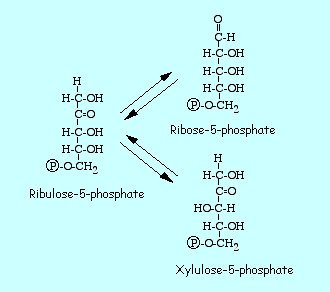
Le segment non oxydatif
Ce segment débute par une interconversion (isomérisation et épimérisation) des pentoses phosphates.
Epimerisation du ribulose 5-phosphate en xylulose 5-phosphate : on est parti de 3 molécules de ribulose 5P, deux de ces molécules vont être épimerisées par une phosphopentose épimerase.
Isomérisation du ribulose 5-phosphate en ribose 5-phosphate : ribulose 5-P restant sera isomérisé par une phosphopentose isomerase en un ribose 5P.
Il existe un équilibre entre les trois pentoses phosphates.
Réaction de transcetonisation: C`est la rupture entre deux carbones du xylulose 5P suivie d`un transfert du radical glyco aldehyde (CH2OH-CHO) sur une molécule de ribose5P.
L`enzyme qui catalyse cette réaction : Transcétolase dont le coenzyme TPP (thiamine pyro phosphate).
Réaction de transaldonisation: La transaldolase catalyse la réaction qui détache les 3 premiers atomes de carbones du sédoheptulose qui forment une molécule de dihydroxy acétone et la transporte sur le 3P-glyceraldehyde qui sera transformé en Fructose 6P.
Seconde réaction de transcetonisation : la transcetolase transfère un glycol aldéhyde du xylulose 5P sur l`érythrose 4P pour former un fructose 6P et le 3P glycéraldéhyde.
Isomérisation du Fructose 5P en Glucose 6P : la phosphohexose isomérase transforme les deux molécules de Fructose 6P formées en 2 glucose 6P.
Donc sur 3 molécules dont nous somme parti deux sont reconstituées, une seul a disparu.
Bilan du cycle :
3 G6P + 6NADP+ —–> 3P Glyceraldehyde + 2Fructose 6P + 3 CO2 + 6NADSPH + 6H+
2Fructose 6P —–> 2Glucose 6P
—–> 1 G6P + 6NADP+ —–> 3CO2 +3P glyceraldehyde + 6NADPH,H+
Apres un tour de cycle tout se passe comme si la moitié de la molécule de Glucose était oxydée en CO2, il y a décarboxylation de 3 molécules de glucose 6P et reconstitution de 2 molécules.
Si on part de 6 molécules de Glucose, soumise aux enzymes du cycle on aura outre le CO2 et NADPH2 deux P glycéraldéhyde dont une molécule sous l`action d`une phosphate isomérase se transforme en PDHA.
Le PDHA et le PGA constituent une molécule de Glucose 6P.
Ainsi 4 molécules de Glucose 6P sont reconstituées à la fin du cycle, un seul glucose a disparu —–> G6P +12NADP —–> 6CO2 +12NADPH, H+
Donc en 2 tours de cycle l`équivalent d`une molécule de glucose est totalement oxydée, il s`est forme 12NADPH, H+ et 6CO2.
Régulation :
La régulation de la voie des pentoses phosphate se limite à la première partie oxydative.
La concentration cytoplasmique en NADP+ sert de contrôle.
Pour les réactions réversibles, la synthèse est dirigée dans le sens qui convient par les équilibres chimiques.
Glucose -6-phosphate déshydrogénase : Inhibée par NADPH, H+.
Phosphogluconate déshydrogénase Inhibée par l’Acétyl-CoA
La voie des pentoses phosphates est particulièrement importante pour les érythrocytes.
Ils utilisent le NADPH, H+ qu’ils ont produit pour régénérer le piège à radicaux libre qui est le glutathion.
Sa fonction est de protéger les groupements thiol de l’oxydation en disulfure.
Les membranes des érythrocytes sont ainsi préservées d’une dégradation prématurée.
IV) Anabolisme glucidique : néoglucogenèse (ou gluconéogenèse)
En cas de carence en glucose, notre organisme est capable de fabriquer ce composé.
Ce processus est appelé la gluconéogenèse.
Ce sont avant tout l’alanine et le lactate qui servent de précurseurs.
Durant les phases de jeûne se rajoute le glycérol issu du catabolisme des graisses.
Les besoin en glucose sont normalement couverts par l’alimentation ou les réserves hépatiques en glycogène.
Comme le cerveau et les érythrocytes sont obligatoirement dépendants d’un apport suffisant en glucose, la gluconéogenèse entre déjà en jeu après huit heures de sommeil.
Le foie tire l’énergie nécessaire à la gluconéogenèse à partir de la β-oxydation des acides gras.
Pour produire une molécule de glucose, 6 ATP sont nécessaires.
Si les précurseurs sont l’oxaloacetate ou le glycérol, les besoins se réduisent à, respectivement, 4 et 2 ATP.
Dans le meilleur des cas, le bilan énergétique jusqu’au pyruvate est ainsi équilibré.
La néoglucogenèse est l’inverse de la glycolyse, en effet elle permet la production de glucide et ceci à partir de précurseurs non glucidiques.
Elle est réalisée au niveau du cytosol, majoritairement au niveau du foie mais également au niveau du rein (principalement à partir d’acides aminés).
1) Les précurseurs
Les précurseurs non glucidiques sont de différents types :
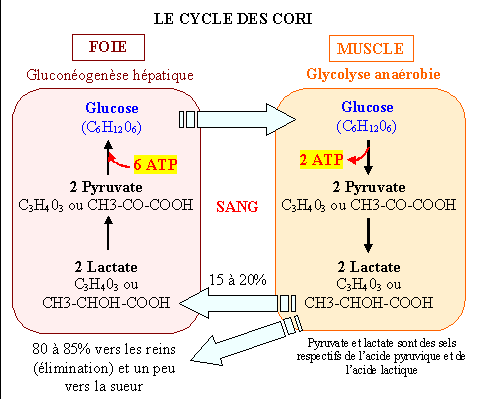
le lactate présent dans le sang est transformé en pyruvate.
Il provient du métabolisme anaérobie des muscles et des érythrocytes, qui sont eux-mêmes incapables de réaliser la gluconéogenèse.
Cette voie est également appelée cycle de Cori en référence à son découvreur.
Le cycle commence avec le glucose hépatique qui est dégradé de façon anaérobie en lactate dans les muscles (🡪glycolyse).
Le lactate revient au foie par le sang et redonne du glucose par la néoglucogenèse.
les acides-aminés glucoformateurs provenant de l’alimentation et de la dégradation des protéines des muscles squelettique.
Parmi eux on compte l’alanine (pour 40 à 60%), la sérine, la cystéine, la thréonine, la glycine, la tyrosine, la phénylalanine et l’isoleucine.
Convertis en pyruvate dans le foie par des transaminases.
les corps cétoniques.
le glycérol provenant de la dégradation des triglycérides au niveau des cellules adipeuses.
Ces précurseurs sont tout d’abord convertis en des intermédiaires de la glycolyse : le pyruvate pour le lactate, les acides aminés et les corps cétonique ; le dihydroacétone pour le glycérol.
2) Réactions de la néoglucogenèse :
La plupart des étapes qui conduisent du pyruvate au glucose sont catalysées par les enzymes de la glycolyse qui interviennent en sens inverse (réactions réversibles).
Les trois réactions irréversibles sont remplacées par d’autres réactions à équilibre thermodynamique plus favorable et catalysées par des enzymes spécifiques de la néoglucogenèse.
Le démarrage de la néoglucogenèse exige la conversion du pyruvate en phosphoénolpyruvate.
Deux pyruvates sont nécessaires pour faire un glucose.
2.1 –Transformation du pyruvate en phosphoenolpyruvate
C’est la première étape.
Elle ne peut être réalisée par l’action de la pyruvate kinase selon la réaction suivante.
2 Pyruvate + 2 ATP 2 Phosphoénolpyruvate + 2 ADP
Pour obtenir cette phosphorylation du pyruvate il y a coopération entre la mitochondrie et le cytosol.
2.1.1 – Phase mitochondriale
Le pyruvate, exporté dans la mitochondrie, est d’abord carboxylé par la pyruvate carboxylase, située dans la matrice.
L’enzyme est une ligase à biotine.
L’ATP est nécessaire.
La pyruvate carboxylase se rencontre dans les mitochondries du foie et des reins mais pas dans celles des muscles.
2 Pyruvate + 2 CO2+ 2 ATP 2 oxaloacétate + 2 ADP + 2 Pi
L’oxaloacétate formé est réduit en malate par la malate déshydrogenase mitochondriale.
Le malate est ensuite transporté de la mitochondrie dans le cytosol.
2 Oxaloacétate + 2 NADH,H+ 2 malate + 2 NAD+
2.1.2 – Phase cytosolique
Le malate est réoxydé en oxaloacétate par la malate déshydrogénase cytosolique.
Malate DH
2 Malate + 2 NAD+ 2 Oxaloacétate + 2 NADH,H+
Enfin l’oxaloacétate est transformé en phosphoénolpyruvate, suivant une réaction réversible en présence du GTP par la phosphoénolpyruvate carboxykinase (PEPcarboxykinase), enzyme spécifique de la néoglucogenèse.
2 Oxaloacétate + 2 GTP 2 PEP + 2 GDP + 2 CO2
En résumé la réaction globale de la transformation du pyruvate en phosphoénolpyruvate est :
2 Pyruvate + 2 ATP + 2 GTP 2 PEP + 2 ADP + 2 GDP + 2 Pi
2.2 – Transformation du phosphoenolpyruvate en fructose-1,6- bi P
La séquence des réactions qui vont conduire du PEP au glucose est cytosolique.
La transformation du phosphoénolpyruvate en furctose-1,6-bi-P est réalisée par la séquence des réactions glycolytiques réversibles, fonctionnant en sens inverse.
2 PEP + 2 H2O 2 glycérate 2- (Enolase)
2 glycérate 2-2 glycérate 3-(Phosphoglycérate mutase)
2 Glycérate 3-+ 2 ATP 2 (3-glycéroyl 1-) + 2 ADP (Glycérate 3-kinase)
2(3-glycéroy11-) + 2 NADH,H+2 glycéraldéhyde 3-+ 2 Pi +2 NAD+ (glycéraldéhyde 3-DH)
1 glycéraldéhyde-3-1 dihydroxyacétone-3-(Phosphotriose isomérase)
3-glycéraldéhyde + 3-dihydroxyacétone Fructose-1,6-bis (Aldolase 1)
Le bilan global de la séquence est le suivant :
2 PEP + 2 H2O + 2 ATP + 2 NADH,H+ Fructose-1,6-biP + 2 ADP + 2 Pi + 2 NAD+
2.3 – Transformation Du Fructose 1-6 Bisphosphate En Glucose
Une séquence de 3 réactions, dont une réversible, conduit au glucose.
2.3.1 – Déphosphorylation du fructose-1,6-bisen fructose 6-
On connaît la réaction qui transforme le fructose 6-phosphate en fructose 1-6 bis.
Cette réaction qui est catalysée par la phosphofructokinase 1 (transférase) est irréversible.
La réaction inverse qui enlève le groupement phosphate est catalysée par la fructose-1,6 bisphosphatase (FBP1), enzyme clé et site de régulation principal de la voie.
Fructose-1,6-bis+ H2O fructose 6- + Pi
2.3.2 – Isomérisation du fructose 6-en glucose 6-
La réaction est catalysée par la phosphogluco-isomérase (PGI)
Fructose 6-glucose 6-
2.3.3 – Déphosphorylation du glucose 6-en glucose
Le départ du groupement phosphate du glucose 6-est effectué par une hydrolase : glucose 6-phosphatase dont l’importance est fondamentale dans le maintien de la glycémie.
On la trouve dans le foie et dans les reins mais pas dans les muscles striés.
glucose 6-+ H2O glucose + Pi
2.4 – Bilan
Le bilan de la formation du glucose à partir de 2 pyruvate est le suivant :
2 pyruvate + 4 ATP+ 2 GTP+ 2 NADH,H+ Glucose + 4 ADP + 2 GDP + 6 Pi+ 2 NAD+
Sur le plan énergétique la synthèse du glucose consomme 4 ATP + 2 GTP soit l’équivalent de 6 liaisons phosphates riches en énergie.

3 – Régulation:
La glycolyse et la néoglucogenèse sont réciproquement régulées de telle sorte qu´une voie est relativement inactive alors que l´autre est pleinement active.
-AMP et Fructose 1,6 bi Phosphate activent la PFK(I)activation de la glycolyse et inhibition de la néoglucogenèse.
-Fructose 2,6 biP inhibe la Fructose 1,6 bi Phosphatase.
V) Réserve glucidique & métabolisme du glycogène
Le glycogène est constitué :
de chaînes de résidus glucose reliées par une liaison α-1,4 ;
les chaînes sont reliées entre elles par des branchements α-1,6.
1) Glycogénolyse
a) Tissus impliqués
La glycogénolyse est la réaction inverse de la glycogénogenèse et se réalise principalement dans le foie et dans les muscles, mais à des fins différentes :
Le foie joue un rôle dans le maintien de l’homéostasie, et ceci grâce à différentes caractéristiques:
La présence de transporteurs du glucose insulinodépendants,
La présence de récepteurs au glucagon,
La présence de l’enzyme glucose-6-phosphatase.
Cette dernière enzyme donne la caractéristique du foie d’être le seul à pouvoir libérer en quantité du glucose dans le sang.
Les muscles stockent le glucose pour une utilisation ultérieure.
En effet ils ne peuvent en aucun cas reverser du glucose dans le sang pour d’autres organes, ne possédant pas la glucose-6-phosphatase permettant le retour au glucose et les transporteurs membranaires étant spécifiques du glucose ne permettent pas le passage de glucose-6-phosphate.
De cette manière tout le glucose entrant dans les muscles est strictement utilisé par les muscles.
b) Etapes de la glycogénolyse
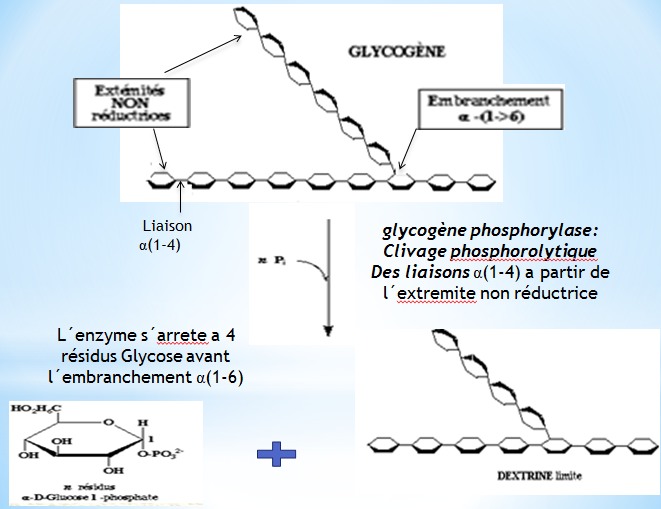
Les résidus glucose du glycogène sont clivés par la glycogène phosphorylase à partir de l’extrémité NON réductrice du glycogène.
1 – Phosphorolyse du glycogène
La phosphorolyse proprement dite est catalysée par la glycogène phosphorylase.
Cette enzyme coupe la liaison (1-4) à partir de l’extrémité non réductrice et fixe, sur le carbone 1 du glucose libéré, un groupement phosphate, apporté par Pi, en donnant du glucose 1-.
La phosphorolyse est répétée de façon séquentielle sur le glycogène jusqu’à 4 résidus Glycosyl sur chaque chaîne avant l´embranchement (1-6).
La structure résiduelle est appelée dextrine limite, résistant à l’action plus poussée de la phosphorylase.
2 – Glycosyl-4,4-transférase
La glucosyl-4,4-transférase intervient sur la dextrine limite en enlevant sur chaque chaîne de la dextrine limite un oligosyle formé de 3 résidus glucose pour aller allonger une autre chaîne de la dextrine limite permettant ainsi la reprise de la phosphorolyse sur cette chaîne.
Après l’action de cette enzyme il demeure à la place de la chaîne latérale un glucose lié par la liaison (1-6).
3 – (1- 6) Glucosidase)
Enfin une -glucosidase hydrolyse les résidus glucose reliés par la liaison (1-6) et libère le glucose.
Après l’action de ces trois enzymes le glycogène libère essentiellement du glucose 1- (par phosphorolyse) et une faible quantité de glucose (hydrolyse).
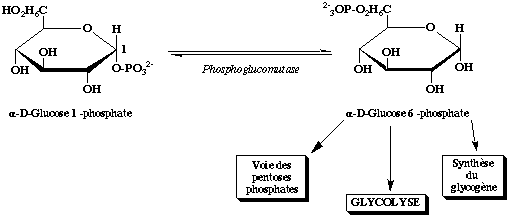
Le glucose1-est isomérisé en glucose-6-par la phosphoglucomutase.
Le glucose 6-peut entré dans la glycolyse dans le foie et dans le muscle.
Mais l’objectif de la dégradation du glycogène hépatique est avant tout le maintien de la glycémie.
Pour ce faire seul le foie, après dégradation du glycogène, dispose de la glucose 6-phosphatase, permettant l’hydrolyse du glucose 6-en glucose et l’excrétion de ce dernier dans le sang.
Les deux réactions catalysées sont les suivantes :
Glucose 1-Glucose 6-(Phosphoglucomutase)
Glucose 6-+ H2O Glucose + Pi (Glucose 6-phosphatase)
2.2 – Dégradation lysosomale du glycogène
Une faible quantité du glycogène est dégradée par une (1-4)glucosidase lysosomale.
Le rôle de cette dégradation est inconnu.
Mais une déficience en cette enzyme provoque une accumulation du glycogène dans les vacuoles, et constitue une véritable maladie du stockage du glycogène du type II (Maladie de POMPE).
2) Glycogénogenèse
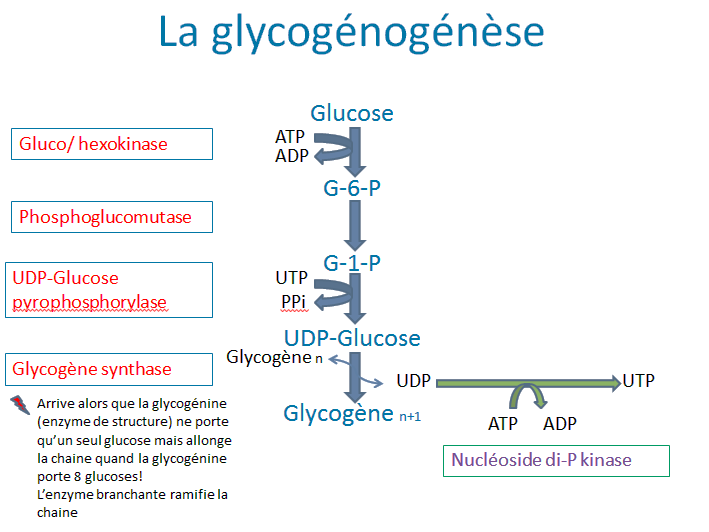
La glycogénogenèse correspond au stockage du glucose sous forme d’un polysaccharide (polymère de glucose), appelé le glycogène.
La synthèse du glycogène se réalise au niveau du cytosol par un enzyme appelée la glycogène-synthase.
Le glucose est tout d’abord phosphorylé pour donner le glucose-6-phosphate qui sera isomérisé en glucose-1-phosphate, lui-même activé par de l’UTP (uridine triphosphate) entraînant la formation d’UDP-glucose ; ces deux premières étapes consomment 2 ATP.
Une fois activés les UDP-glucoses se lient les uns après les autres à la chaîne en voie d’élongation (près existante ; Oglio saccharide contenant au moins 4 résidus, attaché à une protéine).
La glycogène synthase qui assure la formation de la liaison (1-4) est une enzyme d’élongation et ne peut initier de novo la synthèse du glycogène à partir du glucose.
Il faut un primer (ou une amorce) qui peut être obtenu de différentes façons :
utilisation d’un fragment de glycogène sous forme de dextrine
En l’absence de ce fragment, intervention d’une protéine spécifique : la glycogénine. Elle possède une chaîne latérale de tyrosine qui sert d’accepteur, grâce à sa fonction -OH, au premier résidu glucosyl provenant de l’UDPglucose.
La formation de la première liaison osidique est catalysée par une glycogène synthase initiatrice.
La glycogénine, elle-même, peut rajouter quelques unités glucose liées par des liaisons (1-4) pour terminer le primer (8 unités de glucose).
A tous les 8 résidus glucose sur la chaîne linéaire synthétisée par la glycogène synthase, se forme une branche donnant au glycogène une structure fortement ramifiée, ce qui accroît le nombre d’extrémités non réductrices, favorables à l’activité de la glycogène phosphorylase au moment de la mobilisation des réserves glycogéniques.
Cette ramification lui assure aussi une solubilité très grande par rapport à l’amylose qui possède une structure uniquement linéaire.
Les ramifications sont assurées par une enzyme branchante : amylo(α-1,4 α -1,6) transglycosylase ou glycosyl(4,6)transférase. Elle prélève un oligoside de 5 à 8 résidus glucose de l’extrémité non réductrice de la chaîne en élongation et l’attache sur un résidu glucosyle de la chaîne principale par une liaison α (1-6).
Cette réaction de branchement a deux conséquences sur le glycogène :
L’augmentation de la solubilité.
L’augmentation du nombre de résidus terminaux permettant un recrutement plus rapide des unités glucidique lors d’un besoin énergétique.
3) Régulation des réserves de glycogène
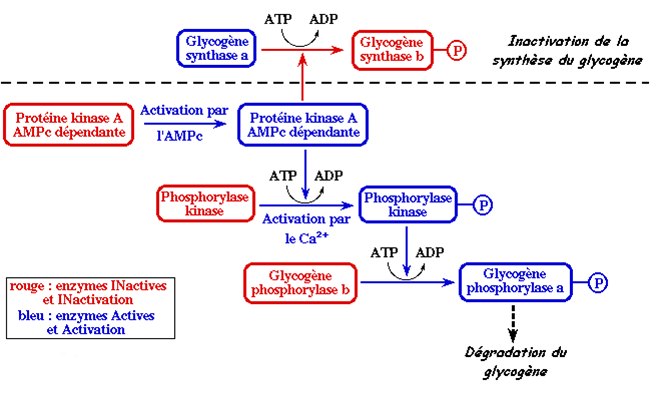
La glycogénolyse et la glycogénogenèse sont des mécanismes inverses et alternatifs qui sont dirigés par des signaux régulateurs importants qui lorsqu’ils activent l’un, ils inhibent l’autre.
La glycogénolyse et la glycogénogenèse ne peuvent donc pas avoir lieu en même temps.
a) Le glucagon et les catécholamines
En effet, les catécholamines (adrénaline) au niveau des muscles et le glucagon au niveau du foie entraînent l’activation de protéines kinases qui auront deux fonctions différentes mais complémentaires :
La phosphorylation de la glycogène-synthase active pour la désactiver, stoppant ainsi la glycogénogenèse.
La phosphorylation de la phosphorylase-kinase inactive pour l’activer, déclenchant ainsi la glycogénolyse.
b) L’insuline
L’insuline aura un effet inverse au niveau du foie et ceci en agissant à différent niveau de la mise en réserve du glucose sous forme de glycogène :
L’insuline et l’augmentation de glucose (et donc de glucose-6-phosphate) entraîne l’activation de la glucokinase (foie), induisant une diminution de la glycémie.
On note que l’hexokinase, qui a la même fonction catalytique que la glucokinase, est moins spécifique d’un tissu et est inhibée par le glucose-6-phosphate.
L’insuline entraîne l’activation de phosphatases qui auront deux fonctions différentes mais complémentaires :
La déphosphorylation de la glycogène-synthase inactive pour l’activer, déclenchant ainsi la glycogénogenèse.
La déphosphorylation de la phosphorylase-kinase active pour la désactiver, stoppant ainsi la glycogénolyse.
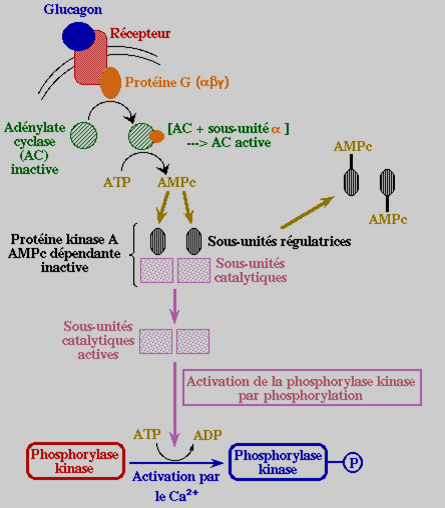
Cascades de réactions amenant à la dégradation du glycogène
Clinique
Trouble liée au métabolisme
Diabète sucré
L’insuline produite dans le pancréas provoque une diminution de la glycémie, en particulier en agissant sur la musculature squelettique, le tissu adipeux et le foie.
En cas de diabète sucré, il existe une carence absolue (type 1) ou relative (type 2) en insuline.
La régulation du glucose sanguin est perturbée.
Dans le cas extrême, la concentration en glucose augmente jusqu’à des valeurs de 400-1000 mg/dl (valeur normales: 80-100 mg/l).
De ce fait, davantage de protéines et de graisses sont dégradées et il y a une énorme perte en liquide et en électrolytes.
Pour le type 1, la thérapie repose sur l’injection parentérale d’insuline humaine produite par génie génétique.
Pour le type 2, en raison de la résistance des tissus à l’insuline, alimentation et activité physique sont déterminantes en plus des antidiabétiques oraux et de l’insuline.
Anémie hémolytique (exemple du déficit en glucose-6-phosphate déshydrogénase)
Un défaut dans le gène de la glucose-6-phosphate déshydrogénase se manifeste par une anémie hémolytique.
Dans les érythrocytes, le déficit d’équivalents réducteurs (NADPH,H+) entraîne une diminution de la formation de glutathion réduit, qui protège les érythrocytes des agents oxydants.
Les membranes des érythrocytes vieillissent très vite, ce qui conduit en définitive à la destruction des globules rouges.
Aucun traitement spécifique n’est possible, mais les crises hémolytiques peuvent être évitées en informant le patient et en évitant et en évitant les facteurs déclenchants.
Galactosémie
Une galactosémie (incidence 1:55000) correspond à une perturbation du catabolisme du galactose et de ses métabolites.
Elle est en général déclenchée par un déficit en galactose -1-phosphate uridyl transférase et est diagnostiquée par une augmentation de l’élimination de galactose dans les urines.
La maladie provoque de sévères dommages au foie, la cataracte et des perturbations du fonctionnement cérébral.
Une alimentation sans galactose et sans lactose tout au long de la vie est pour le moment la seule option thérapeutique.
Intolérance au fructose
L’intolérance au fructose (fréquence 1:20000) est provoquée par un déficit en aldolase B dans le foie.
L’aldolase A qui reste disponible, dégrade quant à elle le fructose-1,6-biphosphate très lentement.
Ceci conduit à un engorgement en substrat dans le foie, les reins et la muqueuse gastrique, ce qui réduit davantage la glycolyse et la dégradation du glycogène.
Il en résulte une hypoglycémie systémique avec les symptômes correspondants.
L’évolution ultérieure conduit à des dysfonctionnements hépatiques et à une hépatosplénomégalie, à un ictère, à des dysfonctionnements de la coagulation et à des dommages rénaux.
Un régime sans fructose et sans saccharose doit être suivi tout au long de la vie.
Glycogénoses
Des perturbations du métabolisme du glycogène conduisent à des glycogénoses (maladie d’accumulation du glycogène).
Elles sont dans l’ensemble relativement rares et sont en général autosomique récessives.
Les trois les plus fréquentes sont les maladies de von Geirke, de Frobes (Cori) et de McArdle
La maladie de von Geirke est due à une glucose -6- phosphatase défective.
Il en résulte que le glucose ne peut être libéré ni par la dégradation du glycogène, ni à partir du galactose, du fructose ou des intermédiaire de la gluconéogenèse.
Ceci explique l’hypoglycémie. le glucose- 6-phosphate accumulé dans le foie et les reins stimule la synthèse de glycogène et par conséquent son accumulation.
Une amylo-1,6- glucosidase défective conduit à la maladie de Frobes.
Le glycogène ramifié ne peut plus être dégradé et s’accumule dans le foie, les muscles et le cœur.
La maladie a en général une évolution peu sévère.
La maladie de McArdle est causée par un défaut dans le gène de la glycogène phosphorylase des muscles squelettiques.
Le stock du glycogène ne peut plus servir à courir les besoins énergétiques et reste déposé dans les muscles.
Il en résulte un dérèglement du métabolisme énergétique musculaire.
Carence en vitamine B1 (béribéri)
L’apport journalier recommandé en vitamine B1 (thiamine) est d’environ 1,7 mg.
Les besoins exacts dépondent de la situation métabolique, c’est –à-dire que fièvre, travail musculaire accru et grossesse augmentent les besoins journaliers.
En raison d’une alimentation déséquilibrée, par exemple chez les alcooliques chroniques, apparaissent des symptômes imputables à une carence en thiamine.
Les cas de carence en thiamine sont rares dans les pays industrialisés.
Cependant, les pays en voie de développement, dans lesquels le riz décortiqué (la balle contient de la thiamine) constitue la nourriture de base, sont fréquemment touchés par le béribéri.
Les symptômes relativement peu spécifiques sont des anémies avec perte d’appétit et fatigue, des désordres neurologiques avec confusion mentale et faiblesse musculaire.
La thiamine pyrophosphate (TPP) est le coenzyme de la pyruvate déshydrogénase et de l’α-cétoglutarate déshydrogénase.
La transcétolase, intervenant dans la voie des pentoses phosphate, ne peut également pas fonctionner sans TPP.
Une carence en TPP a ainsi pour conséquence une augmentation de la concentration en pentose phosphate dans les érythrocytes, symptôme qui peut servir au diagnostic.
Lésion hépatique
L’activité sérique d’enzymes hépatocellulaires, telle que la glutamate déshydrogénase (GLDH), permet de diagnostiquer des lésions hépatiques.
L’enzyme fournit de l’α-cétoglutarate pour le cycle du citrate via une réaction anaplérotique (une réaction chimique qui produit un métabolite). Pour déterminer le degré de la lésion cellulaire dans le cas d’une maladie du foie, l’activité GLDH est rapportée aux activités de l’aspartate aminotransférase (ASAT, anciennement GOT) l’alanine aminotransférase (ALAT, anciennement GPT).
Alors que l’ASAT et l’ALAT proviennent en partie ou totalement du cytosol des hépatocytes, la GLDH ne provient que des mitochondries.
La quantité d’ASAT et d’ALAT augmente déjà en cas de lésions hépatiques légères, alors que la GLDH augmente seulement dans le sang quand non seulement les hépatocytes sont détruits, mais également quand leurs mitochondrie sont déjà en train d’être détruites.
L’activité GLDH est déterminée par spectrophotométrie: la grandeur mesurée est la concentration en NADH, dont la diminution traduit la conversion de l’α-cétoglutarate et du NH4+ en glutamate et H2O.