les protéines – Cours de Biochimie: 2ème année pharmacie
III- les protéines
Introduction :
En 1839, le chimiste hollandais Gerrit MULDER publia des résultats sur l’analyse de la fibrine du sang, des albumines du sérum sanguin et de l’œuf.
Ceux-ci indiquaient que c’étaient des composés quaternaires (C, H, O, N) avec des pourcentages quasiment identiques pour ces quatre atomes et qui contenaient des traces variables de soufre et de phosphore.
En 1938, sur la suggestion du chimiste suédois BERZELIUS, MULDER désigna ces composés sous le nom de protéines (du grec : prééminence).
Après une période d’identification des composants, les acides α-aminés, FISCHER et HOFMEISTER présentèrent chacun, le même jour, lors d’un congrès en 1902 le mode de liaison des acides aminés dans les protéines: la liaison peptidique.
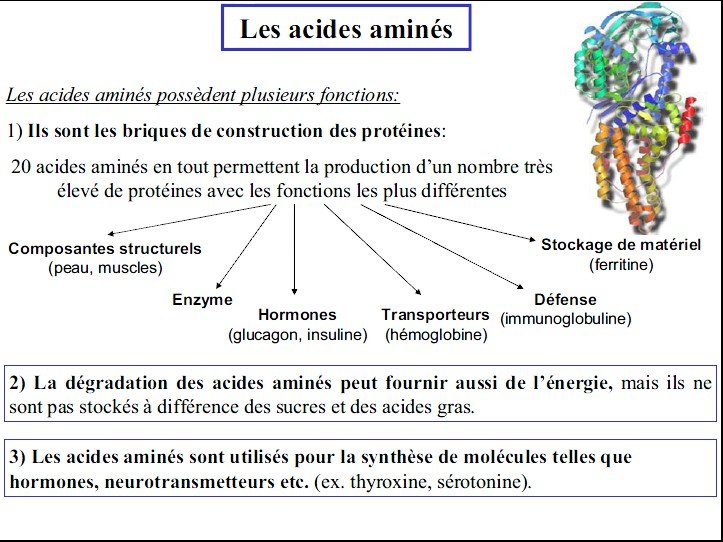
Les protéines sont des biomolécules de première importance :
par leur présence universelle dans le monde vivant, seuls des viroïdes en sont dépourvus.
par leur abondance cellulaire : c’est le premier constituant après l’eau (10 fois plus que des glucides)
par leur extrême diversité : elles assurent des fonctions vitales tant structurales que dynamiques et de plus elles sont le support de la spécificité des “espèces”.
I-1- Structures et propriétés physiques I-1-1 Structures des acides aminés
Formule générale :
Le carbone portant la fonction carboxylique acide est dit “0”, donc le carbone suivant est le carbone α.
Il porte la fonction amine NH2.
Ce sont donc des acides α aminés.
On trouve en gros 20 AA naturels protéinogènes, combinés ou non soit entre eux, soit avec d’autres molécules.
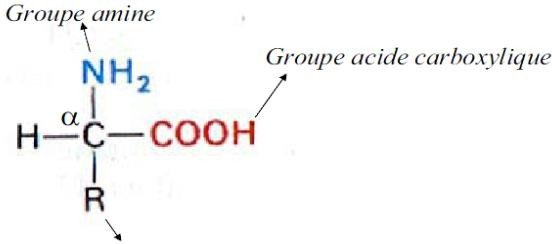
Groupe qui permet à chaque AA
d’avoir des propriétés physiquechimique différentes (ex. polarité, charge électrique, groupe réactif acide ou
basique etc.)
Le carbone qui porte la fonction acide carboxylique et la fonction amine est appelé α.
Cette forme de l’acide aminé n’est retrouvée qu’en très faible proportion (0,001% au mieux).
Classification des aminoacides
Classification des acides aminés selon leur importance alimentaire:
Les acides aminés essentiels:
Valine, Leucine, Isoleucine, Phénylalanine, Tryptophane, Méthionine, Thréonine, Histidine (essentielle pour les nourrissons), Lysine, Arginine (semi- essentielle).
Les acides aminés non-essentiels:
Glycine, Alanine, Proline, Serine, Cystéine, Tyrosine, Asparagine, Glutamine, Acide Asparagique, Acide Glutamique.
Les acides aminés protéiques peuvent être classés aussi :
selon la nature de leur chaîne latérale R qui peut être aliphatique ou cyclique
selon la polarité de la chaîne latérale R en 4 catégories :
Les AA non polaires ou hydrophobes.
Cette catégorie comprends 5 AA avec des chaînes latérales aliphatiques (le GLY, ALA, VAL, LEU, ILE,) 2 avec des noyaux aromatiques ( PHE et TRP ) 1 contenant du soufre ( MET ) et la ( PRO ).
Les AA polaires, non chargés.
Les chaînes latérales de ces AA sont plus solubles dans l’eau donc plus hydrophiles parce qu’ils contiennent des groupements fonctionnels qui forment des liaisons hydrogène avec l’eau.
Cette catégorie comprend, SER, THR, CYS, TYR, ASN et GLN.
Les AA polaires chargés négativement.
Les 2AA dont les chaînes latérales ont une charge négative nette à pH 7,0 sont acide Aspartique et acide Glutamique.
Les AA polaires chargés positivement.
Les AA dans lesquels les chaînes latérales R ont une charge positive nette à pH 7, sont la LYS, ARG, HIS.
Les acides aminés aliphatiques hydrophobes :
| Acide aminé | Radical | Remarques |
| Glycine(Gly; G) | pKa = 2,3 / pKb = 9,6 / pKr = aucun / pHi = 6,0C’est le plus simple des acides aminés possibles.Ne possède pas de carbone asymétrique puisque le carbone α porte deux hydrogènes (il faut quatregroupements différents pour avoir un carbone asymétrique). | |
| Alanine(Ala; A) | pKa = 2,3 / pKb = 9,7 / pKr = aucun / pHi = 6,0 | |
| Valine(Val; V) | pKa = 2,3 / pKb = 9,6 / pKr = aucun / pHi = 6,0 | |
| Leucine(Leu; L) | pKa = 2,4 / pKb = 9,6 / pKr = aucun / pHi = 6,0 | |
| Isoleucine(Ile; I) | pKa = 2,4 / pKb = 9,7 / pKr = aucun / pHi = 6,1Comporte deux carbones asymétriques : le carbone α mais aussi le carbone β. | |
| Proline(Pro; P) | pKa = 2,0 / pKb = 10,6 / pKr = aucun / pHi = 6,3*L’amine portée par le carbone alpha est une amine secondaire et non une amine primaire. |
Les acides aminés aromatiques hydrophobes :
| Acide aminé | Radical | Remarques |
| Phénylalanin e (Phe; F) | pKa=1,8 / pKb=9,1 / pKr=aucun / pHi=5,5 | |
| Tryptophane(Trp; W) | pKa = 2,4/ pKb=9,4/pKr = aucun/ pHi=5,9 |
Les acides aminés amidés :
| Acide aminé | Radical | Remarques |
| Asparagine(Asn; N) | pKa=2,0/pKb=8,8 pKr=aucun /pHi=5,4Le groupement carboxyamide terminal est polaire mais non-ionisable. |
| Glutamine(Gln; Q) | pKa = 2,2 / pKb = 9,1 / pKr =aucun / pHi = 5,7*Le groupement carboxyamideterminalest polaire mais non-ionisable. |
Les acides aminés aromatiques hydroxylés :
| Acide aminé | Radical | Remarques |
| Tyrosine(Tyr; Y) | pKa = 2,2 / pKb = 9,1/ pKr = 10,1 / pHi = 5,7La fonction hydroxyle liée au cycle aromatique est ionisable, mais non ionisée au pH physiologique (pH 7,4). |
Les acides aminés hydrophiles hydroxylés :
| Acide aminé | Radical | Remarques |
| Sérine(Ser; S) | pKa = 2,2 / pKb = 9,2 / pKr = aucun / pHi = 5,7La fonction hydroxyle est polaire mais non-ionisable. | |
| Thréonin e(Thr; T) | pKa = 2,6 / pKb = 10,4 / pKr = aucun / pHi = 6,5*La fonction hydroxyle est polaire mais non-ionisable.*Comporte deux carbones asymétriques : le carbone α mais aussi le carbone β. |
Les acides aminés soufrés :
| Acide aminé | Radical | Remarques |
| Cystéine(Cys; C) | pKa = 1,7 / pKb = 10,8 / pKr = 8,3 / pHi = 5,0Le groupement thiol (-SH) est ionisable mais non- ionisé au pH physiologique (pH 7,4).Deux groupements thiols sont susceptibles des’oxyder pour former une liaison covalente Cys-S-S- Cys appelée pont disulfure. | |
| Méthioni ne (Met; M) | pKa = 2,3 / pKb = 9,2 /pKr = aucun / pHi = 5,8Groupement aliphatique soufré donc caractère hydrophobe. Ne forme pas de pont disulfure. |
Les acides aminés dibasiques :
| Acide aminé | Radical | Remarques |
| Lysine(Lys; K) | pKa = 2,2 / pKb =9,0 / pKr = 10,5 / pHi=9,8 | |
| Arginine(Arg; R) | pKa = 2,2 / pKb = 9,0 / pKr = 12,5/ pHi =10,8 |
| Histidine(His; H) | pKa = 1,8 / pKb = 9,2 /pKr = 6,0/ pHi = 7,6Le groupement imidazole est ionisable mais faiblement ionisé à pH physiologique (pH7,4).pHi proche du pH physiologique (pH 7,4). |
Les acides aminés diacides :
| Acide aminé | Radical | Remarques |
| Aspartate ou acide aspartique(Asp; D) | pKa=2,2/pKb =9,8/pKr=3,9/pHi =3,0 | |
| Glutamate ou acide glutamique(Glu; E) | pKa=2,2 /pKb=9,7/pKr=4,3/pHi= 3,2 |
Remarque : L’état d’ionisation des acides aminés étant dépendant des conditions de pH, il a été choisi dans cette présentation de donner les formules présentant l’état d’ionisation qui prévaut à pH physiologique (pH 7,4).
Propriétés physiques
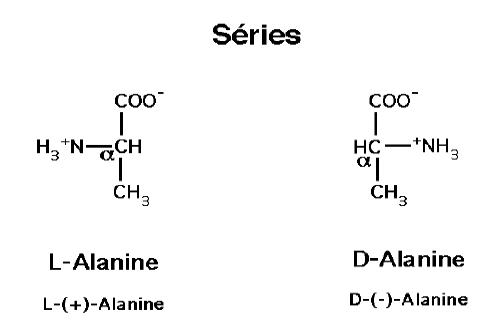
Séries :
Tous les acides aminés constitutifs des protéines, sauf le glycocolle, possèdent un carbone α (carbone n° 2) asymétrique.
Ils ont donc deux isomères optiques possibles, qui correspondent à ces deux structures.
Par définition, lorsque la molécule est représentée avec les mêmes conventions que les oses linéaires (convention de Fisher), l’isomère dont la fonction amine est orientée à gauche appartient à la série L.
Tous les acides aminés optiquement actifs des protéines des animaux et des végétaux appartiennent à la série L.
On trouve cependant quelques acides aminés de la série D chez les microorganismes.
La série à laquelle appartient un acide aminé ne désigne pas le sens dans lequel une solution de cet acide aminé dévie le plan de polarisation de la lumière : ainsi, la L-Alanine est dextrogyre.
On indique quelquefois entre parenthèses après la lettre désignant la série, le sens de la rotation optique : L-(+)-alanine.
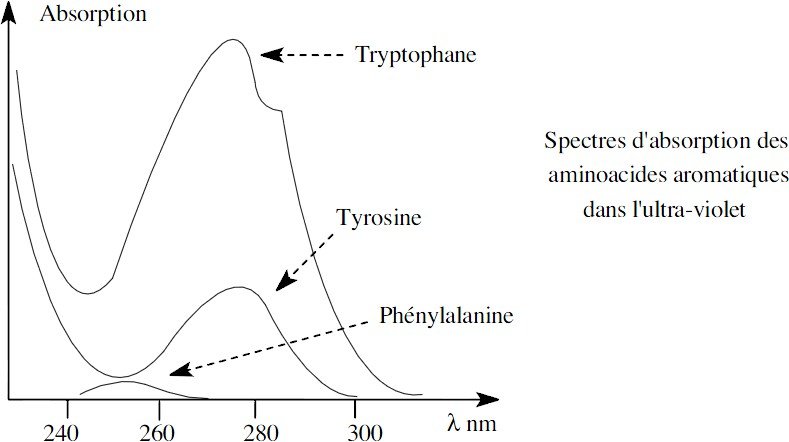
Absorption
les aminoacides n’absorbent pas la lumière visible, leurs solutions sont incolores.
les bandes d’absorption dans l’infrarouge sont caractéristiques de leurs chaînes latérales
les chaînes latérales aromatiques des aminoacides ont des spectres d’absorption caractéristiques dans l’ultraviolet moyen :
La phénylalanine absorbe peu et le tryptophane est 4 fois plus absorbant que la tyrosine au maximum d’absorption, proche de 280 nm.
Cette propriété est très souvent utilisée pour le dosage des peptides et des protéines.
Remarquons que l’absorption de la tyrosine dans l’UV sera dépendante de l’état d’ionisation du phénol et par conséquent du pH.
Solubilité
La solubilité des aminoacides dans l’eau (de un gramme à une centaine par litre) va dépendre essentiellement de deux facteurs :
le double groupement fonctionnel commun qui peut s’ioniser et donc favoriser la dissolution
la chaîne latérale qui peut avoir un caractère plus ou moins polaire ou apolaire.
La solubilité dans les solvants organiques est faible de quelques mg/L et encore moins dans les solvants plus apolaires.
En présence de deux phases liquides (éthanol/eau), les aminoacides se répartissent dans les deux phases avec des coefficients de partage spécifique : cette propriété est utilisée pour les classer.
Propriétés chimiques :
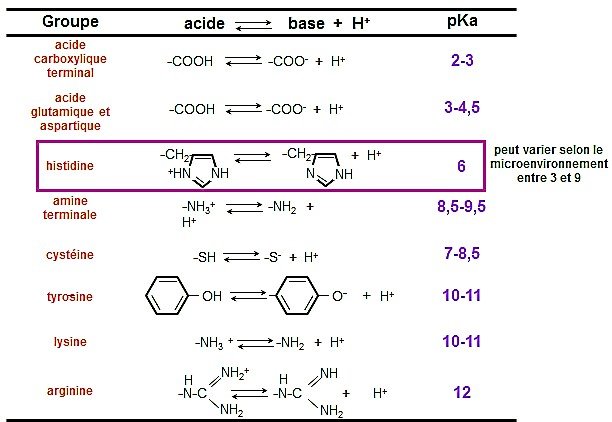
Acido-basicité
Les aminoacides en solution à pH neutre se trouvent sous forme d’ions dipolaires ou
zwitterion.
L’état d’ionisation d’un aminoacide dépend du pH du milieu.
COOH↔COO–+ H+
Fonction Acide :
[𝐻+] × [𝐶𝑂𝑂−] 1
1 [𝐶𝑂𝑂−]
𝐂𝐨𝐧𝐬𝐭𝐚𝐧𝐭𝐞 𝐝’é𝐪𝐮𝐢𝐥𝐢𝐛𝐫𝐞 𝐾𝑎 = → = ×
[𝐶𝑂𝑂𝐻] [𝐻+] 𝐾𝑎 [𝐶𝑂𝑂𝐻]
𝟏 𝟏
[𝑪𝑶𝑶−]
𝒍𝒐𝒈 [𝑯+] = 𝒍𝒐𝒈 𝑲 + 𝒍𝒐𝒈 [𝑪𝑶𝑶𝑯] →
𝒑𝑯 = 𝒑𝑲𝒂 + 𝒍𝒐𝒈 [𝑪𝑶𝑶𝑯]
[𝑪𝑶𝑶−]
𝒂
Equation d´Henderson- Hasselbalch
Ceci est également valable pour la fonction α-aminée.
Cette fonction est dite basique puisqu’elle ne libère son proton que pour de faibles concentrations de H+ dans le milieu.
NH3 ↔NH2+ H
+
+
Fonction Amine :
[𝐻+] × [𝑁𝐻2] 1
1 [𝑁𝐻 ]
𝐂𝐨𝐧𝐬𝐭𝐚𝐧𝐭𝐞 𝐝’é𝐪𝐮𝐢𝐥𝐢𝐛𝐫𝐞 𝐾𝑎 =
3
[𝑁𝐻+]
→ [𝐻+] =
𝐾𝑎
× 2
[𝑁𝐻+]
3
𝟏 𝟏
[𝑁𝐻2]
𝒍𝒐𝒈 [𝑯+] = 𝒍𝒐𝒈 𝑲 + 𝒍𝒐𝒈 [𝑁𝐻+] →
3
𝒂
Equation d´Henderson- Hasselbalch
𝒑𝑯 = 𝒑𝑲𝒂 + 𝒍𝒐𝒈 [𝑁𝐻+]
[𝑁𝐻2]
3
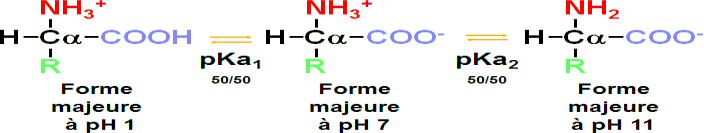
pK de chaque étape d’ionisation correspond au point médian de la partie correspondante de la courbe de titration; Par exemple, pour la glycine, à pH 2.35, les concentrations de la forme cationique +H3NCH2COOH et de la forme ion dipolaire
+H3NCH2COO– sont égales
Le pH auquel une molécule ne présente aucune charge électrique nette est appelé son point isoélectrique (pI) :
𝑝𝐼 =
𝑝𝐾𝑖+𝑝𝐾𝑗
2
où Ki et Kj sont les constantes de dissociation des deux ionisations impliquant la forme neutre de l’acide aminé.
Courbe de titration de la glycine :
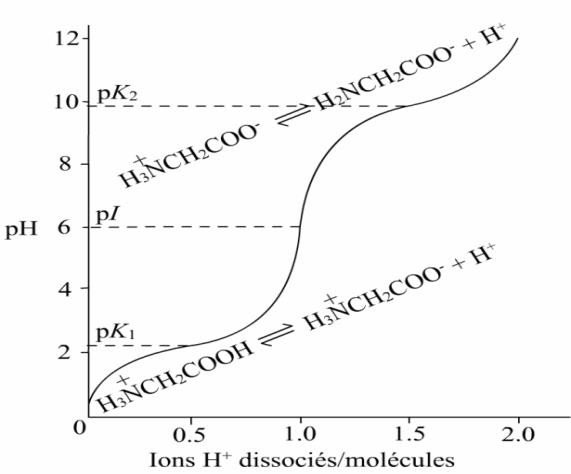
La zone de pH, où la courbe de titration est relativement plate est appelée ZONE TAMPON : Tampon = mélange d’acide faible – base conjuguée capable de stabiliser le pH.
Liaison peptidique
Les peptides sont de petits polymères d’acides aminés, liés entre eux par des liaisons peptidiques.
La réaction du biuret permet le dosage des peptides en milieu alcalin : les liaisons peptidiques forment un complexe violet en présence d’ions cuivriques.
Réactivité chimiques :
Lorsque l’acide aminé est libre, il a au moins deux groupements fonctionnels sur le même carbone α et pour certains un troisième sur la chaîne latérale.
2.1.
Le groupement carbonyle (α-carboxylique)
Dans l’eau, à un pH physiologique, l’ion carboxylate est fortement stabilisé par résonance et donc peu réactif :
Formation de sel.
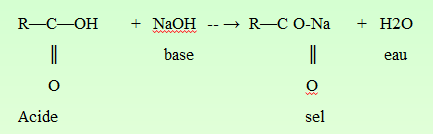
Formation d’ester.
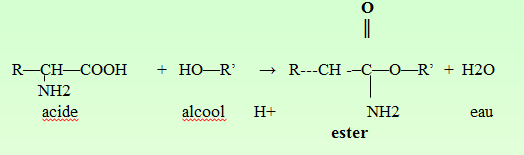
Formation d’amide avec les amines.
R—CH—COOH + NH2—R’ → R—CH –CO—NH—R’ + H2O
Réaction de décarboxylation.
Elle joue un rôle important et aboutit à la disparition de l’acide aminé et la formation d’une amine.
Cette réaction est catalysée par des décarboxylases cellulaires, elle peut donner naissance à des corps doués d’une activité physiologique considérable.
R—CH—COOH→ R–CH2 –NH2 +CO2
NH2 amine
Tableau Principales amines biogènes
| Aminoacide | Amine | Localisation ou rôle |
| Acide aspartique | α-alanine β-alanine | dans les protéines dans le coenzyme A |
| Cystéine | mercaptoéthylamine | dans le coenzyme A |
| Acide glutamique | Acide γ-aminobutyrique | Médiateur du système nerveux central |
| Histidine | Histamine | Action hypotensive |
| 3,4-dihydroxy- Phénylalanine (DOPA) | Dopamine | Précurseur de l’adrénaline (hormone) |
| Sérine | Ethanolamine | Dans les phosphatides |
| 5-hydroxy-tryptophane | Sérotonine | Hormone tissulaire vasoconstrictrice |
2 / A la présence du groupement amine [NH2] a- La désamination par l’acide nitreux
R— CH— COOH + HNO2 →R—CH – COOH+ N2+ H2O
NH2 acide OH eau
b- La désamination oxydative
Ce processus a lieu en deux étapes.
COOH
COOH
COOH
(CH2)2
L-glutamate déshydrogénase
(CH2)2
H2O NH3
(CH2)2
H2N CH COOH
HN C COOH
O CH COO
Acide
L-glutamique
NAD+ NAD+H+
ou ou
NADP+ NADPH+H+
H2 O
Acide
Acide
α-céto-glutarique
α-imino-glutarique
La transamination
Elle désigne le transfert réversible du groupement amine d’un aminoacide à un α-cétoacide il n’y a pas libération de NH3.
Acide L-glutamique + acide oxalo-acétique ↔ acide α-cétoglutarique + acide L-aspartique Acide L-glutamique + acide pyruvique ↔ acide α-cétoglutarique + acide L-alanine
Formation d’imines « bases de Schiff »
R’—CHO+ H2N—CH——R → R’—CH = N—CH ––R
COOH COOH imine
d- Formation de dérivés N acylés
R’—CO –X+ H2N—CH—R’ → R –CO—NH—CH—R’+HX
COOH COOH
Dérivé N acylé
3/ Réactivité des chaînes latérales :
Les groupes latéraux réactifs des aminoacides sont :
les carboxyles et amines : ils sont de réactivité identique à celles des groupes α
les chaînes latérales contenant du soufre, des groupes imidazole ou aromatique autre que le phényle inerte.
Ces réactions sont présentes dans les cellules pour modification post-traductionnelle, comme sites actifs dans les protéines.
Elles sont aussi utilisées par les biochimistes dans l’étude des protéines.
Les chaînes latérales des lysines
La réactivité de la fonction amine se retrouve dans :
la condensation des aldoses et cétoses sur les protéines : glycation des protéines du plasma
la fixation des coenzymes prosthétiques sur leur apoprotéine
l’établissement de liaisons covalentes entre molécules de protéines fibreuses (collagène) qui passe par l’oxydation enzymatique d’une chaîne latérale de lysine en aldéhyde et ensuite la condensation de l’aldéhyde avec une amine d’une lysine d’une autre chaîne (base de Schiff).
Les chaînes latérales soufrées
Le groupe thiol de la cystéine est très réactif :
son oxydation permet la formation des ponts disulfures que l’on trouve dans les protéines (pont intra-chaîne ou entre chaînes polypeptidiques).
des thiols sont indispensables à l’expression de la fonction de nombreuses protéines
les dérivés mercuriels se fixent spécifiquement sur les groupements thiols
les protéines peuvent fixer des métaux par l’intermédiaire du groupe thiol de la cystéine (l’Histidine peut aussi fixer des métaux sur le groupement imidazole)
le sélénium (oligo-élément) peut remplacer le soufre du groupe thiol : sélénocystéine.
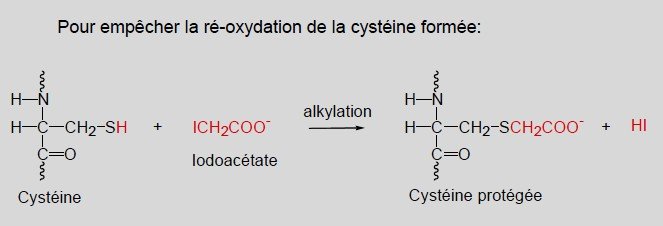
dans les études de protéines, l’acide iodoacétique est utilisé pour bloquer les thiols des protéines : l’acide aminé modifié obtenu est une carboxyméthylcystéine.
Le groupe thioéther de la méthionine est très peu réactif :
dans les cellules, l’alkylation enzymatique du soufre par un nucléoside produit le dérivé SAdénosylméthionine qui est un coenzyme d’activation et de transfert du groupement méthyle.
dans les études de protéines, le bromure de cyanogène (BrCN) est utilisé.
Il réagit avec le soufre d’une méthionine et coupe la chaîne polypeptidique à cet endroit.
Les chaînes latérales alcools et amides
Ces groupes sont peu réactifs :
la sérine intervient dans des mécanismes de catalyse enzymatique
la sérine, la thréonine et la tyrosine sont des sites potentiels de phosphorylation
la sérine, la thréonine et l’asparagine sont des sites potentiels de O et N-glycosylations
l’hydroxyle de la tyrosine donne au noyau phényle une réactivité assez forte qui favorise les substitutions électrophiles.
L’iodation enzymatique de la tyrosine est une étape dans la biosynthèse des prohormones (T4) et hormone (T3) thyroïdiennes.
Les acides aminés non standards
Les acides aminés non standard sont soit :
acide aminé d’une protéine modifié après la traduction (modification post-traductionnelle)
des intermédiaires de la biosynthèse d’autres aminoacides, des éléments de construction d’autres molécules (lipides, coenzymes) ou encore des molécules actives
1.
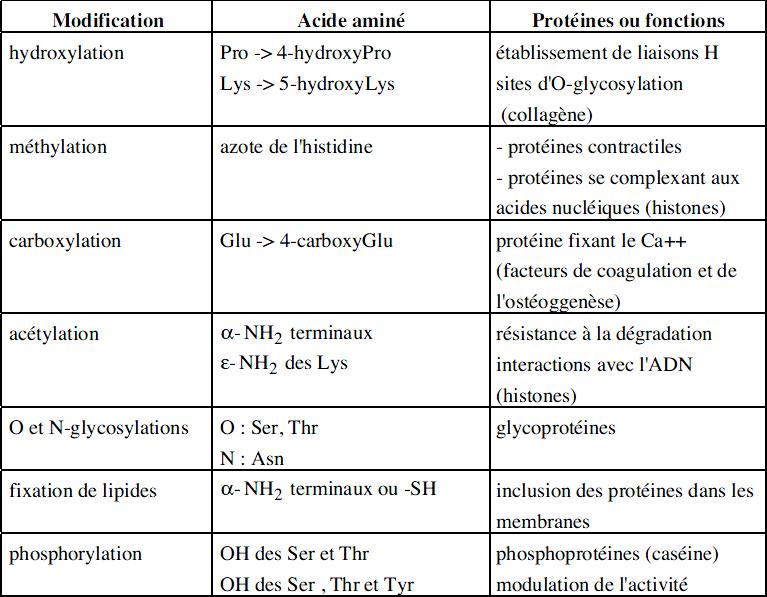
Aminoacides subissant une modification post-traductionnelle
Ces modifications peuvent concerner dans les protéines, les groupes des extrémités terminales ou ceux qui appartiennent à la chaîne latérale.
Autres aminoacides
Citons quelques dérivés importants :
Les dérivés obtenus par décarboxylation :
– histidine décarboxylée en histamine qui entre en jeu dans les réactions d’inflammation
-acide glutamique décarboxylé en 4-aminobutanoique (GABA) qui est un neurotransmetteur
Les dérivés de la tyrosine :
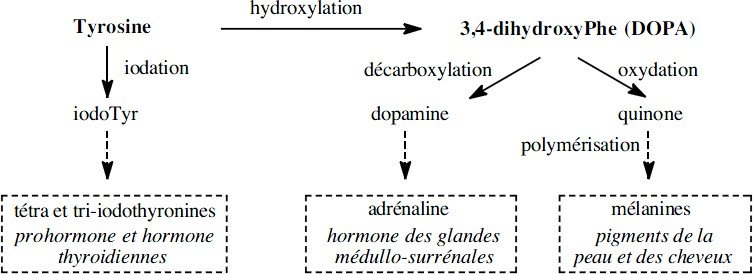
Chez les mammifères, citons :
l’ornithine (homologue à 5 carbones de la lysine) et la citrulline (dérivé amide du précédent) sont des intermédiaires du cycle qui convertit dans le foie l’ion ammonium en urée.
la taurine est un acide 2-aminosulfonique (oxydation de la cystéine en acide cystéique puis décarboxylation de ce dernier) qui entre dans la composition des sels biliaires nécessaires à l’absorption des lipides.
Chez les plantes, champignons et bactéries, citons :
le poison β-cyanoalanine, sécrété par des plantes et des champignons
la bactérie Streptomyces sécrète des antibiotiques comme la D-cyclosérine et l’azasérine, cette dernière est employée dans des thérapeutiques pour ses propriétés antifongiques et anti tumorale.
Les Peptides :
Les chaînes peptidiques sont le produit de la polymérisation covalente des aminoacides par une liaison peptidique.
Elles diffèrent par le nombre, la nature et l’ordre des aminoacides.
On définit arbitrairement :
peptide : enchaînement d’un nombre d’aminoacide inférieur à 50.
Parmi ceux-ci, on parle d’oligopeptide pour un nombre d’aminoacides inférieur à 10 et de polypeptide pour un nombre supérieur à 10.
protéine : enchaînement d’un nombre d’aminoacides au-delà de 50.
La liaison peptidique
Type de liaison
La liaison est de type amide substituée : élimination d’eau entre les groupes α-COOH et α – NH2 de deux aminoacides.
Cette liaison amide lie les deux carbones Cα des deux aminoacides.
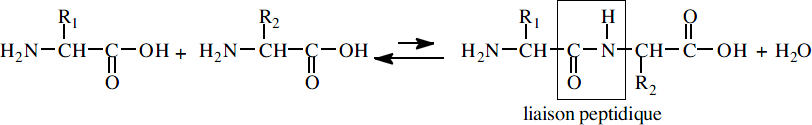
peptide : enchaînement d’un nombre d’aminoacide inférieur à 50.
Parmi ceux-ci, on parle d’oligopeptide pour un nombre d’aminoacides inférieur à 10 et de polypeptide pour un nombre supérieur à 10.
protéine : enchaînement d’un nombre d’aminoacides au-delà de 50.
Cette réaction est thermodynamiquement en faveur de l’hydrolyse :
la synthèse chimique d’un peptide n’est possible qu’en milieu anhydre et une forme activée de l’acide
la biosynthèse cellulaire, en milieu aqueux, est dépendante d’une “activation énergétique” qui a lieu par un couplage avec l’hydrolyse d’un “donneur d’énergie” (ATP).
Cette liaison, une fois formée, est très stable et son hydrolyse spontanée est quasiment nulle.
Caractéristiques de la liaison peptidique
L’oxygène du groupement CO et l’hydrogène du groupement NH sont en position trans l’un par rapport à l’autre.
La conformation trans est la plus favorisée de point de vue énergétique, donc elle est plus faible énergétiquement que la conformation cis.
La liaison peptidique se fait par des liaisons chimiques covalentes.
Ainsi, une rotation serait possible autour de chacune de ces liaisons.
La densité électronique est équitablement répartie entre les différents atomes de la chaîne peptidique.
Les conséquences de cette distribution électronique sont :
Le squelette peptidique possède deux degrés de rotation : – une rotation autour de la liaison N-Cα.
L’angle de rotation porte le nom de Φ (phi). – une rotation autour de la liaison Cα – CO .
L’angle de rotation porte le nom de Ψ (psi).
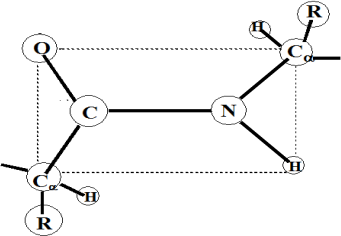
Les 6 atomes du motif peptidique sont coplanaires : plan amide de la structure peptidique (Figure 1).
Les liaisons C-N présentent des distances bien fixes : CO-N : 0,133 nm et Cα – N : 0,145 nm.
Le motif peptidique est relativement polaire : l’azote de l’amide possède une charge positive et l’oxygène du CO porte une charge négative.
Ainsi, la liaison peptidique possède un dipôle permanent.
Cependant, malgré cette polarité, le motif peptidique n’est pas actif chimiquement.
Les chaînes peptidiques et leur nomenclature
Les chaînes peptidiques sont vectorisées : les liaisons peptidiques attachent les acides aminés dans un ordre spécifique.
Les conventions sont les suivantes :
les aminoacides engagés dans une chaîne peptidique sont appelés résidus.
Leur nom est celui de l’aminoacide auquel on ajoute le suffixe yl.
les deux aminoacides aux extrémités de la chaîne sont appelés : N-terminal pour celui qui a sa fonction α-aminée libre et C-terminal pour celui qui a sa fonction α-COOH libre
on numérote les aminoacides en écrivant l’enchaînement de gauche à droite à partir de l’extrémité N-terminal.
On distingue trois types de peptides :
peptide formé d’une seule chaîne (monocaténaire) et linéaire

peptide formé d’une seule chaîne (monocaténaire) et cyclique
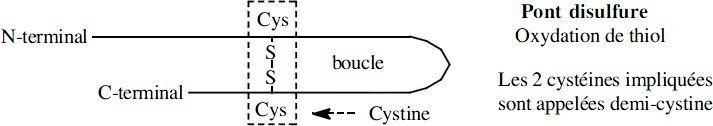
Une liaison covalente (pont S-S) intra-chaîne est présente et réalisée par l’oxydation de deux fonctions thiol de deux cystéines
peptide formé de plusieurs chaînes (polycaténaire)

Une liaison covalente (pont S-S) inter-chaînes est présente et réalisée par l’oxydation de deux fonctions thiol de deux cystéines appartenant à deux chaînes peptidiques différentes
Ionisation des peptides
Les groupes ionisables d’un peptide sont :
le groupe α – NH + de l’aminoacide N-terminal
3
le groupe α-COOH de l’aminoacide C-terminal
les groupes ionisables des chaînes latérales des différents aminoacides du peptide, à l’exception toutefois des thiols (cystéine) ayant subi une oxydation et qui sont engagés dans une liaison S-S.
Détermination de la structure d’un peptide
La détermination de la structure primaire d’un peptide est conduite en deux étapes :
détermination de la composition en aminoacides
détermination de l’ordre des enchaînements des résidus
Ces deux étapes ont comme point commun l’hydrolyse de la liaison peptidique.
Hydrolyse de la liaison peptidique
La liaison peptidique est très stable, son hydrolyse spontanée est quasiment nulle.
Hydrolyse chimique complète
L’action de l’acide chlorhydrique (HCl) 6M sur un peptide, à ébullition pendant au moins 24 heures, aboutit à un hydrolysat contenant les aminoacides avec toutefois les restrictions suivantes :
l’aminoacide acide tryptophane est entièrement détruit
les amides (Asn, Gln) sont hydrolysés en ammoniac et acides correspondants (Asp, Glu)
certains aminoacides (Tyr, Ser, Thr) peuvent être partiellement détruits (un temps d’hydrolyse plus faible permet de résoudre le problème).
Hydrolyse chimique spécifique
Certains réactifs hydrolysent une liaison peptidique avec une spécificité sur un des aminoacides participant à la liaison :
le bromure de cyanogène (BrCN) hydrolyse la liaison peptidique du côté carboxyle de la Méthionine : cette dernière devient alors un résidu C-terminal transformé en résidu homosérine lactone
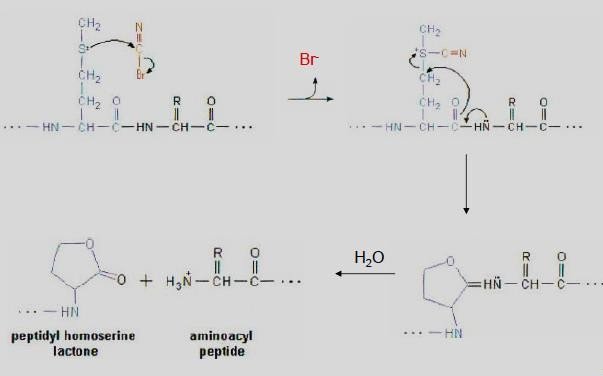
le 2-nitro-5-thiocyanobenzoate (NTCB) hydrolyse la liaison peptidique du côté amine de la Cystéine.
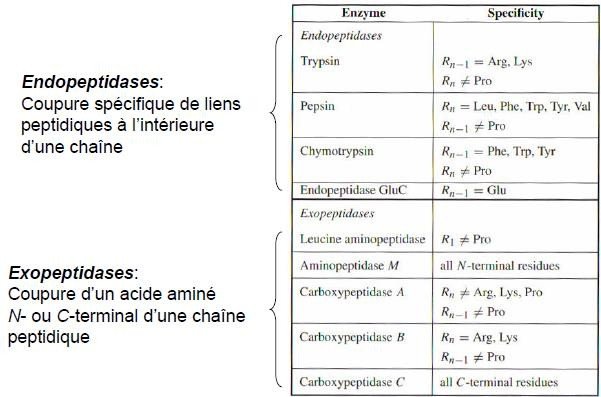
Hydrolyse enzymatique
L’hydrolyse des liaisons peptidiques peut être réalisée par des enzymes protéolytiques (ou protéases ou encore peptidases) qui sont des hydrolases.
La spécificité principale de ce groupe d’enzymes est l’hydrolyse des liaisons peptidiques.
Leur spécificité secondaire permet de les classer en deux groupes :
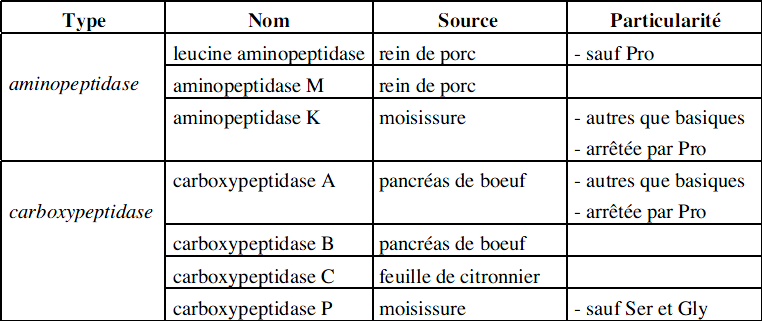
exopeptidase : L’enzyme n’hydrolyse que la première liaison peptidique (aminopeptidase) ou la dernière liaison peptidique (carboxypeptidase) en libérant l’aminoacide terminal.
Bien évidemment, le processus recommence sur le peptide amputé d’un aminoacide (un temps d’hydrolyse court permet de libérer un seul aminoacide).
Certaines exopeptidases ont des spécificités secondaires particulières.
Exemples :
Endopeptidase : L’enzyme hydrolyse des liaisons peptidiques internes entre deux aminoacides i, (i+1).
Il peut être spécifique du résidu en position i ou (i+1).
L’hydrolyse d’un peptide par une endopeptidase donnera plusieurs fragments peptidiques : si on a m coupures (m liaisons peptidiques hydrolysées), le peptide sera dégradé en (m+1) fragments peptidiques.
Exemples d’endopeptidases avec leurs spécificités :
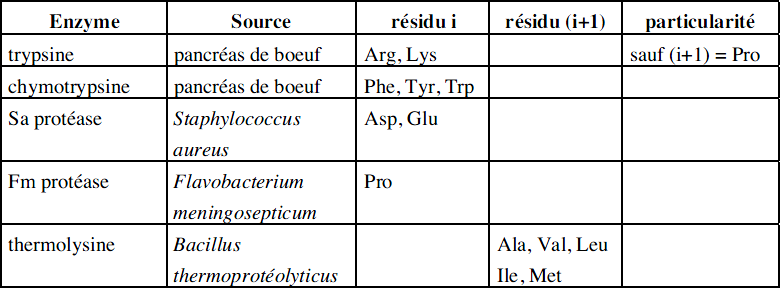
Remarque : on peut dire que la thermolysine est une endopeptidase spécifique des aminoacides Ala, Val, Leu, Ile, Met avec une coupure du côté amino de la liaison peptidique.
Les autres enzymes sont spécifiques des aminoacides indiqués avec une coupure du côté carboxyle de la liaison peptidique.
2- Détermination de la séquence
La détermination de la structure primaire d’un peptide obéit en général à la stratégie suivante :
Identification des aminoacides terminaux
l’extrémité N : on utilise en général le chlorure de dansyl et après hydrolyse chimique complète du peptide, on identifie le dansyl-aminoacide.
La présence de lysine dans le peptide va perturber cette méthode puisque la chaîne latérale de ce résidu porte un groupe -NH2 qui réagira avec le DNS-Cl.
l’extrémité C : on utilise en général une dégradation limitée à l’aide des carboxypeptidases
I-1-4-Principales méthodes d’études des acides amines
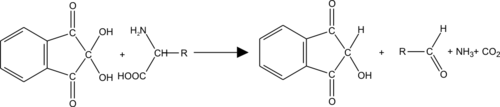
A / Réactions colorées des aminoacides Méthode colorimétrique à la ninhydrine :
C’est une réaction fondamentale pour la détection et le dosage des acides aminés.
La ninhydrine est un oxydant puissant qui par désamination oxydative des acides aminés, conduit à l’aldéhyde correspondant, avec libération d’ammoniac et de gaz carbonique et formation de ninhydrine réduite (hydrindantine).
La ninhydrine ou nihydrine (2,2-dihydroxyindan-1,3-dione) est un composé aromatique
utilisé comme révélateur des acides aminés.
Formule semi-développée de la ninhydrine.
Tous les acides aminés sont colorés en pourpre de Ruhemann (λ = 570nm), seule la
prolineest colorée en jaune (λ = 440nm).
La ninhydrine réagit avec les acides aminés de désamination et de décarboxylation simultanée : la ninhydrine est toujours en excès.
Puis, l’ammoniac formé, la ninhydrine réduite et un excès de ninhydrine réagissent pour former un composé bleu violet. le pourpre de Ruhemann
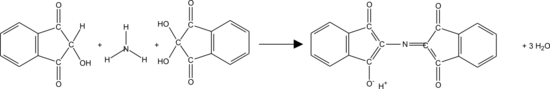
Elle réagit également avec les amines primaires générant une coloration pourpre de Ruhemann et avec les amines secondaires auxquelles elle fournira une coloration jaune.
Méthodes spécifiques
Elles permettent d’identifier et de doser spécifiquement certains AA grâce à leur chaîne latérale sans avoir recours à une séparation préalable des AA
Identification de la cystéine et de la cystine.
Le groupement thiol peut être mis en évidence par la nitroprussiate de sodium en milieu ammoniacal donnant une couleur rouge: Réaction de Brandt.
Identification de la tyrosine par la réaction de Millon, de l’arginine par la réaction de
Sakaguchi, de l’histidine par la réaction de Pauly, du tryptophane par la réaction d’Ehrlich.
B/ Séparations des acides aminés :
Les AA constitutifs des protéines, sont libérés par hydrolyse.
Un hydrolysat protéique, obtenu après ébullition dans l’acide chlorhydrique (HCl) prolongé (6N) est un mélange d’AA qu’il importe d’identifier et de doser.
Les méthodes de séparations les plus utilisées sont:
Méthodes électrophorètiques;
Méthodes chromatographiques
1 / chromatographies de partage;
2 / chromatographies échangeuses d’ions
Méthodes électrophoretiques
Puisque les AA en solution aqueuse sont chargés, ils pourront migrer dans un champ électrique, et ce déplacement dépendra de leur charge nette au pH considéré.
Si l’on dépose un mélange d’AA sur un support (feuille de papier) préalablement imprégné d’un tampon ayant un pH voisin de la neutralité, et que l’on établisse un champ électrique continu de haut voltage au sein du support, les AA basiques migreront le long de ce support vers la cathode, les AA acides vers l’anode et les AA neutres ne se déplaçant pratiquement pas.
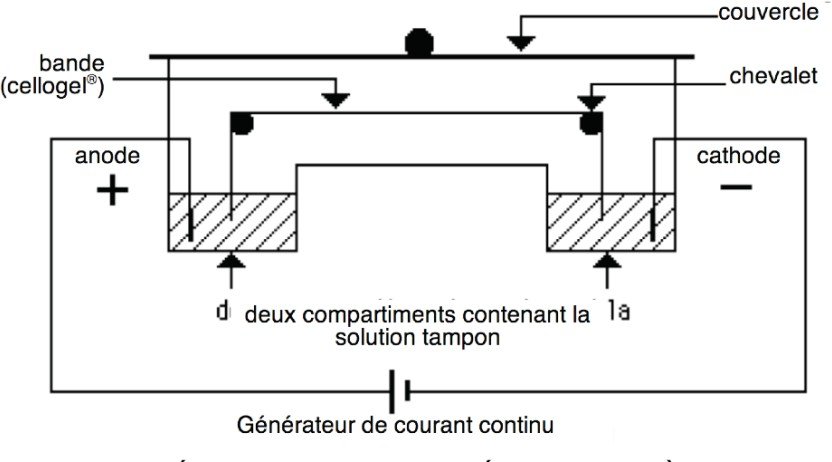
Schéma d’une cuve d’électrophorèse
Les supports solides :
feuille de papier ou feuille d’acétate de cellulose Les supports sous forme de gels :
polyacrylamide ou agarose
Afin de localiser les AA sur le support celui-ci est séché, reçoit une pulvérisation d’une solution de ninhydrine, puis est chauffé.
Des spots bleus indiquant la présence d’un AA sur le support.
Séparation des protéines du sérum sur acétate de cellulose :
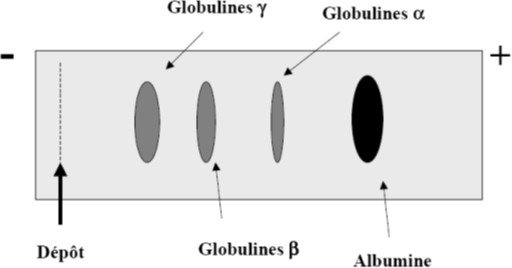
Tampon pH 9,2 ; migration 40 minutes sous 180 V révélation par coloration des protéines
au noir amido
Critères de migration d’un peptide dans deux phases : aqueuse stationnaire et organique mobile.
3 critères sont à considérer.
Dans l’ordre d’importance, ils sont : la charge globale, la polarité de la chaîne latérale (radical) et le nombre de carbones.
Methodes chromatographiques :
Ce sont des techniques fondamentales dans la purification des protéines.
On utilise principalement:
_ chromatographie sur papier
_ chromatographie sur couche mince
_ chromatographie sur échangeur d’ions
_ chromatographie en phase gazeuse
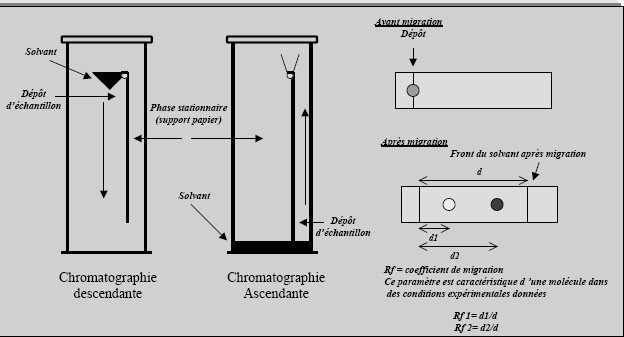
Chromatographie sur papier
L’une des phases est stationnaire, l’autre est une phase mobile organique, se déplaçant par capillarité au sein d’une feuille de papier.
Ce type de chromatographie se pratique dans une cuve de verre hermétiquement close, dont l’atmosphère est saturée par la phase stationnaire.
Le mélange à analyser est déposé sous un faible volume sur un emplacement de départ situé à proximité d’une des extrémités de la feuille que l’on met en contact avec la phase
mobile.
couvercle hermétique


Migration du solvant
.
augette de solvant mobile
…………………………………
papier
dépôt initial
front du solvant
réserve de saturation
cuve de verre
en solvant
.
……….
Matériel pour chromatographie descendante sur papier
Plus les substances constituant le mélange sont solubles dans cette phase mobile, ou plus leur Rf est élevé, plus elles migrent rapidement sur la feuille.
Lorsque la migration est terminée, on pulvérise de la ninhydrine sur la feuille.
Après chauffage, des taches bleu-violet apparaissent dans les zones où se trouvent les aminoacides.
Chromatographie sur couche mince
Le mélange à étudier ainsi que les substances de référence sont déposés sur un support appelé phase stationnaire (dans le cas d’un chromatographie sur couche mince, il s’agit d’un gel de silice déposé en couche mince sur une plaque d’aluminium).
Les dépôts sont entraînés par un solvant approprié (phase mobile ou éluant) qui migre par capillarité sur la plaque. Les constituants du mélange se séparent par migration différentielle : chacun d’eux est d’autant plus entraîné par l’éluant qu’il est plus soluble dans celui-ci et moins absorbé par la phase stationnaire.
Après migration, les tâches incolores doivent être révélées.
C’est la détection qui peut se faire par immersion dans un bain de permanganate de potassium ou encore par observation à la lumière UV (Ultraviolet) si la plaque de silice comporte un indicateur de fluorescence.
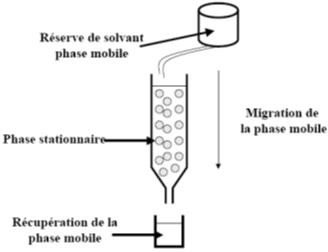
chromatographie échangeuse d’ions :
La chromatographie échangeuse d’ions, ou chromatographie par échange d’ions, est une chromatographie permettant d’isoler une substance chargée électriquementd’un mélange de moléculeschargées (liquide).
Pour cela, on fait passer le mélange sur une phase stationnaire (solide) chargée déjà associée à des ions connus et on remplace ces ions par les ions/molécules chargées du mélange à séparer.
La phase stationnaire peut être une résine sous forme de billes.
Cette résine est greffée d’un radical chargé (+ ou -).
La résine est dans une colonne et on fait passer la solution dans cette colonne.
Le pH d’élution peut faire changer la charge de la molécule M ou B (dans le cas d’une acide aminé par exemple) ce qui permet de récupérer cette molécule seulement.
Peptides et protéines.
Les peptides sont de petits polymères d’acides aminés, liés entre eux par des liaisons peptidiques.
La réaction du biuret permet le dosage des peptides en milieu alcalin : les liaisons peptidiques forment un complexe violet en présence d’ions cuivriques.
Leurs propriétés sont intermédiaires entre celles des acides aminés et celles des protéines.
Ils sont plus ou moins solubles dans l’eau, et présentent un caractère amphotère, lié à leur pHi G é n é r a l i t é s.
Il existe 20 AA majeurs entrant dans la composition des protéines (plus quelques autres, un peu originaux).
Les conventions d’écriture placent la fonction N-terminale à gauche, et la fonction C-terminale à droite.
Les protéines jouent différents rôles dans l’organisme : structure (maintien de la membrane plasmique) ou métabolisme (enzymes ; protéines porteuses,…).
La structure primaire
C’est la séquence en acides aminés.
Stratégie de séquençage d’une protéine
Stratégie de base développée par Frederick Sanger en 1953 (Prix Nobel 1958)
Étapes impliquées dans le séquençage d’une protéine:
Détermination du nombre de chaînes polypeptidiques (sous-unités) dans la protéine
Coupure des liens disulfures (inter- ou intramoléculaires)
Détermination de la composition des acides aminés de chaque chaîne polypeptidique
Les chaînes polypeptiques sont souvent trop longues pour être directement séquencées; elles doivent avant être coupées en des plus petits fragments peptidiques par des réactions spécifiques.
Détermination de la séquence de chacun des fragments peptidiques par la dégradation d’Edman
Élucidation de la séquence de chacune des chaînes polypeptidiques par recouvrement des séquences des différents fragments
Détermination de la structure de la protéine entière, incluant les liens disulfures entre les sous-unités
Etape 1 : Séparation des chaînes polypeptidiques.
Cette étape concerne les protéines hétéromultimériques uniquement : il y a dissociation des sous-unités par le pH, en présence d’urée 8M et de guanidine 6M ou à forte concentration de sel.
Les sous-unités sont ensuite séparées les unes des autres en fonction de leur poids moléculaire et/ou charge.
Si les sous-unités sont liées entre elles par des ponts disulfures S-S, il est primordial avant de les séparer de couper ces ponts disulfures.
Composition en acides aminés.
Hydrolyse.
La composition brute en AA peut être déterminée par hydrolyse chimique (HCl 6N, 105°C, 24 h, ampoule scellée).
Le mélange obtenu est ensuite analysé par chromatographie (papier 2 dimensions, HPLC, …).
Cette méthode pose problème car elle conduit à la destruction de certains AA, à l’isomérisation D – L d’autres, etc.
Des temps de réaction plus long sont nécessaires pour une hydrolyse complète des résidus Leu, Val et Ile.
Par contre, certains résidus sont dégradés dans ces conditions sévères.
Trp est considérablement dégradée.
La vitesse de dégradation de certains résidus, tels que Thr, Tyr et Ser peut être mesurée et un facteur de correction peut être inclut pour tenir compte de la perte de ces acides aminés en fonction du temps d’hydrolyse.
De plus, l’hydrolyse acide convertit Asn à Asp et Gln à Glu, respectivement (du NH4+ est éliminé).
Pour déterminer la quantité de ces acides aminés, la teneur totale de Asx (Asn + Asp), Glx (Gln + Glu) et NH + (Asn + Gln) doit être mesurée et comparée.
4
Puisque des conditions optimales pour l’hydrolyse acide sont difficiles à établir, la réaction est effectuée plusieurs fois dans des conditions différentes et la composition des acides aminés est déduite à partir des différentes expériences d’hydrolyse.
L’hydrolyse peut aussi être réalisée par voie enzymatique (protéases), mais on n’obtient généralement que des polypeptides, et non les AA eux-mêmes.
Les méthodes enzymatiques sont surtout utilisées pour la détermination de l’Asn, de la Gln et du Trp.
Puisque les exopeptidases et endopeptidases exhibent des spécificités élevées, il est essentiel d’utiliser un mélange d’enzymes pour assurer l’hydrolyse de tous les liens peptidiques.
Des faibles concentrations d’enzymes doivent être utilisées (~1%) puisqu’elles sont aussi des protéines qui peuvent être dégradées et contaminées le mélange réactionnel.
Analyse des résidus terminaux
Puisque chaque chaîne polypeptidique possède un résidu N-terminal et C-terminal, le nombre de sous-unités distinctes dans une protéine peut être déterminé en identifiant le nombre de chacun des résidus terminaux.
Analyse N-terminal
Détermination de la séquence propre en AA.
Méthodes chimiques.
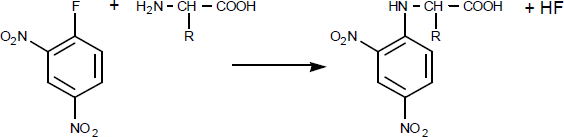
Méthode de Sanger : Résidu N terminal.
Le dinitrofluorobenzène (NDFB) forme, avec la fonction N terminale, un dérivé avec libération d’acide fluorhydrique.
L’hydrolyse de la protéine libère ensuite le composé dérivé, qui présente des caractéristiques propres de coloration et de migration en chromatographie ou en électrophorèse.
En comparant le résultat de l’analyse aux standards connue et à l’hydrolyse “simple” pratiquée plus haut, on peut connaître l’acide aminé N terminal.
Dansylation : Résidu N terminal.
Le chlorure de 1-dinéthyl-amino-naphtalène-5-sulfonyle (DANS) réagit avec le NH2 terminal et donne un dérivé (dansyl-amino-acide) décelable par sa fluorescence jaune.
La méthodologie est la même que dans le cas de la méthode de Sanger, mais la réaction est 100 fois plus sensible.
La dansylation est utilisée pour doser les acides aminés par HPLC car elle permet une meilleure détection et une meilleure quantification.
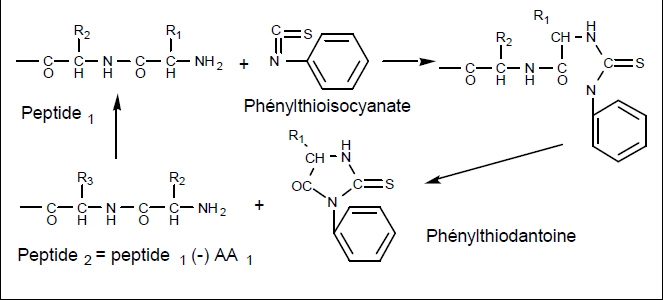
Méthode d’Edman : Résidu N terminal.
Le phénylthioisocyanate donne une phénylthiodantoine avec l’acide N-terminal.
Il libère un nouveau polypeptide, ayant un AA de moins que le précédent, avec lequel il peut alors réagir.
Cette détermination est donc dite récurrente.
En l’arrêtant à temps, ou en utilisant diverses méthodes mathématiques, on peut ainsi connaître de proche en proche la composition complète de la molécule.
Cette technique a été utilisée dans un appareil automatisé.
Réaction à l’hydrazine : Résidu C terminal.
Un traitement à l’hydrazine à 100°C hydrolyse toutes les liaisons peptidiques, et libère des hydrazides de tous les AA sauf le C terminal, qui se présente comme un AA libre normal.
Il est alors facile à isoler et à identifier.
Méthodes enzymatiques.
Pour chacune des extrémités, il existe une enzyme particulière qui hydrolyse les acides terminaux.
Il s’agit de la carboxypeptidase et de l’aminopeptidase, qui libèrent respectivement l’acide C-terminal et l’acide N-terminal.
Il s’agit de méthodes récurrentes, qui dégradent le polypeptide dans toute sa longueur.
On parvient à connaître la séquence grâce à la vitesse de libération des acides aminés.


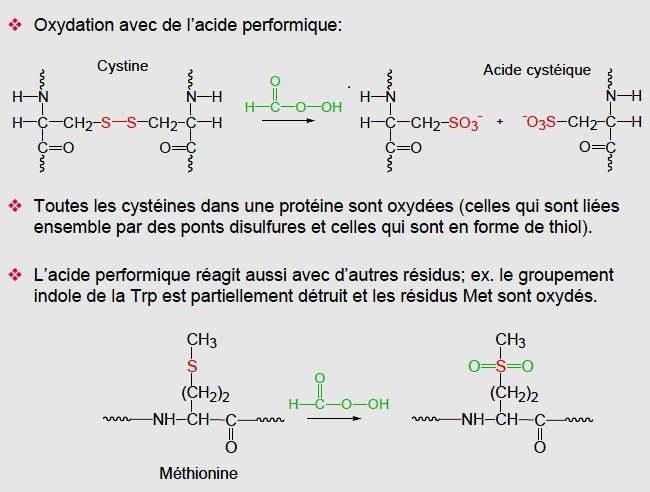
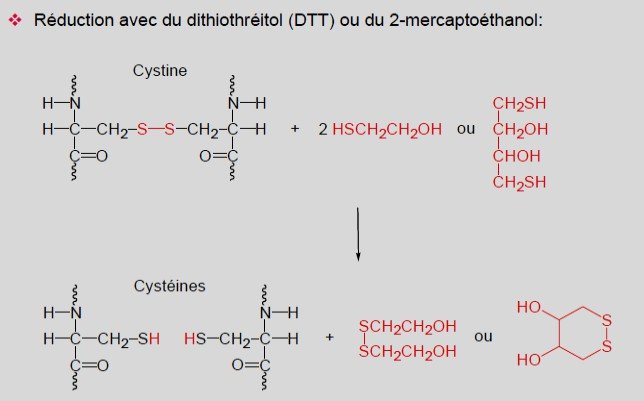
Coupure des liens disulfures
Coupure spécifique des liens peptidiques
2.5.1 Fragmentation enzymatique
2-5-2- Fragmentation chimique
Le CNBr coupe les liens peptidiques du côté C-terminal d’un résidu Met.
2-6- Détermination de l’ordre des fragments peptidiques
La séquence des fragments peptidiques individuels est déterminée en établissant l’ordre dans lequel ils étaient connectés.
La séquence des acides aminés dans un 1er set de fragments est comparée avec celui d’un 2è set de fragments pour lequel les points de coupure sont différents.
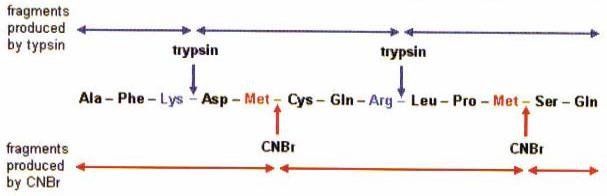
Un recouvrement de quelques résidus est généralement suffisant pour identifier un point de connexion.
2-7- Détermination des positions des liens disulfures
Fragmentation de la protéine native => mélange de fragments peptidiques, dont certains sont liés par des ponts disulfures
Le mélange peptidique est analysé par électrophorèse sur gel en 2D en utilisant les mêmes conditions de séparation dans les deux directions.
Après séparation dans la 1ère direction, la matrice est exposée à l’acide performique pour couper tous les liens disulfures existants.
Ensuite la séparation est effectuée dans la 2è directions.
Les fragments qui ne contiennent pas de liens disulfures sont positionnés sur la diagonale puisque leur vitesse de migration dans les deux directions est identique.
L’électrophorégramme des fragments contenant des liens disulfures montrera 2 points pour les fragments produits par oxydation qui sont positionnés on dehors de la diagonale.
Les fragments liés par des ponts disulfures peuvent être isolés du gel et identifiés par séquençage.
La séquence des acides aminés est ensuite comparer avec celle de la protéine entière, permettant ainsi l’identification de la position des liens disulfures.
La structure secondaire
L’encombrement stérique des acides aminés et les angles des liaisons font que l’enchaînement n’est pas linéaire, mais présente un certain nombre de replis.
En outre, les différentes portions des replis peuvent établir entre elles des liaisons qui vont contribuer à consolider la structure.
Liaisons intervenant dans la structure spatiale.
Liaison disulfure.
C’est une liaison covalente forte établie entre deux résidus cystéine appartenant à une seule chaîne ou à deux chaînes différentes.
Liaison ionique (ou saline).
C’est une liaison électrovalente (plus faible) établie entre deux charges de signe opposé : NH + et COO–.
Ce type d’interaction permet la liaison de deux molécules de type différent dans les hétéroprotéines.
3
Liaison hydrogène.
Ce type de liaison non covalente se forme lorsque sont à proximité l’un de l’autre d’une part un atome d’hydrogène lié à un azote ou à un oxygène, et d’autre part un doublet électronique non partagé d’un autre azote ou d’un autre oxygène.
Ces liaisons peuvent s’établir entre :
les C=O et les N-H des liaisons peptidiques ;
les radicaux des résidus d’acides aminés, impliquant par exemple les noyaux phénoliques, le γ carboxyle du glutamate, etc.
Liaison hydrophobe.
Les chaînes latérales hydrophobes de certains acides aminés (Ala ; Val ; Leu ; Ile ; Phe) sont repoussées par l’eau et ont donc tendance à se rapprocher les unes des autres (interactions de type Van der Waals).
Propriétés spatiales de la liaison peptidique.
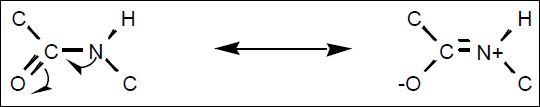
La liaison peptidique peut s’écrire sous deux formes : elle possède donc un caractère de double liaison, ce qui implique que les atomes soient tous dans le même plan.
Il existe une
possibilité d’isomérie cis – trans pour les résidus de part et d’autre de la liaison.
Ces propriétés entraînent trois possibilités de conformation spatiale :
les plans successifs alternent de part et d’autre selon deux orientations privilégiées, et on parlera de structure en feuillet plissé ;
les plans successifs tournent régulièrement dans le même sens, et on parlera de structure hélicoïdale ;
il n’y a pas de direction privilégiée, et on parlera de pelote statistique.
Feuillets plissés.
Protéines fibreuses.
Liaisons hydrogènes inter-chaînes
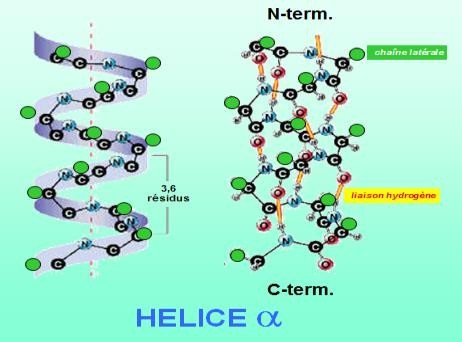
Hélices α
Protéines globulaires.
Liaisons hydrogène intra-chaîne.
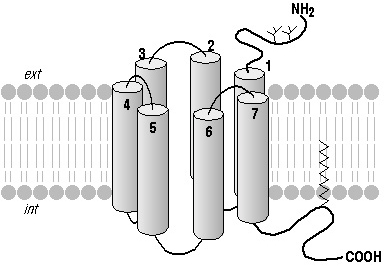
Un caractère amphiphile, moment dipolaire, un tour Example: Récepteurs couplés aux Protéines G
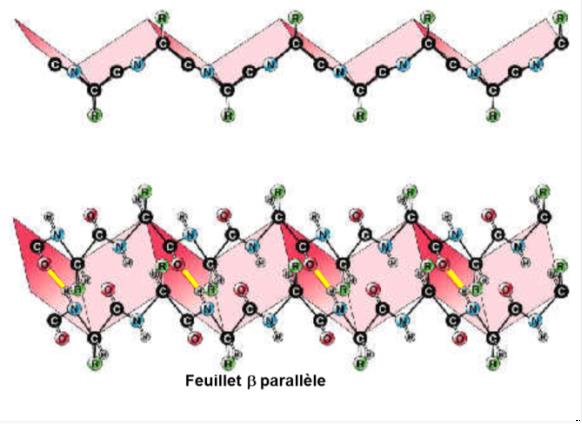
STRUCTURES SECONDAIRES: FEUILLET-β
Seconde conformation: stable, complétement étendue, liaison hydrogènes entre atomes NH et CO de(s) la chaine(s) principale(s).
La fibroïne est une protéine sécrétée par le Bombyx mori (ver à soie) qui donnera le fil de soie.
Cette protéine est constituée essentiellement de feuillets plissés β.
Le feuillet a un sens (N ” C) ! : parallèle, antiparallèle
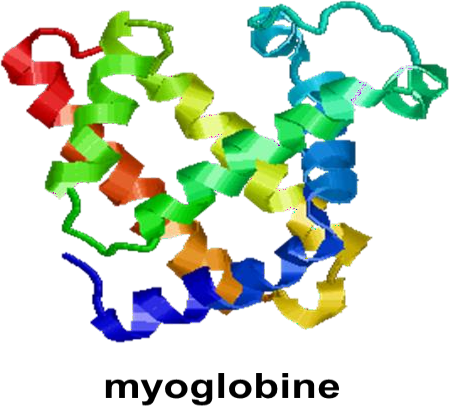
Structure tertiaire
La structure tertiaire consiste en une organisation des structures secondaires entre elles.
Cela implique l’apparition de liaisons hydrogène, ioniques, de forces hydrophobes et parfois de ponts disulfure.
La structure tertiaire correspond à la structure tridimensionnelle de la protéine.
Une structure tertiaire n’est pas une structure figée : elle peut se modifier (se tordre, se déformer) sous l’effet de la fixation d’une molécule (ligand) ou sous l’effet de la variation d’un paramètre physico-chimique (pH, température).
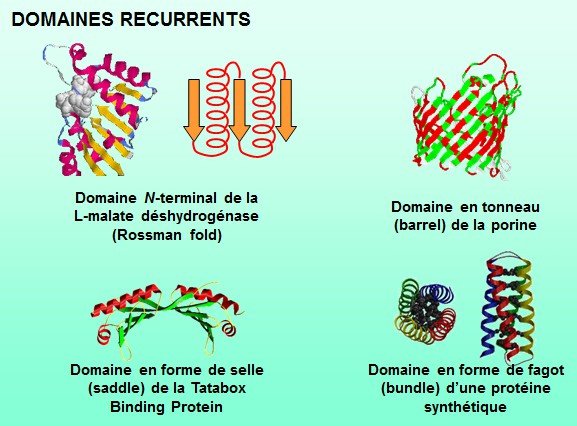
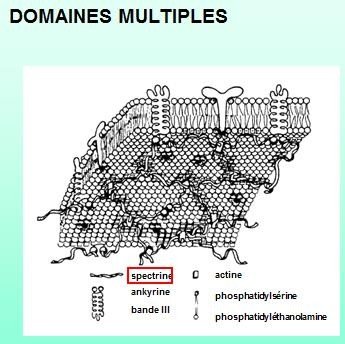
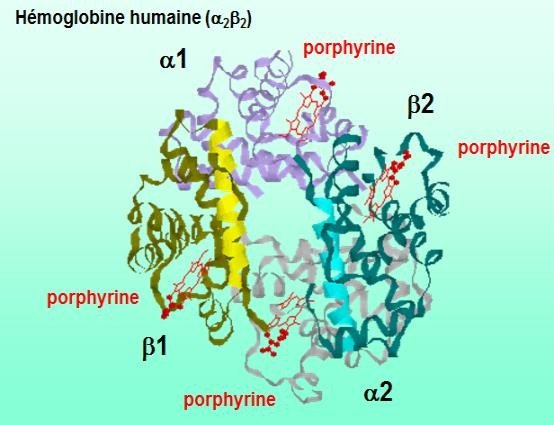
Structure quaternaire
La structure quaternaire est l’association de plusieurs chaînes protéiques identiques ou différentes.
On obtient donc des homo- (créatine kinase par exemple) ou hétéro-polymères.
Certains hétéro-polymères sont très complexes comme l’ATPase mitochondriale.
Toutes les protéines n’ont pas nécessairement de structure IVaire.
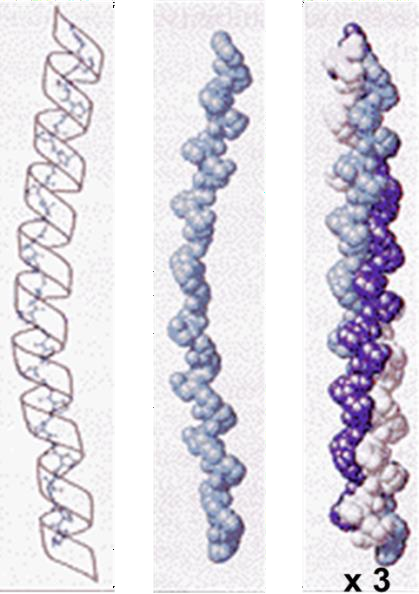
Le collagène :
Le collagène est très répandu dans le règne animal.
C’est la principale protéine des tissus conjonctifs et du squelette des vertébrés.
Il forme des fibrilles qui résistent à la traction.
La molécule de collagène est constituée de 3 chaînes peptidiques, dont deux au moins sont les mêmes dans tous les différents collagènes.
Ce sont des cylindres d’environ 3 x 1000 acides
aminés, de 280 nm de longueur et 1,4 nm de diamètre, avec une masse moléculaire proche de 300 kDa.
La séquence du collagène comporte des séries de triplets où la glycine occupe la même position.
Des zones polaires séparent ces séquences :
Gly-Ala-Pro Gly-Pro-Ala Gly-Pro-Pro(OH)
Les résidus de Pro et Pro(OH) imposent une conformation hélicoïdale (droite), avec un triplé dans chaque spire, sans liaison hydrogène.
La structure spatiale est complétée par la formation d’une triple hélice grâce, cette fois-ci, à l’établissement de liaisons H inter-chaînes nombreuses, et aussi à la présence de glycine, qui se trouve à l’intérieur de la triple hélice.
Classification des protéines.
Classification selon la forme des molécules. Protéines fibreuses ou scléroprotéines.
Pratiquement insolubles.
Fibroïnes de la soie ; collagènes (tissus conjonctifs… transformables par la chaleur en gélatines) ; kératines.
Protéines globulaires ou sphéroprotéines : Forme générale sphérique ou ovoïde.
Classification selon la solubilité.
Albumines. Solubles dans l’eau distillée.
Précipitent par addition de sulfate d’ammonium entre 70 et 100% de la saturation. pHi < 7 (caractère acide).
Globulines. Insolubles dans l’eau pure, mais solubles dans les solutions salines diluées (NaCl 5%), précipitent par addition de sulfate d’ammonium à 50% de la saturation.
Souvent des glycoprotéines ou lipoprotéines.
Protamines et histones. Solubles, taille petite (plutôt polypeptides que protéines) ; très basiques (lysine et arginine) pHi élevé.
Globines.solubles dans l’eau.
Prolamines et glutélines
Protéines végétales insolubles dans l’eau, mais solubles dans les acides et les bases dilués.
Classification selon la composition.
Holoprotéines. Elles ne sont constituées que d’acides aminés.
Hétéroprotéines. Elles comportent une ou plusieurs chaînes peptidiques associées (homoprotéine) liées par covalence à un groupement prosthétique de nature non glucidique.
La nature de ce groupement est extrêmement variée :
glucide : glycoprotéines
lipide : lipoprotéines
phosphate : phosphoprotéines
ion métallique : chromoprotéines (hémoglobines, cytochromes)
Fonctions biologiques des protéines
Les enzymes
Ce sont des catalyseurs qui accélèrent les vitesses des réactions biologiques.
Chaque enzyme possède une fonction spécifique et agit sur une réaction métabolique particulière.
En présence d’un enzyme, la vitesse d’une réaction dans les cellules peut atteindre 1020 fois la vitesse mesurée en absence d’enzyme.
Les enzymes sont classés en fonction de la nature de la réaction qu’ils catalysent, tel que le transfert d’un groupement phosphate (phosphotransférase) ou une réaction d’oxydo-réduction (oxydoréductase).
Aussi, un enzyme peut avoir deux noms, par exemple l’alcool : NAD+ oxydoréductase s’appelle aussi l’alcool déshydrogénase.
Cet enzyme enlève un hydrogène de l’alcool et fait subir une réaction d’oxydo-réduction au NAD+.
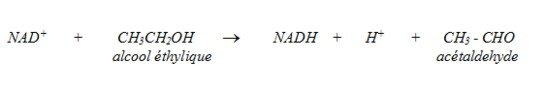
Aussi, nous avons la L-lactate cytochrome c oxydoréductase ou la flavodéshydrogénase.
Les protéines de régulation
Elles régulent la capacité d’autres protéines à réaliser leurs fonctions physiologiques.
Exemples :
l’insuline, hormone qui régule le métabolisme du glucose chez les animaux.
L’insuline est une petite protéine (5 à 7 kDa), formée de 2 chaînes polypeptidiques liées ensemble par des ponts disulfures.
La somatotropine (11 kDa) et la thyrotropine sont des hormones qui stimulent la glande thyroïdale.
Les protéines de transport
Elles transportent des substances spécifiques d’un endroit à un autre.
L’hémoglobine transporte l’oxygène des poumons aux tissus.
La sérum albumine transporte les acides gras des tissus adipeux à différents organes.
Certaines protéines membranaires transportent des molécules métabolisées à travers la membrane.
Ainsi, grâce à ces protéines, des produits tels que le glucose et les acides aminés traversent la membrane cellulaire.
Les protéines de stockage
Elles sont des protéines de réserve des produits nutritifs.
Parmi ces protéines, on trouve :
L’ovalbumine, la protéine du blanc d’œuf, fournit à l’embryon d’oiseau de l’azote durant sa présence dans l’œuf.
La caséine se trouve dans le lait et est une source d’azote pour les enfants.
La ferritine se trouve dans les tissus animaux.
Elle fixe le fer, permettant ainsi la synthèse des protéines telle que l’hémoglobine.
Une molécule de ferritine fixe 4500 atomes de fer, soit 35% de son poids égal à 460 kDa.
Les protéines de mouvement et de contraction
Elles se présentent sous forme de filaments.
Exemples, l’actine et la myosine qui forment le système de contraction des cellules.
La division cellulaire, la contraction musculaire et le déplacement cellulaire représentent certains des moyens par lesquels les cellules exécutent leurs mouvements.
Les protéines de structure
Elles renforcent et protègent les cellules et les tissus.
Les monomères des protéines structurales se polymérisent pour former de longues fibres, comme c’est le cas par exemple dans les cheveux.
Les α-kératines sont des protéines fibrillaires insolubles formant les cheveux et les ongles.
Le collagène, protéine fibrillaire insoluble, se trouve dans les os, les tendons, le cartilage.
Il forme le tiers des protéines présentes chez un vertébré.
L’élastine est un composé important des ligaments.
Les protéines de protection et de défense
Les immunoglobulines ou anticorps produites par les lymphocytes sont des protéines de protection.
Les anticorps « ignorent » les molécules intrinsèques à l’organisme et reconnaissent et neutralisent les molécules étrangères dont la présence est due à l’invasion de l’organisme par les bactéries, les virus ou d’autres agents d’infection.
La thrombine et le fibrinogène empêche la perte de sang lorsque le système circulaire est endommagé.
Aussi, nous retrouvons des protéines de défense telles que les protéines neurotoxiques des serpents et la ricine chez les végétaux.
Les protéines exotiques.
Les protéines qui vivent dans les eaux glacées des océans arctique et antarctique possèdent des protéines anti-congélation.
La monelline, protéine que l’on trouve dans une plante africaine, possède un goût doux.
Certains organismes marins secrètent des protéines gluantes leur permettant de s’attacher aux surfaces solides.
Les protéines possédant des groupements en plus que les acides aminés Les glycoprotéines
Ce sont des protéines qui contiennent des glycannes.
Elles se trouvent essentiellement dans les membranes, la partie glycosylée se trouvant à l’extérieur de la cellule.
Les lyoprotéines
Les lipoprotéines du plasma humain transportent les lipides qui sont insolubles dans l’eau et qui sont entre autres utilisées pour la synthèse des membranes.
On distingue les
lipoprotéines de haute densité, les α1-lyoprotéines de densité ρ comprise entre 1,063 et 1,210.
Ces lipoprotéines s’appellent aussi HDL ou high density lipoprotein.
Aussi, il existe les lipoprotéines de basse densité, ρ < 1,063, appelées aussi LDL ou low density lipoprotein.
Ces lipoprotéines servent comme indicateur clinique pour les maladies vasculaires.
Les nucléoprotéines
Elles sont impliquées dans le stockage et la transmission de l’information génétique.
Les virus et les chromosomes sont des complexes protéine – acide nucléique.
Les phosphoprotéines
Elles possèdent des groupements phosphates liés aux groupement hydroxyle (HO) de la sérine, la thréonine et la tyrosine.
Exemple : la caséine, protéine essentielle du lait, possède plusieurs groupements phosphates et fournit le phosphore essentiel à la croissance de l’enfant.
Les métalloprotéines
Le métal est stocké (cas de la ferritine) ou il participe à une réaction catalytique de transfert d’électrons.
Les hémoprotéines
Elles possèdent un groupement prosthétique, l’hème.
Exemple : l’hémoglobine et la myoglobine.
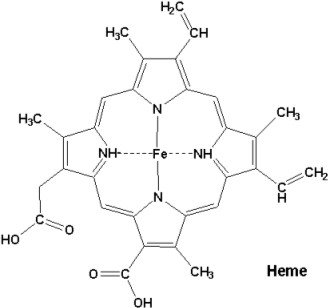
.
Structure de l’hème.
Les flavoprotéines
Elles sont des oxydoréductases où la flavine joue un rôle important dans l’activité protéique.
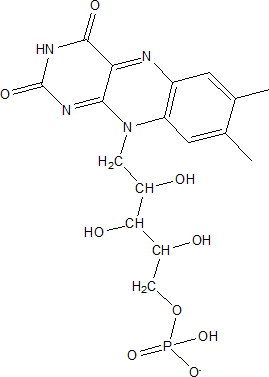
Structure de la flavine mononucléotide ou FMN
