LES HALOGENES F, Cl, Br, I et At*
LES HALOGENES
F, Cl, Br, I et At*
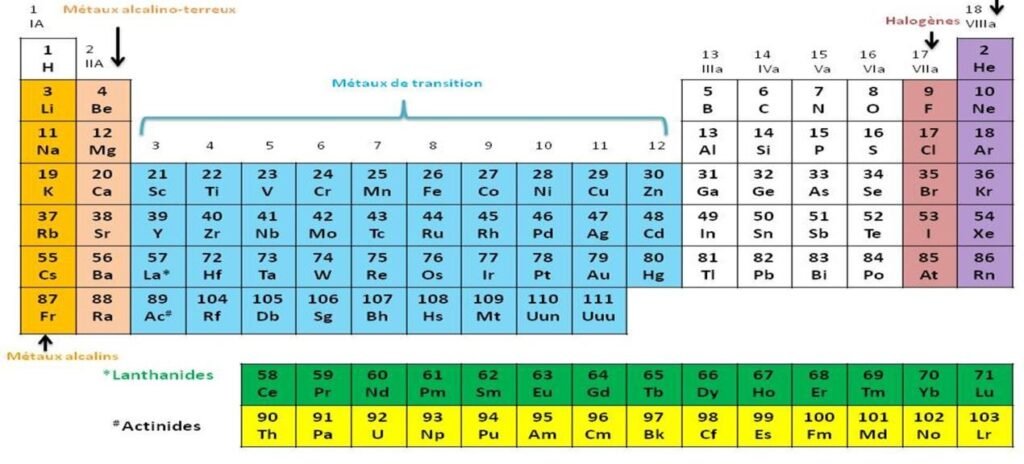
Halogènes : groupe 17
Figure 1– Classification des halogènes dans le tableau périodique.
| Nom | Symbole | Numéro atomique | Structure électronique | Etat d’oxydation (≠0) |
| Fluor | F | 9 | 2 5[He] 2s 2p | -I |
| Chlore | Cl | 17 | 2 5[Ne] 3s 3p | ±I, +III, +V, +VII |
| Brome | Br | 35 | 10 2 5[Ar] 3d 4s 4p | ±I, +III, +V, +VII |
| Iode | I | 53 | 10 2 5[Kr]] 4d 5s 5p | ±I, +III, +V, +VII |
| Astate | At | 85 | 14 10 2 5[Xe] 4f 5d 6s 6p | / |
Tableau I– Propriétés générales des halogènes.
Les halogènes ont une structure électronique externe de type ns2 np5. (n représente la période et varie de 2 à 6).
Les halogènes possèdent sept électrons de valence , deux électrons situés sur une sous couche s et cinq électrons situés sur une sous couche p, ils appartiennent donc à la 5ème colonne du bloc p et à la 17ème colonne du tableau périodique , soit au groupe 17 (IUPAC) ou anciennement VIIA.
Pour acquérir une plus grande stabilité et satisfaire ainsi à la règle de l’octet (obtenir la structure électronique du gaz inerte le plus proche dans la classification périodique ) les halogènes ont tendance à gagner un électron et former ainsi des anions monovalents (halogénures) de type X- (X :Halogène , ex : F-) et dont l’état d’oxydation est de -I.
F ne possède qu’un seul degré d’oxydation de –I .A partir du Cl ,d’autres états d’oxydation peuvent être rencontrés allant de +I à +VII.
Ces états d’oxydation positifs sont entre autres rencontrés dans les composés oxygénés des halogènes (Cl, Br et I) par partage d’électrons de valence et s’expliquent par la présence d’orbitales d et par le fait que l’oxygène est plus électronégatif que les halogènes concernés.
Les états d’oxydation positifs les plus stables correspondent au degrés : +I , +III , +V et +VII. NB : Les corps simples des halogènes sont des molécules diatomiques : F2 ,Cl2, Br2 et I2 .Ces espèces chimiques sont très toxiques.
Etat naturel :
Les halogènes n’existent pas à l’état libre à cause de leur grande réactivité chimique, on les trouve sous forme de composés essentiellement sous forme d’halogénures.
Le Cl et le F sont relativement abondants dans la croute terrestre et occupent respectivement la 16ème et 18ème place sur l’échelle de répartition des éléments chimiques sur terre.
Ils sont suivis par le Br puis par l’ I qui existe à l’état d’impureté dans les
–
gisements de nitrates du chili sous forme d’iodate (IO
3
) (de Ca et de Na principalement).
L’ At (élément radioactif) est extrêmement rare et n’existe qu’à l’état de traces (Il est très toxique).
| Elément | Teneur en % masse dans croute terrestre | Rang |
| F | 0,029 | 18 |
| Cl | 0.045 | 16 |
| Br | 0.0002 | / |
| I | 5 . 10-5 | / |
Tableau II– Abondance des halogènes dans la croute terrestre.
Dans l’eau de mer, c’est le Cl qui est le plus répandu de tous les halogènes avec une teneur d’environ 1,9% d’ions chlorures principalement sous forme de NaCl.
Certaines étendues d’eau contiennent une concentration encore plus grande :
Great Salt Lake (Utah) : ≅ 23% en NaCl et Mer Morte : ≅ 8% NaCl, 13,0% MgCl , 3,5% CaCl ).
2 2
Le Br occupe la seconde place après le Cl en termes d’abondance dans l’eau de mer où il
–
existe à l’état d’ions bromures Br avec une teneur de 65 ppm.
Certaines eaux thermales sont
en outre riches en Br.
–
Les eaux naturelles contiennent normalement peu d’ions I (≅ 0,05 ppm).
Cependant, lors de
forages pétroliers, des sources d’eau contenant de grandes quantités d’iodures sont parfois découvertes (ex : sources en Californie et en Louisiane : 30-40 ppm, source au Japon : 100 ppm).
Par ailleurs, les eaux minérales renferment de l’iode en petite quantité sous forme d’iodure de potassium KI et certaines algues marines (ex : varech) constituent une source riche en I.
Plusieurs minerais renferment des halogènes, les plus courants sont cités dans le tableau suivant :
| F | Cl | Br | I | |
| Minerai principal | Fluorine : CaF2 | Halite (Sel gemme) : NaCl | Bromargyrite : AgBr | Nitrates du Chili : NaNO3 , NaIO3 |
| Autres Minerais | Fluoroapatite :Ca (PO ) F5 4 3Cryolithe :Na AlF3 6 | Sylvinite (Sel double) :KCl,NaClCarnallite (Sel double) :KCl , MgCl2, 6H2OCerargyrite : AgClAtacamite : Cu2(OH)3Cl | Embolite : Ag(Br, Cl) | Lautarite : Ca(IO )3 2Dietzeite : 7Ca(IO ) · 83 2CaCrO4Brüggenite : Ca2(IO3)H2OIodoargyrite : AgIMarshite : CuI |
Tableau III– Les minerais des halogènes.
Méthodes de préparation :
Préparation du F2 :
La préparation du F2 par électrolyse du HF en solution est très complexe en pratique avec
03 inconvénients :
Le F2 libéré à l’anode réagit systématiquement en présence de traces d’eau en formant du HF avec libération d’oxygène.
Donc impossible d’obtenir du fluor tel quel car il redonnera à chaque fois du HF.
F2 + H2O → 2HF + ½ O2
Les produits de l’électrolyse peuvent réagir entre eux avec une réaction explosive.
F2 + H2 → 2HF
Le F2 produit est un oxydant puissant, très corrosif et attaque les électrodes ainsi que l’enceinte d’électrolyse.
Pour pallier à tous ces problèmes on a recours aux solutions suivantes :
Au lieu d’utiliser du HF en solution, on procède à une distillation fractionnée du CaF2 en milieu acide pour obtenir du HF en solution et du HF anhydre.
Au HF anhydre on rajoute du KF anhydre pour améliorer la conductibilité électrique du HF et pour abaisser la température de fusion du mélange .
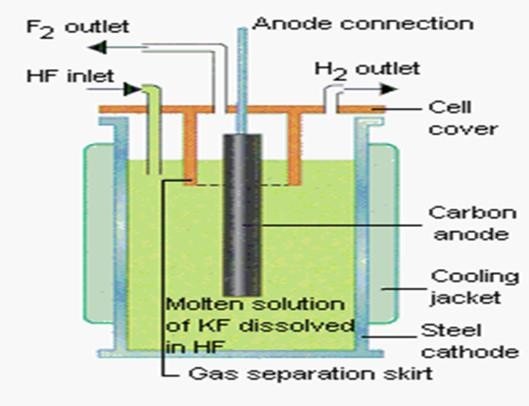
HF anhydre + KF anhydre KHF2 anhydre
L’électrolyse du KHF2 se fera à 250°C en milieu anhydre.
Couvercle
Les réactions engagées lors de l’électrolyse sont :
Anode (+) (Oxydation) : 2F– F2 + 2e–
Cathode (-) (Réduction) : 2H+ + 2e– H2
On obtiendra également 2KF anhydre qui sera recyclé.
KHF2
Diaphragme
Anode Cuve Cathode
Figure 2– Préparation du F2 par électrolyse de KHF2 anhydre.
On utilise un diaphragme pour empêcher la diffusion des gaz entre les compartiments et donc une réaction entre F2 et H2.
On utilise des électrodes spéciales afin qu’elles ne soient pas attaquées par le fluor : Cathode en acier et anode en carbone.
L’enceinte d’électrolyse sera en cuivre car le fluor réagit avec le cuivre pour former une couche protectrice de CuF2 qui empêchera ultérieurement toute attaque de l’enceinte.
Préparation du Cl2 :
Procédés d’oxydation chimique (préparations de laboratoire) :
Oxydation de l’acide chlorhydrique par l’oxygène de l’air (Procédé Deacon) :
C’est un procédé ancien qui consiste à l’ oxydation du chlorure d’hydrogène HCl par l’oxygène de l’air à 400°C avec du chlorure de cuivre (CuCl2) comme catalyseur.
4HCl + O2 → 2H2O + 2Cl2
-Oxydation de l’acide chlorhydrique par du dioxyde de manganèse : Procédé le plus utilisé en laboratoire
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2
-Oxydation de l’acide chlorhydrique par du permanganate de potassium : Procédé permettant d’obtenir du Chlore pur.
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2
Electrolyse (préparation industrielle) :
Le Cl2 est industriellement préparé par électrolyse de solutions aqueuses d’acide chlorhydrique, de chlorure de sodium aqueux ou fondu ou encore de chlorure de magnésium fondu.
C’est l’électrolyse du chlorure de sodium en solution aqueuse qui représente la principale méthode de production industrielle du chlore et de soude :
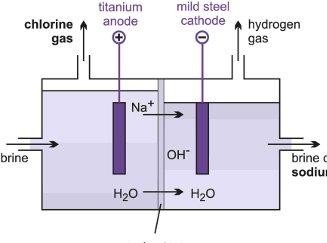
2NaCl + 2H2O → Cl2 + H2 + 2NaOH
Les réactions engagées lors de l’électrolyse sont :
Cl2 gaz
Anode
Cathode
H2 gaz
Anode (+) (Oxydation) : 2Cl– Cl2 + 2e–
NaCl
Cathode (-) (Réduction) : 2Na+ + 2H2O + 2e– 2NaOH + H2
NaOH
Diaphragme
Figure 3– Préparation du Cl2 par électrolyse de NaCl aqueux.
Remarque : On utilise un diaphragme pour empêcher la diffusion des gaz entre les compartiments et donc une réaction entre Cl2 et H2 d’une part qui aboutira à la formation de HCl et entre Cl2 et NaOH d’autre part qui aboutira à la formation d’hypochlorite de sodium (Eau de javel) .
Cl2 + H2 2HCl / Cl2 + 2NaOH
NaCl + NaClO + H2O
Préparation du Br2 :
Oxydation du bromure de sodium par le chlore gazeux :
2NaBr + Cl2 → 2NaCl + Br2
Oxydation du bromure d’hydrogène par de l’acide sulfurique :
2HBr + H2SO4 → Br2 + SO2 + 2H2O
Oxydation du bromure de potassium par du dioxyde de manganèse et de l’acide sulfurique :
2KBr + MnO2 + 2H2SO4 → Br2 + K2SO4 + MnSO4 + 2H2O
Préparation de I2 :
Oxydation des ions iodures I– par le chlore ou le dioxyde de manganèse en milieu acide :
2I– + Cl2 → I2 + 2Cl–
2I– + 4H+ + MnO2 → I2 + 2H2O + Mn2+
Traitement des nitrates du Chili avec SO
–
pour extraire IO et ensuite libérer I :
2 3 2
IO – + 3SO + 3H O → I– + 6H+ + 3SO 2-
3 2 2 4
HIO3 + 5HI → 3I2 + 3H2O
Propriétés physiques générales du groupe 17 :
| F | Cl | Br | I | At | |
| Numéro atomique (Z) | 9 | 17 | 35 | 53 | 85 |
| Masse atomique (g/mole) | 19.00 | 35.45 | 79.9 | 126.9 | 210 |
| Etat ordinaire | Gaz | Gaz | Liquide | Solide | Solide |
| Aspect | Non métal | Non métal | Non métal | Non métal | Métalloïde |
| Couleur | Jaune clair | Jaune vert | Brun rougeâtre | Gris foncé violacé | Argenté |
| Densité (g/l) | 1.55 | 2.9 | 3.10 | 4.93 | / |
| Rayon atomique (pm) | 42 | 79 | 94 | 115 | 127 |
| Rayon ionique X– (pm) | 133 | 181 | 196 | 220 | / |
| Point de fusion (°C) | -219.67 | -101.5 | -7.2 | 113.7 | 302 |
| Point d’ébullition (°C) | -188.12 | -34.04 | 58.8 | 184.4 | 334 |
| E1i (KJ/mole) | 1681 | 1251 | 1140 | 1008 | 926 |
| Ae (KJ/mole) | -328 | -349 | -325 | -295 | -270 |
| Ӽ (Pauling) | 3.98 | 3.16 | 2.96 | 2.66 | 2.2 |
| Système cristallin | Cubique | Orthorhombique | Orthorhombique | Orthorhombique | / |
Tableau IV– Propriétés physiques générales des halogènes.
Aspect :
Les halogènes sont des non métaux à l’exception de l’astate qui est un métalloïde.
Le groupe 17 renferme des éléments possédant des états physiques différents : F2 et Cl2
sont des gaz , Br2 est liquide , I2 et At sont solides .
F2 est un gaz jaune clair d’odeur piquante et très toxique.
Cl2 est un gaz jaune vert d’odeur suffocante et toxique. (Autrefois utilisé comme gaz de combat, son antidote est l’ammoniac gazeux).
–Br2 est un liquide brun rougeâtre d’odeur suffocante.
–I2 est un solide cristallin de couleur grise avec des reflets métalliques qui en se sublimant donne des vapeurs violettes.
Les halogènes sont des éléments peu denses et la densité augmente lorsque l’on descend dans le groupe.
Rayon atomique et rayon ionique :
| F | Cl | Br | I | At | |
| Rayon atomique (pm) | 42 | 79 | 94 | 115 | 127 |
| –Rayon ionique X (pm) | 133 | 181 | 196 | 220 | / |
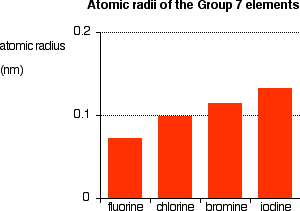
R at
F
Cl
Br
I
Figure 4– Rayon atomique du groupe 17
Points de fusion et d’ébullition :
– F possède un rayon atomique
particulièrement du groupe.
faible par rapport au
reste
-Le rayon atomique augmente lorsque augmente car le nombre de couches électroniques augmente et la distance
Z
entre
les électrons externes et le noyau s’agrandit.
-Le rayon des anions est plus grand que
le rayon des atomes correspondants (effet de répulsion) et il augmente lorsque Z
augmente.
| F | Cl | Br | I | At | |
| Point de fusion (°C) | -219.67 | -101.5 | -7.2 | 113.7 | 302 |
| Point d’ébullition (°C) | -188.12 | -34.04 | 58.8 | 184.4 | 334 |
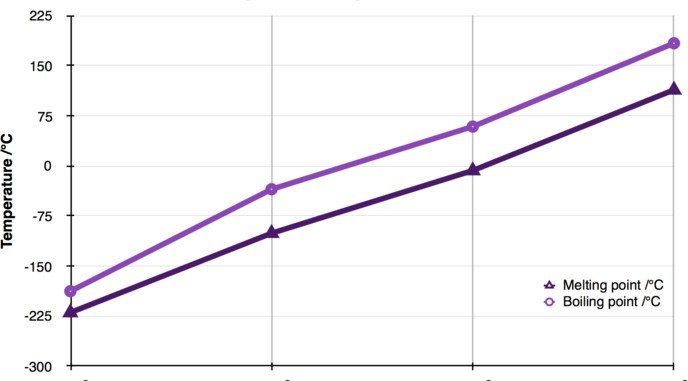
F
Cl
Br
I
Figure 5– Points de F° et Eb° du groupe 17
Les points de fusion et d’ébullition des halogènes sont peu élevés.
F, Cl présentent des points de fusion et d’ébullition négatifs.
Br est caractérisé lui aussi par un point de fusion négatif .
Ceci s’explique par les différents états physiques d’existence de ces éléments : gaz pour F et Cl et liquide pour le Br.
Les pt F° et les pt Eb augmentent quand Z augmente, car le nombre d’électrons augmente, entrainant une plus grande polarisabilité, qui engendrera plus d’interactions intermoléculaires de type Van Der Walls qui nécessitera de fournir plus d’énergie afin de les rompre d’où des points de fusion et d’ébullition plus élevés.
Energie d’ionisation :
| F | Cl | Br | I | At | |
| E1i (KJ/Mole) | 1681 | 1251 | 1140 | 1008 | 926 |
E1i
KJ/Mole
L’énergie d’ionisation des halogènes est très élevée car ils ont tendance à vouloir acquérir un électron plutôt que d’en perdre.
–F possède l’énergie d’ionisation la plus élevée du groupe.
L’énergie d’ionisation diminue lorsque Z augmente car la distance entre le noyau et les électrons externes augmente et ils deviennent plus faciles à enlever car ils sont moins attirés par le noyau.
1800
F
Cl
Br
I
At
1600
1400
1200
1000
800
600
400
200
0
1
2
3
4
5
Figure 6– Energie de 1ère ionisation du groupe 17
Affinité électronique :
Les halogènes possèdent en valeur absolue les Ae les plus élevées du tableau périodique car ils ne leur manque qu’un seul électron pour adopter la structure électronique des gaz rares.
–Cl possède l’affinité électronique la plus élevée du groupe.
Ae diminue lorsque Z augmente car l’attraction du noyau sur l’ électron à acquérir diminue du fait de la distance qui augmente.
–F possède une Ae inférieure à la valeur prévue. À cause de la petite taille des orbitales 2p qui fait en sorte que les électrons, très rapprochés les uns des autres, subissent d’importantes forces de répulsion entre eux.
Pour les autres halogènes, les orbitales sont plus grandes et par conséquent, les répulsions sont moins fortes.
| F | Cl | Br | I | At | |
| Ae (KJ/Mole) | -328 | -349 | -325 | -295 | -270 |
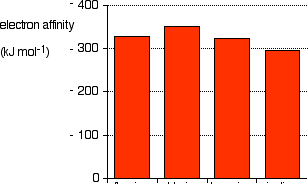
F
Cl
Br
I
Ae
Figure 7– Affinité électronique du groupe 17
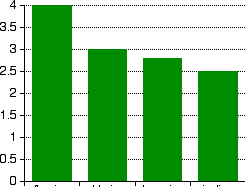
Electronégativité :
| F | Cl | Br | I | At | |
| Ӽ (Pauling) | 3.98 | 3.16 | 2.96 | 2.66 | 2.2 |
– Les halogènes sont fortement électronégatifs.
–F possède l’électronégativité la plus élevée de l’ensemble du tableau périodique.
-L’électronégativité diminue quand Z augmente.
F
Cl
Br
I
Figure 8– Electronégativité du groupe 17
Conductibilité thermique et électrique :
Les halogènes (F,Cl, Br et I) sont des non métaux ,ce sont donc de très mauvais conducteurs d’électricité et de chaleur.
L’astate est un métalloïde c’est un semi-conducteur (conduit l’électricité à chaud mais pas à froid).
Propriétés chimiques générales du groupe 17 et composés :
Pouvoir oxydant des halogènes :
Les halogènes sont tous des oxydants comme le laisse prévoir leur affinité électronique élevée, mais ce pouvoir oxydant diminue de manière régulière du F2 à I2.
Ce pouvoir oxydant est traduit par le fait qu’il est plus ou moins facile de former les anions correspondants, X–, à partir des molécules X2.
Exemple : Les réactions de déplacement : déplacement successif des halogènes à partir de leurs halogénures .
F2 + 2X– → 2F– + X2 (X: Cl , Br ou I) Cl2 + 2X– → 2Cl– + X2 (X: Br ou I)
Br2 + 2I– → 2Br– + I2
PS: I2 ne peut rien déplacer.
Réactions avec H2 et formation d’acides halogénés ou halogénures d’hydrogène HX :
F2 :
HF n’est pas préparé par combinaison directe du F2 et H2 car la réaction est explosive :
F + H 2HF
2 2
Le fluorure d’hydrogène est préparé de façon indirecte à partir de la fluorine selon la réaction :
CaF2 + H2SO4 2HF + CaSO4
Cl2 , Br2 et I2 :
La préparation des acides halogénés par combinaison directe des halogènes (Cl2 , Br2 et I2 )
avec H2, présente certains inconvénients :
Cl + H 2HCl
(Nécessite : T° élevée
et réaction à effectuer à l’abri de la lumière car risque d’explosion)
2 2
Br + H
2 2
2HBr
I + H 2HI
Réaction lente
2 2
Solutions :
Préparation de HCl par action de H2SO4 sur NaCl , selon la réaction :
NaCl + H SO HCl + NaHSO
2 4 4
Préparation de HBr et HI par action de H2SO4 sur NaBr et NaI , aboutira en présence d’un excès d’acide à une oxydation plus poussée avec formation de Br2 et I2 , selon les réactions :
H SO
2 4
en excès
NaBr + H SO HBr + NaHSO Br
2 4 4 2
NaI + H SO HI + NaHSO I
H SO
2 4
en excès
2 4 4 2
Pour pallier à ce problème , il faut utiliser un oxydant moins énergique que l’acide sulfurique
, ex: acide orthophosphorique.
NaBr + H PO HBr + NaH PO
3 4 2 4
NaI + H PO HI + NaH PO
3 4 2 4
| Acide halogénés | HFAcide fluorhydrique | HClAcide chlorhydrique | HBrAcide bromhydrique | HIAcide iodhydrique |
| Etat physique à 25°C | Liquide incolore | Gaz incolore | Gaz incolore | Gaz incolore |
| Force d’acidité | + | ++ | +++ | ++++ |
| Augmente de HF à HI | ||||
| Stabilité | Diminue de HF à HI | |||
| Action sur métaux | +sauf: Pt , Au et Ag | +sauf: Pt et Au | – | – |
| Conductibilité | + | – | – | – |
| T° F (C°) | -83 | -114 | -87 | -51 |
| T° Eb (C°) | 19,4 | -85 | -67 | -35 |
| -De HCl à HI la polarisabilité augmente avec développement de plus d’interactions de type Van Der Walls (Keesom,Debye et London) d’où élévation des températures afin de casser ces liaisons.-HF est moins polarisable que HCl : on devrait donc avoir T°Eb (HF) < T°Eb (HCl). Cependant, HF s’associe aussi par des liaisons hydrogène plus énergétiques que les interactions de Van der Waals ce qui explique l’anomalie constatée dans l’évolution. | ||||
Tableau V– Propriétés des acides halogénés.
Réactions avec H2O :
F2 :
F2 + H2O 2HF + ½ O2
(Réaction spontanée)
Cl2 :
Cl + H O 2HCl + ½ O2
Réaction lente
2 2
Activation photochimique ou catalytique (Pt)
Cl2 + H2O HCl + HClO
Br2 :
Br2 + H2O 2HBr + ½ O2
Réaction lente
Activation photochimique ou catalytique (Pt)
Br + H O HBr + HBrO
2 2
I2:
I2 est très peu soluble dans l’eau.
C’est pour cela qu’on lui adjoint du KI, de façon à former
–
l’anion triiodure ( I3 ) soluble.
Cette solution s’appelle eau iodée ou “lugol“.
Réactions avec O2 et formation d’oxydes et d’oxyacides:
F2 :
Il faut distinguer F2 des autres halogènes.
F2 étant plus électronégatif qu’O2 ne forme pas d’oxydes mais des composés où l’atome de O est au D.O=+II (OF2) ou au D.O= +I (F2O2).
Ces composés sont pour l’instant des « curiosités chimiques », bien qu’on les emploie parfois en recherche pour synthétiser d’autres molécules riches en énergie (carburants pour fusée).
F2 ne se combine pas directement avec O2 et le fluorure d’oxygène OF2 est préparé par une réaction indirecte :
2F2 + 2NaOH → OF2 + 2NaF + H2O
OF2 réagit avec H2O mais ne forme pas de HOF car OF2 n’est pas un oxyde ( F2 plus électronégatif que O2) .
On aura donc la formation d’HF et O2, selon la réaction :
OF2 + H2O → 2HF + O2
Cl2 , Br2 et I2 :
–Cl2, Br2 et I2 sont moins électronégatifs que O2 et forment des oxydes au sens strict.
Comme ils peuvent dépasser l’octet, on observe des composés à divers degrés d’oxydation.
-La réaction de ces oxydes avec l’eau fournit des oxyacides.
Il en résulte une chimie très riche.
– Evolution de la force d’acidité des oxyacides: HOCl < HClO2 < HClO3 < HClO4
HOF > HOCl > HOBr > HOI
| Elément | Cl2 | Br2 | I2 |
| Oxydes | Cl2OAnhydride hypochloreux ou Hémioxyde de chlore | Br2OAnhydride hypobromeux | I2O4 |
| Cl2O3Anhydride chloreux | Br2O3Anhydride bromeux | I4O9 | |
| ClO2Dioxyde de chlore | BrO2Dioxyde de brome | I2O5 | |
| Cl2O5Anhydride chlorique | Br2O5Anhydride bromique | ||
| Cl2O6Trioxyde de chlore | |||
| Cl2O7Anhydride perchlorique |
Tableau VI– Oxydes des halogènes.
| Elément | Cl2 | Br2 | I2 |
| Oxyacides | HClOAcide hypochloreux | HBrOAcide hypobromeux | HOIAcide hypoiodeux |
| HClO2Acide chloreux | HBrO2Acide bromeux | HIO2Acide iodeux | |
| HClO3Acide chlorique | HBrO3Acide bromique | HIO3Acide iodique | |
| HClO4Acide perchlorique | HBrO4Acide perbromique | HIO4Acide periodique |
Tableau VII– Oxyacides des halogènes.
Oxydes et oxyacides de Cl2 :
Cl2O :
-Préparation:
2Cl2 + 2HgO → HgO,HgCl2 + Cl2O
-Cl2O est un composé instable et à haute température il se décompose avec une réaction explosive en Cl2 et O2 :
2Cl2O → 2Cl2 + O2
–Cl2O réagit avec H2O pour former l’acide hypochloreux (HClO) , selon la réaction :
Cl2O + H2O → 2HClO
La réaction de HClO avec NaOH , aboutit à la formation d’hypochlorite de sodium (NaClO), selon la réaction :
HClO + NaOH → NaClO + H2O
ClO2 :
-Préparations:
2KClO3 + SO2 → K2SO4 + 2ClO2
2NaClO3 + Cl2 → 2NaCl + O2 + 2ClO2
–ClO2 (anhydride mixte) réagit avec H2O et forme de l’acide chloreux (HClO2) et de l’acide chlorique (HClO3), selon la réaction :
2ClO2 + H2O → HClO2 + HClO3
La réaction de HClO2 et d’HClO3 avec NaOH , aboutit respectivement à la formation de
chlorite de sodium (NaClO2) et de chlorate de sodium (NaClO3), selon les réactions :
HClO2 + NaOH → NaClO2 + H2O HClO3 + NaOH → NaClO3 + H2O
Cl2O6 :
-Préparation :
2ClO2 + 2O3 → Cl2O6 + 2O2
–Cl2O6 (anhydride mixte) réagit avec H2O et forme de l’acide chlorique (HClO3) et de l’acide perchlorique (HClO4), selon la réaction :
Cl2O6 + H2O → HClO3 + HClO4
La réaction de HClO3 et d’HClO4 avec NaOH , aboutit respectivement à la formation de
chlorate de sodium (NaClO3) et de perchlorate de sodium (NaClO4), selon les réactions :
Cl2O7 :
HClO3 + NaOH → NaClO3 + H2O HClO4 + NaOH → NaClO4 + H2O
-Préparation:
P4O10
2HClO4 → Cl2O7 + H2O
–Cl2O7 réagit avec H2O pour former de l’acide perchlorique (HClO4), selon la réaction :
Cl2O7 + H2O → 2HClO4
La réaction de HClO4 avec NaOH , aboutit à la formation de perchlorate de sodium
(NaClO4), selon la réaction :
HClO4 + NaOH → NaClO4 + H2O
Réactions avec les halogènes et formation de composés inter-halogénés AXn :
Les halogènes peuvent réagir entre eux et former des halogénures mixtes ou composés inter-halogénés de type AXn avec (A≠F) et n= 1 , 3 , 5 ou 7 , selon la réaction générale :
½ A2 + (n/2) X2 AXn
Ex : ½ Cl2 + ½ F2 ClF
Propriétés des composés inter-halogénés :
-La liaison est essentiellement covalente à cause de la faible différence d’électronégativité entre les halogènes.
-Du point de vue stérique A est le + gros élément et X le plus petit.
-Les composés inter-halogénés régissent avec l’eau avec formation d’un halogénure d’acide et d’un oxyde acide .
Ex : ICl + H2O HCl + HOI
| AX | AX3 | AX5 | AX7 |
| ClF | ClF3 | ClF5 | |
| BrF | BrF3 | BrF5 | |
| BrCl | BrCl3 | BrCl5 | |
| ICl | ICl3 | ICl5 | |
| IBr | IBr3 | ||
| IF | IF3 | IF5 | IF7 |
Tableau VIII– Composés inter-halogénés.
Réactions avec les métaux et formation d’halogénures métalliques MX :
L’ action des acides halogénés sur des métaux , leurs oxydes ou leurs carbonates, aboutit à la formation d’halogénures métalliques , selon les réactions :
M + HX MX + ½ H2
M2O + 2HX 2MX + H2O M2CO3 + 2HX
2MX + H2CO3
Remarque : le métal M n’est pas toujours monovalent, il faudra alors équilibrer les réactions :
EX: Mg + 2HCl MgCl2 + H2
Propriétés des halogénures métalliques :
-La stabilité diminue en allant des fluorures vers les iodures.
-Les halogénures les plus répandus sont les chlorures.
-Caractères des liaisons entre M et X :
Bloc s : liaisons ioniques (à l’exception du Be : caractère covalent).
Bloc p : liaisons covalentes ( à l’exception des fluorures qui ont un caractère ionique prépondérant)
-M peut posséder deux degrés d’oxydation différents :
ex :Hg2Cl2 (mercure mercureux) et HgCl2 (mercure mercurique).
SnCl2 (chlorure stanneux) et SnCl4 (chlorure stannique).
Caractère ionique pour le degré d’oxydation faible et caractère covalent pour le degré d’oxydation élevé.
Réactions avec les non métaux :
Le fluor se combine directement avec tous les non métaux à l’exception de N2, O2.
Ex : CF4 , SF6
Le chlore également réagit directement avec les non métaux. Ex : PCl3 , PCl5
Ex : La réaction du soufre avec les halogènes , aboutit à la formation des composés suivants :
| F | Cl | Br | I |
| S2F2 | S2Cl2 | S2Br2 | SI2 |
| SF2 | SCl2 | ||
| SF6 |
NB : Seul F admet des combinaisons jusqu’à SX6.
Le SI6 n’est pas possible à cause de l’encombrement stérique (Iode étant trop volumineux).
Réactions avec les bases et formation de sels et oxysels :
Les halogènes réagissent avec la soude pour former des sels et oxysels :
X2 + 2OH– XO– + X– + H2O (Réaction de dismutation) Ex : Cl2 + 2NaOH
NaClO + NaCl + H2O
Usages industriels et médicaux :
Usages industriels :
Fluor :
70% à 80% du F produit est consacré à la préparation d’UF6, un gaz qui sert à
2
l’enrichissement isotopique de l’uranium pour les centrales nucléaires.
F est utilisé pour la production de SF6, un gaz très stable, non corrosif et ayant des
2
propriétés diélectriques utilisé dans les transformateurs de haute tension.
F est utilisé pour la synthèse de certains produits organiques :
2
Les fréons ou CFC (chlorofluorocarbones) : gaz développés pour la réfrigération.
Ils ne sont pratiquement plus utilisés de nos jours parce qu’ils sont soupçonnés de jouer un rôle dans la détérioration de la couche d’ozone.
Le Téflon : polytétrafluoroéthylène (PTFE) : C’est un polymère blanc anti-adhésif qui résiste très bien aux agents chimiques et à la chaleur.
Il est insoluble dans la grande majorité des solvants, c’est un très bon isolant électrique qui sert souvent de revêtement de protection.
–HF sert à la gravure sur verre :
SiO2 + 4HF → SiF4 + 2H2O
Ne jamais stocker HF dans un récipient en verre.
Le polyéthylène et le téflon sont compatibles pour le stockage.
–CaF2 et NaF sont utilisés comme conservateurs dans l’industrie alimentaire.
Chlore :
–Cl2 est utilisé dans la fabrication de très nombreux produits chimiques et dans le commerce, on trouve plus de 15 000 produits chlorés.
–Cl2 intervient dans la synthèse du titane, du silicium et de la méthylcellulose.
–Cl2 sert à la fabrication de PVC qui est utilisé pour l’élaboration de : tuyaux, tubes isolants et de revêtements protecteurs de réservoirs métalliques.
–Cl2 sert à la production de produits de blanchiment (papiers et textiles).
–Cl2 sert à la fabrication de produits de désinfection (usines de traitement des eaux potables et piscines).
–NaClO (eau de Javel) sert de désinfectant domestique et d’agent de blanchiment (textile).
–HCl est utilisé dans des applications diverses : le contrôle du pH, la régénération des résines échangeuses d’ions utilisées dans le traitement des eaux usées, la neutralisation des produits alcalins ou des déchets.
Il est également utilisé dans de nombreux procédés de production de produits chimiques organiques ( p-phénylènediamine, résines de polycarbonate, bisphénol A, résines de PVC et éthanol).
Brome :
–Br sert à la synthèse de composés organiques bromés pour des applications spécifiques :
2
Pesticides, herbicides et fongicides.
Additifs anti-feu et produits d’ignifugation de vêtements, fibres, plastiques, tapis …etc. (retardent la formation de flammes).
Br est utilisé dans la désinfection de l’eau de piscine.
2
Iode :
Dans la purification de métaux tels que Ti, Zr, Hf.
Catalyseur pour la production de caoutchouc synthétique.
Dans la fabrication de colorants, teintures et pigments.
HI est utilisé dans les synthèses organiques et inorganiques comme source d’ions iodures.
–ICl (monochlorure d’iode) est utilisé en bromatologie pour le calcul de l’indice d’iode qui caractérise le degré de saturation des acides gras.
Usages médicaux :
Fluor :
-Le fluor est utilisé dans les dentifrices fluorés pour la prophylaxie de la carie dentaire. À cet effet, certains pays introduisent systématiquement du fluor dans les eaux de consommation mais de façon très réglementée car les composés fluorés restent toxi- ques ( risque de fluorose ).
-Médicaments à base de fluor :
Présence du fluor dans 20 % des médicaments sur le marché internationale.
L’insertion du fluor dans une molécule modifie sa réactivité et sa biodisponibilité.
Corticostéroïdes : Acétate de la 9-fluoro-dihydrocortisone : 11 fois plus actif que l’acétate de la dihydrocortisone et ne provoque pas de gonflement de tissus par rétention d’eau.
Antiviraux : Trifluridine contre l’herpès.
Antibiotiques : Fluoroquinolones.
Anti-inflammatoire : Flurbiprofène.
Antifongiques : Fluconazole.
Anesthésiques : Composés volatiles, ininflammables et stables métaboliquement.
Ex : Séoflurane, Desflurane, Isoflurane.
Médicaments du SNC : Domaine important d’application des molécules fluorées puisqu’ on peut augmenter la lipophilie grâce au fluor et rendre donc la molécule susceptible de passer la BHE (barrière hémato-encéphalique).
Chlore :
85 % des produits pharmaceutiques fabriqués dans le monde utilisent dans leurs schémas de synthèse du Cl2 ou contiennent l’élément chlore.
-Exemples de médicaments contenant du chlore:
Clopidogrel : antiagrégant plaquettaire.
Amlodipine : antagoniste des canaux calciques de type L (responsables de la contraction des muscles lisses) utilisé comme antihypertenseur et pour le traitement de l’angine de poitrine.
Diclofénac : anti-inflammatoires non stéroïdiens (AINS).
Halopéridol : antipsychotique de la classe des neuroleptiques.
Ce médicament est utilisé pour le contrôle des symptômes des psychoses aiguës, de la schizophrénie aiguë, des phases maniaques chez les bipolaires (maniaco-dépressifs).
-La solution de Dakin est un liquide antiseptique utilisé pour le lavage des plaies et
des muqueuses, de couleur rose et à l’odeur d’eau de Javel.
Elle est à base d’hypochlorite de sodium à 0,5 % de chlore actif additionnée de permanganate de potassium pour la stabiliser vis-à-vis de la lumière UV.
-NaCl:
-Rôle physiologique de NaCl :
Dans l’organisme, NaCl a de multiples fonctions avec, en particulier, le maintien de l’équilibre hydro électrolytique.
Le passage important de chlorure de sodium dans le milieu dit « extracellulaire » entraine une majoration de la tension artérielle avec, dans les cas plus avancés, des œdèmes allant parfois jusqu’à l’œdème pulmonaire.
La perte de NaCl, à l’inverse, entraine une déshydratation qui peut aller jusqu’à l’état de choc.
– NaCl est indiqué, seul, dans les cas suivants :
Sous forme injectable dans le:
-Traitement de la déshydratation extracellulaire.
-Comme transporteur ou diluant de médicaments compatibles pour administration parentérale intraveineuse.
En larmes artificielles dans le traitement symptomatique du syndrome de l’œil sec.
–HCl : est secrété par les cellules pariétales de l’estomac (pH=1 à 2).
Un à deux litres de HCl peuvent être produits par jour.
Le rôle physiologique de HCl est :
-d’intervenir dans la conversion du pepsinogène en pepsine, enzyme qui sert à la digestion des protéines.
-d’agir sur les glucides en commençant la dégradation du saccharose en glucose et fructose.
-de servir à aseptiser le bol alimentaire : en détruisant la majorité des bactéries , virus, levures et champignons qui pourraient pénétrer dans le tube digestif en même temps que les aliments.
Parmi les usages pharmaceutiques de HCl :
-Intervient dans la synthèse de certains médicaments (ex :acide ascorbique).
-Sert d’excipient dans plusieurs médicaments (Son rôle sera d’ajuster le pH)
-Desionisation de l’eau.
-Exemples de médicaments à base d’HCl :
Metformine HCl : Antidiabétique orale administré pour le diabète de type 2
Cetirizine Hydrochloride : Antihistaminique (lutte contre les allergies)
Adrenaline HCl : injection utilisé pour traiter les réactions allergiques graves (anaphylaxie), choc anaphylactique, agit comme un bronchodilatateur en ouvrant les voies respiratoires .
Brome :
La production de substances pharmaceutiques est une application clé des composés bromés.
Les substances bromées sont des ingrédients importants de nombreux médicaments notamment d’analgésiques, de sédatifs et d’antihistaminiques :
-Bromures de K ou Na et le bromure de Ca sont utilisés comme sédatifs nerveux.
–Bromure de pinavérium (DICETEL) est un spasmolytique dont les effets s’exercent sélectivement au niveau du tube digestif.
C’est un antagoniste calcique qui inhibe l’entrée du calcium au niveau de la cellule musculaire lisse intestinale.
–Bromo-galactogluconate de calcium (Calcibronate) est utilisé comme sédatif nerveux. d-Iode :
L’iode est important en physiologie humaine car il rentre dans la synthèse des hor- mones thyroïdiennes : la thyroxine (T4) et la triiodothyronine (T3), qui agissent sur à peu près sur tous les métabolismes de base, la synthèse des protéines, la croissance des os longs , le développement neuronal…etc .
La carence en iode est à l’origine de goitres, de retards de croissance et de divers troubles mentaux dont le crétinisme.
Vue l’importance de l’iode dans le fonctionnement de la thyroïde , une petite quantité d’iode est rajoutée au sel alimentaire à titre préventif .
22
-La teinture d’iode, servait autrefois d’antiseptique.
De nos jours, on utilise l’iso-bétadine, une substance dans laquelle les molécules d’iode sont “enrobées” dans de la polyvinylpyrrolidone.
Grâce à l’absence d’irritations, l’applicabilité de l’iso-bétadine est de loin supérieure à celle de la teinture d’iode.
-L’iode entre dans la fabrication des puces de pacemaker (lithium-iode).
-L’iode possède une forte opacité aux rayons X.
Il est utilisé comme agent de contraste en imagerie médicale pour opacifier des organes (reins, artères, veines, vésicule biliaire, cerveau… etc).
-Certains isotopes radioactifs de l’iode tel que 123I sont utilisés comme traceurs dans le corps humain pour la réalisation de scintigraphie.
-En radiothérapie contre le cancer de la thyroïde, 131I se fixe sur la thyroïde et les cellules métastasiques pour les détruire, néanmoins il expose les autres cellules à un rayonnement interne et augmente par conséquent le risque de développer un second cancer.
–KI est employé :
en tant qu’expectorant pour traiter la congestion de poumon.
dans le traitement d’une infection fongique dénommée « sporotrichose ».
en cas de contamination radioactive : l’administration préventive permet de saturer la thyroïde en iode non radioactif afin d’empêcher l’iode radioactif de s’y déposer et d’entrainer un cancer.
en microbiologie le lugol est utilisé pour réaliser la coloration de gram et distinguer ainsi les bactéries selon leurs affinités tinctoriales.
en botanique pour la mise en évidence des granules d’amidon auxquels il communique une coloration d’un bleu intense.
-Les médicaments à base d’iode:
Il existe divers médicaments contenant un ou plusieurs atomes d’iode inclus dans une molécule organique.
Amiodarone : utilisé comme antiarythmique dans les troubles du rythme.
En traitement prolongé, il apporte une grande quantité d’iode et est souvent à l’origine de troubles thyroïdiens.
Iododésoxycytidine (Cuterpes): antiviral utilisé pour le traitement de l’herpès sous forme de pommade à 1%.
Polyvidone iodée PVP-I: Antiseptique bactéricide à large spectre (en moins de 5 min in vitro, sur l’ensemble des bactéries), fongicide sur les levures et champignons filamenteux et virucide.
Elle agit par libération d’iode actif entraînant la dénaturation des protéines et des acides nucléiques.
Les produits de contraste iodés: sont utilisés en radiologie pour explorer des cavités : vaisseaux, voies urinaires, voies biliaires et cavité utérine.
Dans la majorité des cas , ils sont administrés par voie vasculaire et doivent être hydrosolubles.
Exemple : iomeron utilisé pour la réalisation d’une urographie intraveineuse pour juger du bon fonctionnement du rein.
Glossaire
Activation catalytique : Processus pour porter la matière sur un état énergétique excité sous l’influence d’un catalyseur.
Activation photochimique : Processus pour porter la matière sur un état énergétique excité sous l’influence de photons incidents.
Administration parentérale : Toute administration qui se fait autrement que par la bouche ou le rectum.
Exemple : administration par voie intraveineuse, administration intramusculaire et administration sous-cutanée.
Affinité électronique : Quantité d’énergie dégagée à la suite de la capture d’un électron par un atome isolé.
Analgésique : Médicament qui agit contre la douleur.
Anesthésique : Médicament qui entraîne une anesthésie (Suppression de la sensibilité).L’anesthésie peut être : générale, le malade est endormi ;régionale, une région du corps est insensibilisée mais le malade est conscient ; locale, seule une petite partie du corps est insensibilisée.
Anhydre : Se dit d’une substance ne contenant pas d’eau.
Anion : Ion portant une charge électrique négative.
Anode : Electrode d’arrivée de courant dans un milieu de conductivité différente.
Dans une cellule d’électrolyse, la polarité est inversée et l’anode constitue le pôle positif.
Antagoniste calcique : inhibiteur calcique.
Médicament qui freine la pénétration du calcium dans les cellules des parois des vaisseaux sanguins et du cœur.
Cela entraine une vasodilatation (augmentation du calibre) des artères, les inhibiteurs calciques améliorent ainsi l’oxygénation du cœur et diminuent la tension artérielle.
Anti-adhésif : Qui empêche de coller.
Anti-aggrégant plaquettaire : Médicament qui empêche les plaquettes de s’agglutiner et donc les caillots de se former.
L’antiagrégant plaquettaire le plus ancien est l’aspirine prise à petite dose.
Les antiagrégants ne doivent pas être confondus avec les anticoagulants dont le mécanisme d’action est différent.
Anti-arythmique : Médicament indiqué dans les troubles du rythme cardiaque.
Antibiotique : Médicament fabriqué à partir de cultures de micro-organismes ou entièrement synthétisé.
Il a la propriété de tuer des bactéries ou d’empêcher leur prolifération.
Antidiabétique : Médicament destiné à lutter contre le diabète.
Il en existe deux catégories : les antidiabétiques oraux et l’insuline, qui ne s’utilise qu’en injection.
Antifongique : Substance possédant la capacité de tuer des champignons microscopiques.
Antihistaminique : Médicament qui s’oppose aux différents effets de l’histamine.
Deux types principaux existent : les antihistaminiques de type H1 (antiallergiques) et les antihistaminiques de type H2 (antiulcéreux gastriques).
Certains antihistaminiques de type H1 sont sédatifs, d’autres n’altèrent pas la vigilance.
Anti-inflammatoire : Médicament utilisé pour lutter contre l’inflammation, processus de défense de l’organisme face à une agression, caractérisé par les signes de chaleur, douleur, rougeur et tuméfaction.
Antipsychotique : Médicament utilisé dans le traitement des psychoses.
Antiseptique : Substances ayant pour but de détruire les germes pathogènes ou d’empêcher leur multiplication sur la peau et les muqueuses (les couches de cellules recouvrant l’intérieur des organes creux en contact avec l’air).
Ce terme définit également ce qui détruit les microbes et empêche leur développement de façon générale.
Contrairement au désinfectant, qui s’utilise sur les matériaux inertes, l’antiseptique s’utilise sur les tissus vivants.
Antiviral : Médicament capable de lutter contre les virus.
Aqueux : substance en solution et dont l’eau est le solvant.
Bactéricide : Substance possédant la capacité de tuer des bactéries.
Barrière hématoencéphalique : Barrière formée d’une couche de cellules endothéliales, solidement liées entre elles, empêchant la plupart des grosses molécules et certains types de cellules sanguines de pénétrer dans le cerveau.
Biodisponibilité : Manière dont un médicament est absorbé, diffusé et éliminé par le corps.
Bromatologie: Etude scientifique et technique des aliments.
Bronchodilatateur: Médicament destiné à dilater les bronches pour faciliter le passage de l’air dans et hors des poumons.
Carie dentaire : Phénomène de déminéralisation des tissus durs de la dent (émail), causée par le milieu acide que créent les sucres apportés par l’alimentation et certaines bactéries de la plaque dentaire.
Catalyseur : Substance qui favorise une réaction chimique en abaissant l’énergie d’activation de cette réaction, sans subir elle-même aucun changement chimique permanent.
Cathode : Electrode de sortie de courant dans un milieu de conductivité différente.
Dans une cellule d’électrolyse, la polarité est inversée et la cathode constitue le pôle négatif.
Choc anaphylactique : Choc d’origine allergique se manifestant par une baisse brutale de la tension artérielle, due à une dilatation extrême des vaisseaux sanguins.
Il survient après un contact avec une substance allergisante (aliment, piqûre d’insecte, injection ou absorption de médicament).
Coloration de gram : Méthode de double coloration des bactéries consistant à faire agir successivement deux solutions colorantes.
La façon dont le germe soumis réagit à l’opération (= GRAM
+ ou – en fonction de la prise de couleur) intervient dans son identification et sa classification.
Conductivité électrique : Aptitude d’un matériau à laisser les charges électriques se déplacer librement, autrement dit à permettre le passage du courant électrique.
Conductivité thermique : Aptitude d’un matériau à transmettre la chaleur.
Conservateurs alimentaires : Substances qui prolongent la durée de conservation des denrées alimentaires en les protégeant des altérations dues aux microorganismes et/ou qui les protègent contre la croissance de microorganismes pathogènes.
Corrosif : Substance qui attaque la matière en la rongeant.
Crétinisme : Déficit intellectuel lié à une hypothyroïdie congénitale.
Densité : Nombre décimal représentant le rapport entre la masse volumique du corps et la masse volumique du corps de référence dans des conditions bien déterminées.
Le corps de référence est l’eau pour les solides et les liquides et l’air pour les gaz.
Déshydratation : Déficit de l’organisme en eau, dû à des pertes anormales de liquides (diarrhée, vomissements, transpiration abondante).
Desionisation : consiste à supprimer des ions dans un soluté ou un composé.
L’eau déionisée, également connue sous le nom d’eau déminéralisée, est de l’eau qui a eu ses ions minéraux éliminés, comme des cations tels que le Sodium, le Calcium, le fer, et le cuivre, et aussi des anions tels que chlorure et sulfate.
La désionisation est un processus chimique qui utilise des résines échangeuses d’ions spécialement fabriquées qui échange des ions Hydrogène et ions hydroxyde avec les minéraux dissous, puis qui sont recombinés ensuite pour former de l’eau.
Dismutation : réaction d’oxydo-réduction dans laquelle un même élément chimique, présent à un certain degré d’oxydation dans les réactifs, joue à la fois le rôle d’oxydant et de réducteur, se retrouvant ainsi à deux degrés d’oxydation différents dans les produits, l’un plus
élevé et l’autre plus faible que le degré d’oxydation initial.
Distillation fractionnée : Séparation des différents constituants d’un mélange de liquides miscibles, possédant des températures d’ébullition différentes (plus cette différence est grande, plus la distillation est facile).
Electrode : Elément conducteur captant ou libérant un courant électrique.
Certains appareils électriques comportent généralement deux électrodes, une anode et une cathode, chacune reliée aux deux bornes de branchement de l’appareil.
Electrolyse : Décomposition chimique de certaines substances en fusion ou en solution , produite par un courant électrique ; c’est une réaction d’oxydoréduction forcée par un apport d’énergie sous forme de courant électrique.
Quand on établit une différence de potentiel au moyen d’un générateur entre l’anode et la cathode , un champ électrique est créé dans l‘électrolyte .
Les ions positifs ou anions, se dirigent vers la cathode et sont réduits (gagnent des électrons) sous forme de métal, tandis que les ions négatifs ou cations se dirigent vers l‘anode et sont oxydés (perdent des électrons).
Electrolyte : Milieu liquide ou solide permettant la conduction du courant électrique via le déplacement des ions qu’il contient.
Electron : Particule élémentaire chargée négativement, qui gravite autour du noyau des atomes.
Electrons de valence : Electrons situés sur la couche électronique la plus externe.
Electronégativité : Aptitude d’un atome à attirer des électrons vers lui lorsqu’il est dans un composé.
Energie d’ionisation : Energie nécessaire pour arracher un électron d’un atome à l’état gazeux.
Etat d’oxydation : Correspond au nombre d’électron(s) perdu(s) ou gagné(s), il est compris entre 0 et VII et s’écrit toujours en chiffres romains.
Excipient : Substance sans activité thérapeutique entrant dans la composition du médicament ou utilisée pour sa fabrication.
L’excipient a pour fonction d’améliorer l’aspect ou le goût, d’assurer la conservation, de faciliter la mise en forme et l’administration du médicament.
Il sert aussi à acheminer la substance active vers son site d’action et à contrôler son absorption par l’organisme.
L’excipient devrait avoir une innocuité parfaite (être bien toléré) ; néanmoins certains peuvent entraîner des réactions allergiques ou des intolérances individuelles : il s’agit des excipients à effet notoire.
Expectorant : Médicament qui facilite l’élimination des mucosités (glaires) contenues dans les voies respiratoires.
Fluorose : Malformation de l’émail, inesthétique , qui se manifeste par des taches ou des lignes blanches sur les dents.
Si la fluorose est très sévère, l’émail montre souvent des malformations importantes et des taches de couleur marron.
Fongicide : substance possédant la capacité de tuer des champignons microscopiques.
Goitre : Augmentation du volume de la glande thyroïde.
Gravure sur verre : Technique qui consiste à sculpter le verre pour le décorer.
Groupe : Ensemble d’éléments ayant des propriétés chimiques similaires; ensemble des éléments d’une colonne (verticale) dans le tableau périodique ; aussi appelé famille.
Halogénure : Minéral dont le groupe anionique est un halogène.
Herbicide : Substance conçue pour tuer ou empêcher la croissance de certaines plantes jugées indésirables.
Herpès : Maladie virale due essentiellement aux virus Herpès simplex 1 et 2.
Elle se manifeste, lors des poussées, par une éruption douloureuse de fines vésicules.
Entre les poussées, le virus reste présent dans les ganglions nerveux.
Le virus de type 1 donne plutôt des lésions situées autour de la bouche, alors que le virus de type 2 atteint de préférence les organes génitaux.
Hydrosoluble : Substances qui se dissolvent dans l’eau.
Ignifugation : Opération qui a pour but de rendre moins dangereux un matériau dans son comportement au cours d’un incendie.
Indice d’iode : indique la quantité d´iode absorbée par 100 g de graisse.
Il sert à déterminer la teneur en acides gras insaturés.
Interactions intermoléculaires (Van Der Walls) : interactions électriques de faible intensité entre atomes, ou entre une molécule et un cristal.
Ion : Atome ou molécule portant une charge.
On parle de cation dans le cas d’une charge positive et d’anion dans le cas d’une charge négative.
Isolant : Matériau qui permet d’empêcher les échanges d’énergie entre deux systèmes.
On distingue : les isolants électriques, les isolants thermiques, les isolants phoniques et les isolants mécaniques.
Le contraire d’un isolant est un conducteur (électricité et chaleur), ou transmetteur (mécanique et son).
Isotope : Variété d’un élément qui a le même nombre de protons mais un nombre différent de neutrons dans le noyau.
Les isotopes d’un même élément ont le même nombre atomique mais une masse atomique différente.
IUPAC : Union internationale de chimie pure et appliquée ; organisme fixant les conventions utilisées par les chimistes.
Levure : Champignon microscopique.
Lipophilie : Propriété d’une substance qui lui confère une affinité pour les tissus adipeux/solvants organiques, ainsi qu’une faible solubilité aqueuse.
Métastase : Propagation d’une maladie maligne d’une partie du corps à une autre attribuable à la migration de cellules malignes à travers le système sanguin ou le système lymphatique.
Méthylcellulose : Dérivé de cellulose dispersible dans l´eau, très utilisé dans les colles pour papier peint.
Minerai: Roche ou minéral contenant des éléments chimiques en pourcentage suffisant pour justifier son exploitation.
Numéro atomique (Z) : Nombre de protons du noyau d’un atome.
Œdèmes : Accumulation d’eau ou de lymphe provoquant un gonflement localisé.
Œdème pulmonaire : Infiltration de lymphe dans le poumon, due à un excès de pression sanguine dans les veines pulmonaires.
Les poumons ne fonctionnent plus correctement et un essoufflement majeur apparaît.
L’œdème aigu du poumon traduit une défaillance du cœur gauche qui reçoit le sang oxygéné en provenance des poumons et le pompe vers l’aorte.
Opacité : Propriété d’un corps à laisser passer la lumière.
Un corps est transparent lorsqu’il laisse passer le maximum de luminosité au point d’en distinguer nettement une image au travers.
Un corps opaque ne laisse passer aucune lumière.
Oxyacide : acide qui contient de l’oxygène, de l’hydrogène et un autre élément chimique .
Oxydant : Entité chimique capable de capter (ou de gagner) un ou plusieurs électrons.
Oxydation : Réaction au cours de laquelle un atome ou un ion perd des électrons.
Pacemaker : Stimulateur cardiaque, familièrement appelé “pile”.
Appareil généralement implanté sous la peau du thorax, chargé de régulariser le rythme cardiaque.
Pour cela, il envoie de façon indolore des impulsions électriques.
Pesticide : Produit chimique toxique qui tue des organismes nuisibles.
Polarisabilité : Déformation du nuage électronique sous l’effet d’un champ électrique.
Polymère : Molécule constituée de la répétition de nombreuses sous-unités.
Produit de contraste : Liquide – le plus souvent injecté dans une veine – qui permet en radiologie d’accroître le contraste visuel entre les tissus que l’on cherche à voir et les tissus environnants.
Prophylaxie : Traitement ayant pour but de prévenir une maladie.
PVC : (chlorure de polyvinyle) : abréviation désignant une matière plastique.
Radioactivité : Propriété que possèdent certains éléments naturels ou artificiels d’émettre spontanément de rayonnements durant leur désintégration.
Radiothérapie : Traitement anticancéreux basé sur l’administration de rayons gamma ou de rayons X, visant à détruire ou à réduire une tumeur bien délimitée en volume.
Réaction d’oxydo-réduction : Réaction chimique au cours de laquelle se produit un transfert d’électrons.
L’espèce chimique qui capte les électrons est appelée oxydant et celle qui les cède, réducteur.
Réducteur : Entité chimique capable de perdre des électrons.
Réduction : Réaction au cours de laquelle un atome ou un ion gagne des électrons cédés par un réducteur.
Résine échangeuse d’ions : Composé solide et insoluble dans l’eau, comportant des groupements fonctionnels ionisés fixes porteurs de charges et des ions mobiles de signe contraire.
Scintigraphie : Méthode d’évaluation du fonctionnement d’un organe qui repose sur l’administration d’une substance très faiblement radioactive.
Le devenir de la substance dans l’organe étudié est suivi par des compteurs spéciaux.
Cette méthode est utilisée pour l’examen du fonctionnement de la thyroïde, des os, du foie, etc..
Sédatif : Médicament servant à réduire la souffrance physique ou mentale, à calmer les émotions ou à réduire le niveau d’éveil ou la réactivité du patient.
Spasmolytique : Médicament qui soulage les crampes.
Sporicide : Substance qui détruit les spores.
Sporotrichose : Maladie mycotique rare appartenant à la famille des levuroses et due à la présence dans l’organisme d’une moisissure toxique et parasite, Sporothrix schenckii.
Sublimation : Passage de l’état solide à l’état gazeux, sans passer par l’état liquide.
Suffocant : Il s’agit généralement d’un gaz ou d’un liquide très volatil qui, lorsqu’il est inhalé, provoque une irritation et de graves lésions au niveau des bronches et des poumons.
Ces derniers se remplissent progressivement de liquide provenant de la circulation du sang.
Ce mécanisme bloque l’arrivée d’oxygène dans l’organisme et entraîne une mort par asphyxie.
Les suffocants les plus courants sont le chlore, la chloropicrine et le phosgène.
Système cristallin : Système de classement des cristaux sur la base de leurs caractéristiques de symétrie.
Température d’ébullition : Température de passage d’un corps de l’état liquide vers l’état vapeur.
Température de fusion : Température de passage d’un corps de l’état solide vers l’état liquide.
Urographie : Technique radiographique permettant d’explorer le système urinaire qui comprend le rein et toutes les voies excrétrices jusqu’au méat urinaire (orifice externe de l’urètre).
Virucide : Substance qui détruit les virus.

