Les éléments du groupe 18
Les éléments du groupe 18
Introduction
On appelle gaz nobles, ou gaz rares, les éléments chimiques du groupe 18 (anciennement « groupe VIIIA », voire « groupe 0 ») du tableau périodique.
Ce sont l’hélium 2He, le néon 10Ne, l’argon 18Ar, le krypton 36Kr, le xénon 54Xe et le radon 86Rn, ce dernier étant radioactif, avec une période de 3,8 jours pour le radon 222, son isotope le plus stable.
Ils forment une famille d’éléments chimiques très homogène de gaz monoatomiques incolores et inodores chimiquement très peu réactifs, voire totalement inertes pour les deux plus légers — hormis dans des conditions très particulières.
L’oganesson 118Og, découvert au début du XXIe siècle, prolonge le 18e groupe, mais ses propriétés chimiques sont encore trop largement méconnues pour pouvoir le ranger dans une quelconque famille .
L’appellation “gaz rares” vient de la faible prévalence historique des gaz nobles comme substances chimiques, bien que cette désignation soit techniquement impropre car l’hélium constitue 24 % de la matière baryonique de l’univers, et l’argon 0,94 % de l’atmosphère terrestre, de sorte qu’ils ne sont pas rares.
L’appellation gaz inertes rencontrée jadis est tombée en désuétude depuis qu’on a synthétisé près d’un millier de composés et d’espèces chimiques contenant chacun des six gaz rares, bien que ces espèces requièrent souvent — mais pas nécessairement — des conditions hors équilibre très particulières pour exister.
Préconisée par l’IUPAC, l’appellation gaz nobles, issue de l’allemand “Edel gas” par analogie avec les métaux nobles (tels que l’or, également peu réactif), apparaît donc de plus en plus comme devant légitimement remplacer à terme celle de gaz.
Abondance naturelle
L’abondance des gaz nobles dans l’univers est d’autant plus faible que leur numéro atomique est plus grand.
L’hélium est le plus abondant d’entre eux, et le deuxième élément le plus abondant dans l’univers après l’hydrogène, constituant environ 24 % de la masse de la matière baryonique.
Sur Terre, l’abondance relative des gaz nobles est différente.
L’hélium n’est que le troisième gaz noble le plus abondant de l’atmosphère terrestre.
L’hélium est en effet trop léger pour que l’hélium primordial ait pu être retenu par la gravité terrestre, de sorte que l’hélium présent sur Terre provient de la désintégration α d’éléments radioactifs tels que l’uranium et le thorium de l’écorce terrestre.
L’argon, en revanche, est plus abondant sur Terre que dans l’univers car il provient de la désintégration β du potassium 40, présent lui aussi dans l’écorce terrestre, et qui donne de l’argon 40, principal isotope de l’argon terrestre, qui est pourtant assez rare dans le Système solaire : ce phénomène est à la base de la datation par le potassium- argon.
Le xénon est anormalement peu abondant sur Terre, ce qui a longtemps constitué une énigme.
Il est possible qu’il soit piégé dans les minéraux, le dioxyde de xénon XeO2 pouvant se substituer au dioxyde de silicium SiO2 dans les silicates, comme le quartz.
Le radon se forme dans la lithosphère par désintégration α du radium dans la chaine de désintégration de 238U et pose un problème de santé sérieux dans les mines d’uranium, car il est lié à des cas de cancer du poumon.
Extraction :
En termes de production industrielle, He et Ar sont les gaz nobles les plus importants.
L’hélium est extrait du gaz naturel par liquéfaction des autres gaz présents (He a le point d’ébullition le plus bas de tous les corps simples), ce qui permet d’enlever l’hélium gazeux par pompage.
Le néon est extrait comme produit secondaire de la liquéfaction de l’air, étant le seul gaz restant.
L’argon a presque le même point d’ébullition que O2 (Ar, 87 K ; O2 90K) et les deux gaz restent ensemble au cours du fractionnement du l’air liquide.
On peut séparer partiellement le mélange O2/Ar par un fractionnement ultérieur ; on mélange Ar brut avec H2 et on y fait jaillir une étincelle pour enlever O2 sous forme de H2O, l’excès de H2 étant éliminé par passage sur CuO.
Le krypton et le xénon sont en général séparés d’O2 par absorption sélective sur du charbon.
Propriétés physiques :
Les propriétés des gaz nobles s’accordent bien avec les théories modernes décrivant la structure des atomes.
Leur couche de valence est saturée, de sorte qu’ils n’établissent normalement pas de liaison covalente avec d’autres atomes, d’où leur inertie chimique.
On ne connaît que quelques centaines de composés de gaz nobles, essentiellement du xénon. À pression atmosphérique, la différence entre la température d’ébullition et la température de fusion d’un gaz noble n’excède jamais 10 °C, de sorte qu’ils n’existent à l’état liquide que dans un intervalle de températures très étroit.
Les gaz nobles présentent des interactions interatomiques faibles, de sorte que leur température d’ébullition est très basse.
Dans les conditions normales de température et de pression, ce sont tous des gaz monoatomiques : le radon est ainsi gazeux alors que sa masse atomique est supérieure à celle du plomb et du bismuth, par exemple.
L’hélium se distingue des autres gaz nobles à différents égards : sa température de fusion et sa température d’ébullition sont plus basses que celles de tous les autres substances connues ; c’est le seul élément connu qui ne peut être solidifié à pression atmosphérique (il faut une pression d’au moins 2,5 MPa à −272,2 °C pour ce faire) ; c’est le seul élément connu présentant le phénomène de superfluidité.
Les températures de fusion et d’ébullition des gaz nobles augmentent avec leur numéro atomique, c’est-à-dire en descendant le long de leur colonne du tableau périodique.
La configuration électronique des gaz nobles est caractérisée par le fait que leurs sous-couches s et p externes sont complètes, avec respectivement deux et six électrons, de sorte qu’il ne leur reste pas d’électron de valence disponible pour établir une liaison chimique avec un autre atome, en vertu de la règle de l’octet.
C’est ce qui explique leur inertie chimique.
Cette inertie est plus relative pour le krypton et plus encore pour le xénon, dont on a isolé plusieurs centaines de composés, certains étant stables à température ambiante.
Le radon semble également assez réactif, mais sa
radioactivité en a freiné l’étude.
Les gaz nobles jusqu’au xénon ont chacun plusieurs isotopes stables ; le radon, en revanche, n’en a aucun : c’est un élément radioactif.
Le radon 222, son isotope le plus stable, présente une période radioactive de 3,8 jours et donne du polonium 218 par désintégration α, qui donne en fin de compte du plomb.
Le rayon atomique des gaz nobles augmente en descendant le long de la 18e colonne en raison du nombre croissant de sous-couches électroniques.
La taille de ces atomes détermine plusieurs de leurs propriétés.
Ainsi, le potentiel d’ionisation décroît lorsque le rayon atomique augmente car les électrons de valence sont de plus en plus éloignés du noyau et interagissent par conséquent de moins en moins étroitement avec ce dernier.
Le potentiel d’ionisation des gaz nobles est le plus élevé des éléments de chaque période, ce qui reflète la stabilité de leur configuration électronique, caractérisée par la saturation de leur couche de valence.
La valeur élevée de leur potentiel d’ionisation est également liée à leur faible réactivité chimique.
Les gaz nobles les plus lourds, en revanche, ont une énergie d’ionisation qui devient comparable à celle d’autres éléments chimiques et de certaines molécules.
C’est l’observation du fait que l’énergie d’ionisation du xénon est du même ordre que celle de la molécule d’oxygène O2 qui a conduit Neil Bartlett à tenter d’oxyder le xénon avec de l’hexafluorure de platine PtF6, connu pour oxyder l’oxygène, ce qui permit de synthétiser l’hexafluoroplatinate de xénond, premier composé du xénon connu.
Les gaz nobles ne sont pas des accepteurs d’électrons susceptibles de former des anions stables : leur affinité électronique est négative.
Les propriétés macroscopiques des gaz nobles sont dominées par leurs faibles forces de van der Waals entre les atomes.
Cette force attractive augmente avec la taille des atomes car leur polarisabilité augmente et leur potentiel d’ionisation diminue.
Il s’ensuit que, lorsqu’on descend le long de la colonne, les températures de fusion et d’ébullition croissent, de même que l’enthalpie de vaporisation et la solubilité.
Composés des gaz nobles
Jusqu’en 1962 les gaz nobles paraissaient n’avoir aucune réactivité chimique et les quelques essais faits pour vaincre cette inertie n’avaient pas abouti.
Les seuls composés obtenus étaient du type clathrates.
« La clathration consiste en l’emprisonnement d’un composé dans un autre composé pouvant en certaines circonstances former des cages de taille convenable »
Composés du xénon :
Le xénon est en effet le plus réactif des gaz nobles — hormis le radon, trop radioactif pour être étudié en détail — et il forme de nombreux oxydes et fluorures dans lesquels le xénon présente des états d’oxydation 2, 4, 6 et 8 :
État d’oxydation +2 : difluorure de xénon XeF2 ;
État d’oxydation +4 : tétrafluorure de xénon XeF4, oxydifluorure de xénon XeOF2, dioxyde de xénon XeO2 ;
État d’oxydation +6 : hexafluorure de xénon XeF6, oxytétrafluorure de xénon XeOF4, dioxydifluorure de xénon XeO2F2, trioxyde de xénon XeO3 ;
État d’oxydation +8 : dioxytétrafluorure de xénon XeO2F4, trioxydifluorure de xénon XeO3F2, tétraoxyde de xénon XeO4.
Fluorures :
Les composés de Xe les plus stables sont les fluorures incolores XeF2, XeF4et XeF6.
Par irradiation avec une lumière UV, Xe réagit avec F2 à température ambiante pour donner XeF2 ; la vitesse de formation est augmentée su on utilise HF comme catalyseur, et on peut préparer XeF2 pur par cette méthode.
On peut aussi préparer le di fluorure de xénon par l’action d’une décharge électrique sur un mélange de X2 et de F2, ou en faisant passer ces gaz à travers un petit tube en nickel à 673 K.
Cette dernière méthode donne un mélange de XeF2 et XeF4 , et on peut optimiser le rendement en XeF4 en utilisant un rapport Xe:F2 de 1:5.avec un catalyseur NiF2 , la réaction se fait à une température inférieure et, même à 393 K.
XeF6 peut se former dans les mêmes conditions ;il n’est possible de préparer XeF4 sans XeF2 et /ou XeF6 ; de même XeF6 se forme toujours avec une contamination par les fluorures légers.
La séparation de XeF4 d’un mélange met en jeu une complexation préferentielle de XeF2 et XeF6 (équation*) et on enlève ensuite XeF4 sous vide alors que la séparation de XeF6 se fait par la réaction ** suivie de la décomposition thermique du complexe
Equation* : XeF2
[Xe2F3]+ [AsF6]–
XeF4 XeF6
AsF5 en excès dans BrF5 liquide XeF4
[XeF5 ]+[AsF6]–
XeF6 + 2NaF Na2[XeF8] réaction **
Tous les fluorures se subliment sous vide, et tous sont facilement décomposés par l’eau, XeF2 très lentement, XeF4 et XeF6 rapidement :
2XeF2 + 2 H2O 2Xe + 4HF +O2
6XeF4 + 12 H2O 2XeO3 +4 Xe + 24 HF+ 3O2 XeF6 + 3 H2O
XeO3+ 6HF
Les trois fluorures sont des oxydants et des agents fluorants puissants, l’ordre de réactivité étant XeF6>XeF4>XeF2.le difluorure est disponible dans le commerce et est largement utilisé pour les fluorations
Difluorure de xénon Tétrafluorure de xénon
Hexafluorure de xénon

Oxydes et oxoacides du xénon
Les trioxydes XeO3 et tétraoxyde XeO4 de xénon sont solubles dans l’eau, où ils donnent deux oxoacides, respectivement l’acide xénique H2XeO4 et l’acide perxénique H4XeO6.
Ce dernier donne des perxénates tels que le perxénate de sodium Na4XeO6, le perxénate de potassium K4XeO6, ou encore le perxénate de baryum Ba4XeO6.
Trioxyde de xénon Tétraoxyde de xénon
Acide xénique Acide perxénique
« La grande majorité des composés du xénon produits jusque dans les années 1980 combinaient le fluor et/ou l’oxygène avec le xénon ; lorsqu’ils intégraient d’autres éléments, comme l’hydrogène ou le carbone, c’étaient généralement avec des atomes électronégatifs d’oxygène et/ou de fluor.
Néanmoins, une équipe animée par Markku Räsänen de l’Université d’Helsinki a publié en 1995 la synthèse du dihydrure de xénon XeH2, puis celle de l’hydroxyhydrure de xénon HXeOH, de l’hydroxénoacétylène HXeCCH et d’autres composés du xénon.
Par la suite, Khriatchev et al. ont publié la synthèse du composé HXeOXeH par photolyse d’eau dans une matrice de xénon cryogénique.
Ils ont également fait état des molécules deutérées HXeOD et DXeOD.
Le nombre de composés connus du xénon est aujourd’hui de l’ordre du millier, certains présentant des liaisons entre le xénon et le carbone, l’azote, le chlore, l’or ou le mercure, tandis que d’autres, observés dans des conditions extrêmes (matrices
cryogéniques ou jets gazeux supersoniques) présentent des liaisons entre le xénon et l’hydrogène, le bore, le béryllium, le soufre, l’iode, le brome, le titane, le cuivre et l’argent. »
Autres composés :
Si la chimie des gaz nobles est essentiellement celle du xénon, il existe néanmoins des composés chimiques avec d’autres gaz nobles que le xénon.
On connaît ainsi le trioxyde de radon RnO3 ainsi que le difluorure de radon RnF2.
Le krypton forme du difluorure de krypton KrF2, lequel donne les cations KrF+ et Kr2F3+.
Les gaz nobles plus légers forment également des exciplexes, c’est-à-dire des molécules qui ne sont stables qu’à l’état excité, notamment utilisés pour faire des lasers (laser à excimère).
On connaît également de nombreux ions moléculaires de gaz nobles, même des moins réactifs d’entre eux, comme le néon, qui donne les ions HNe+, HeNe+, Ne2+ et NeAr+.
Applications
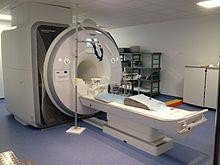
L’hélium liquide est utilisé pour refroidir les électroaimants supraconducteurs dans les équipements d‘imagerie par résonance magnétique.
Les gaz nobles présentent une température de fusion et une température d’ébullition particulièrement basses, d’où leur utilisation comme réfrigérants cryogéniques.
En particulier, l‘hélium liquide, qui bout à −268,95 °C à pression atmosphérique, est utilisé avec les électroaimants supraconducteurs comme ceux utilisés en imagerie par résonance magnétique (IRM) et en résonance magnétique nucléaire (RMN).
Le néon liquide est également utilisé en cryogénie, malgré le fait qu’il n’atteint pas les températures aussi froides que l’hélium liquide, car il présente une capacité réfrigérante quarante fois supérieure à celle de l’hélium liquide, et plus du triple de celle de l‘hydrogène liquide.

Stockage de gaz respiratoires pour plongée profonde à saturation
L’hélium est utilisé comme constituant des gaz respiratoires à la place de l’azote en raison de sa faible solubilité dans les fluides physiologiques, notamment dans les lipides.
Les gaz sont absorbés par le sang et les tissus biologiques sous pression, par exemple en plongée sous-marine, provoquant un effet anesthésiant appelé narcose à l’azote. En raison de sa solubilité réduite, l’hélium est peu absorbé dans les membranes cellulaires, de sorte que l’utilisation de l’hélium à la place de l’azote dans le héliox ou le trimix réduit l’effet narcotique du gaz respiratoire au cours de la plongée.
Cette faible solubilité présente également l’avantage de limiter les risques d‘accident de décompression, car les tissus comportent moins de gaz dissous susceptible de former des bulles lorsque la pression diminue lors de la remontée.
L‘argon, quant à lui, est considéré comme le meilleur candidat pour remplir les combinaisons de plongée.

Exemple de ballon à hélium.
L’hélium est utilisé, pour des raisons de sécurité, à la place de l‘hydrogène dans les dirigeables et les ballons, malgré une perte de portance de 8,6 %.
Les gaz nobles sont également utilisés dans de nombreuses applications requérant une atmosphère chimiquement inerte. L’argon est utilisé pour la synthèse de composés sensibles à l’azote atmosphérique.
L’argon solide permet d’étudier les molécules très instables en les immobilisant dans une matrice solide à très basse température qui empêche les contacts et les réactions de décomposition.
L’hélium peut être utilisé en chromatographie en phase gazeuse (CPG), pour remplir les thermomètres à gaz, et dans les appareils de mesure de la radioactivité, comme les compteurs Geiger et les chambres à bulles. L’hélium et l’argon sont couramment utilisés pour isoler les métaux de l’atmosphère lors de la découpe ou du soudage à l‘arc électrique, ainsi que pour
divers autres procédés métallurgiques et pour la production de silicium par l’industrie des semiconducteurs.

Les gaz nobles sont couramment utilisés pour l’éclairage en raison de leur inertie chimique.
L‘argon mélangé à l‘azote est utilisé pour remplir les ampoules des lampes à incandescence5, ce qui prévient l’oxydation de filament en tungstène tout en limitant la redéposition du tungstène sublimé sur les parois de l’ampoule.
Le krypton est utilisé pour les ampoules à hautes performance avec une température de couleur plus élevée et un meilleur rendement énergétique car il réduit le taux d’évaporation du filament par rapport aux ampoules à argon ; en particulier, les lampes à halogènes utilisent un mélange de krypton avec de petites quantités de composés d’iode et de brome.
Les gaz nobles luisent avec des couleurs particulières lorsqu’ils sont utilisés dans les lampes à décharge, comme les « tubes au néon ».
Malgré leur appellation commune, ces lampes contiennent généralement d’autres gaz que du néon comme substance phosphorescente, ce qui ajoute de nombreuses teintes à la couleur rouge orangé du néon.
Le xénon est couramment utilisé dans les lampes au xénon (en)en raison de leur spectre quasiment continu qui ressemble à la lumière du jour, avec des applications comme projecteurs de cinéma et phares automobiles.
Les gaz nobles sont utilisés pour réaliser des lasers à excimères, dont le principe repose sur l’excitation électronique de molécules pour former des excimères.
Il peut s’agir de dimères tels que Ar2, Kr2 ou Xe2, ou plus souvent d‘espèces halogénées telles que ArF, KrF, XeF ou XeCl.
Ces lasers produisent une lumière ultraviolette dont la faible longueur d’onde (193 nm pour ArF et 248 nm pour KrF) permet de réaliser des images à haute résolution.
Les lasers à excimères ont de nombreuses applications industrielles, médicales et scientifiques.
On les utilise en microlithographie et en microfabrication, technologies essentielles à la réalisation des circuits intégrés, ainsi que pour la chirurgie au laser, comme l‘angioplastie et la chirurgie oculaire.
Certains gaz nobles ont des applications directes en médecine.
L’hélium est parfois utilisé pour faciliter la respiration des personnes asthmatiques5, et le xénon est utilisé en anesthésie à la fois en raison de sa solubilité élevée dans les lipides, qui le rend plus efficace que le protoxyde d’azote N2O, et parce qu’il s’élimine facilement de l’organisme, ce qui permet une récupération plus rapide .
Le xénon est également utilisé en imagerie médicale des poumons par IRM hyperpolarisée.
Le radon, qui n’est disponible qu’en petites quantités, est utilisé en radiothérapie.

