LES ELEMENTS DU GROUPE 17 – LES HALOGENES
Objectifs du cours : à la fin du cours, l’étudiant devrait être en mesure de :
Apprécier l’homogénéité de l’évolution des propriétés périodiques dans le groupe ;
Relier les propriétés particulières du fluor à son rayon et son électronégativité ;
Connaître les aspects biologiques et pharmaceutiques des halogènes, notamment ceux du fluor et de l’iode.
INTRODUCTION
| Elément | Symbole | Z |
| Fluor | F | 9 |
| Chlore | Cl | 17 |
| Brome | Br | 35 |
| Iode | I | 53 |
| Astate | At | 85 |
| Tenessine | Ts | 117 |
Les halogènes (du grec « halos = sel, mer » et « génos = engendrer »), sont des éléments dont la chimie est homogène et relativement simple.
Ils sont très réactifs et par conséquent, ne se trouvent jamais dans la nature à l’état élémentaire.
ETAT NATUREL :
Le fluor existe sous forme de fluorite (CaF2), cryolithe (Na3AlF6) et fluorapatite (Ca5(PO4)3F).
Le chlore, le brome et l’iode se trouvent en général, sous forme de sels dissouts dans les eaux de mer et les lacs ou de dépôts salins suite à l’évaporation des étendues d’eau.
L’astate est un élément radioactif (210At : t½ = 8.1 h) et on le considère comme l’élément naturel le moins abondant sur terre.
Le Tenessine est un élément, dont la découverte est récente.
Il est obtenu par nucléosynthèse.
PROPRIETES :
PROPRIETES ELECTRONIQUES :
| Conf. électronique | Charge nucléaire effective | Etats d’oxydation | |
| F | [He] 2s22p5 | 5.1 | -1, 0 |
| Cl | [Ne] 3s23p5 | 6.116 | -1, 0, +1, +3, +5, +7 |
| Br | [Ar] 3d104s24p5 | 9.028 | -1, 0, +1, +3, +5, +7 |
| I | [Kr] 4d105s25p5 | 11.612 | -1, 0, +1, +3, +5, +7 |
Configuration électronique : la couche de valence de type : ns2np5.
Ils tendent à compléter leur couche externe :
En formant des liaisons ioniques avec les métaux : anions halogénures (X–).
En formant des liaisons covalentes, avec les non-métaux, ex.
X-X, H-X, C-X, etc.
Charge nucléaire effective : très élevée.
Etats d’oxydation :
Fluor : élément le plus électronégatif du tableau périodique, il adopte toujours un état d’oxydation -1.
Cl, Br et I : ils adoptent généralement l’état d’oxydation -1.
Cependant, des états d’oxydation supérieurs (voir tableau ci-dessus) sont possibles lorsqu’ils se combinent avec des éléments plus électronégatifs (ex.
F ou O).
N.B. d’autres états d’oxydation sont possibles pour Cl, Br et I (voir oxydes)
PROPRIETES PHYSIQUES :
Aspect : les halogènes sont des éléments non-métalliques.



| Élément | Aspect | Caractère métallique |
| F | Gaz jaune pâle | Non-métaux |
| Cl | Gaz jaune-verdâtre | |
| Br | Liquide huileux rouge-brun | |
| I | Solide brillant violet-noir |
Point d’ébullition, point de fusion et rayon :
| Élément | Point d’ébullition (°C) | Point de fusion (°C) | Ra (pm) | Rcov (pm) | Ri (X–) (pm) |
| F | -219 | -188 | 50 | 77 | 133 |
| Cl | -101 | -34 | 100 | 99 | 181 |
| Br | -7 | +60 | 115 | 114 | 196 |
| I | +114 | +185 | 140 | 133 | 220 |
Les halogènes existent sous forme de molécules diatomiques, apolaires et discrètes X2, liées entre elles par la force de dispersion de London.
Cette dernière augmentant avec le nombre d’électrons (Z), les PE° et PF° augmentent dans le groupe et on observe le passage de l’état gazeux (fluor, chlore) à l’état liquide (brome) puis solide (iode).
Force de dispersion de London est une liaison intermoléculaire est une interaction dipôle instantané – dipôle instantané.
Ce type d‘interaction se développe entre deux molécules quelconques (polaires ou apolaires).
L’atome de fluor est très petit.
Ceci se répercute sur certaines de ces propriétés, notamment l’affinité électronique et l’enthalpie de la liaison F – F.
L’enthalpie de liaison (H) est l’’énergie de dissociation d’une liaison.
PROPRIETES CHIMIQUES :
| χ | Aff. électro. (kJ/mol) | Potentiel E (V) | |
| F | 4.0 | – 328 | + 2,87 |
| Cl | 3.2 | – 349 | + 1.36 |
| Br | 3.0 | – 325 | + 1.09 |
| I | 2.7 | – 295 | + 0.54 |
Electronégativité : les électronégativités sont élevées.
Le Fluor est l’élément le plus électronégatif du tableau périodique, tandis que le chlore est troisième après l’oxygène.
Affinité électronique* : les halogènes ont des affinités électroniques très élevées concordant avec les valeurs de leurs électronégativités.
* Affinité électronique : changement d’énergie (kJ/mol) d’un atome « E », en phase gazeuse, lorsqu’un électron est capté par cet atome pour former un anion « E– » : E(g) + e− → E(g) –
L’affinité électronique diminue dans le groupe avec l’augmentation du rayon.
Cependant, chez le petit atome du fluor, la fixation d’un électron sur la couche de valence sera rendue difficile à cause de la répulsion exercée par les 7 électrons de valence confinés dans un petit espace.
| C. Pouvoir oxydant : A l’inverse des métaux alcalins, très réducteurs, les halogènes constituent des entités oxydantes.Le fluor est l’élément le plus oxydant du tableau périodique (E° = +2.87 V), il réagit avec la plupart des éléments, y compris les métaux nobles (Au, Pt, etc.) et quelques gaz nobles (Kr, Xe et Rn). Il attaque également le verre et ne peut être conservé que dans des récipients préalablement passivés par le fluor.Le pouvoir oxydant diminue dans le groupe, ce qui rend possible, les réactions de déplacement ci-contre : | F2 + 2NaCl → 2NaF + Cl2Cl2 + 2NaBr → 2NaCl + Br2 Br2 + 2NaI → NaBr + I2Application : préparation du brome et de l’iode. |
D.
Examen des liaisons :
Corps simples :
| Distance interatomique (pm) | Enthalpie de la liaison (kJ/mol) | |
| F – F | 143 | 155 |
| Cl – Cl | 199 | 240 |
| Br – Br | 228 | 190 |
| I – I | 266 | 149 |
La réactivité des halogènes est à la fois, une conséquence de leur électronégativité élevée et des
enthalpies des liaisons X – X relativement faibles.
En général, l’enthalpie d’une liaison est inversement proportionnelle à sa longueur.
Toutefois, on note que la liaison F – F (155 kJ/mol) est plus faible que la liaison Cl – Cl (240 kJ/mol) malgré une distance interatomique F – F inférieure à celle de Cl – Cl.
En effet, les atomes de fluor présentent une densité électronique (Nombre d’électrons/Rayon) telle, qu’ils se repoussent mutuellement, fragilisant ainsi la liaison.
Corps composés : Les liaisons covalentes formées entre un halogène et un élément « E » sont généralement très stable.
Pour une liaison de type, E – X, l’enthalpie diminue dans le groupe.
| Elément | Enthalpie E-X (kJ/mol) | ||
| H – X | C – X | Al – X | |
| F | 565 | 485 | 582 |
| Cl | 428 | 327 | 427 |
| Br | 363 | 272 | 360 |
| I | 294 | 239 | 285 |
La stabilité des liaisons de type : « C – X,» rend compte de la possibilité d’introduire des atomes d’halogènes sur des molécules organiques via des réactions d’halogénation (fluoration, chloration, bromation, iodation).
E.
Solubilité et réaction dans l’eau :
| Elément | Solubilité (mol/L) | Réactivité (CNTP) |
| F | – | Réaction violente |
| Cl | 0.091 | Réaction rapide |
| Br | 0.21 | Réaction lente |
| I | 0.0013 | Solubilité négligeable |
Fluor : le fluor ne se dissout pas dans l’eau.
Son pouvoir oxydant est tel, qu’il oxyde l’eau produisant le fluorure d’hydrogène et libération de dioxygène :
2F2(g) + 2H2O(l) → O2(g) + 4HF(aq)
Chlore, brome et iode : ils sont peu solubles dans l’eau.
Dans les CNTP, ils subissent une
dismutation* :
| X2 | + | H2O | ⇋ | HXO | + | HX |
| E.O. 0 | E.O. +1 | E.O. -1 |
| * Dismutation : réaction d’oxydoréd produisant deux dérivés ayant deux étaEx. Lors de la dismutation du Cl2 (E (E.O. +1). L’autre atome de Cl sera rCl2 | uctio ts d.O. 0éduit+ | n dans ’oxydatio) dans l’ en anioH2O | laquelle n diffeau, u n Chlo⇋ | une espèc érents.n atome de rure Cl- (EHClO | e chiCl ser.O. -1)+ | mique sera à la fois oxydée et réduitea oxydé en anion hypochlorite ClO–:HCl |
| E.O. 0 | E.O. +1 | E.O. -1 |
DISMUTATION DU CHLORE DANS UNE SOLUTION ALCALINE : la dismutation du chlore produit deux entités acides (acide hypochloreux et le chlorure d’hydrogène).
En milieu alcalin, ces deux entités acides seront neutralisées par l’anion hydroxyde (OH–) comme suit :
Cl2 + 2H2O ⇋ HClO + H3O+ + Cl– HClO + OH– → ClO– + H2O
H3O+ + OH– → 2H2O
La réaction de dismutation est donc favorisée (passage d’une réaction partielle « ⇋ » à une réaction totale
«→ ») et l’équilibre est déplacé vers la gauche.
Le bilan de la réaction s’écrit comme suit : Cl2 +2OH–→ ClO–+ Cl– +H2O
Application : La dismutation du chlore en présence d’une solution de soude caustique (NaOH) permet la préparation de l’hypochlorite de sodium (voir acide hypochloreux et sels hypochlorites).
SOLUBILITE DE L’IODE DANS UNE SOLUTION D’IODURE : la solubilité de l’iode dans l’eau est négligeable, toutefois en présence de l’anion I– (ex. solution KI), la solubilité augmente avec formation de l’anion triiodure (I –) :
I2 + I– ⇋ I –
3
3
III PRÉPARATION :
D’une façon Générale les halogènes sont dans la nature à l’état d’ion X– , le problème consiste à oxyder l’ion X –
,les halogènes se préparent donc par oxydation qui se fait par voie chimique ou électrochimique.
Outre les oxydants le plus souvent utilisé au laboratoire KMnO4,, K2Cr2O7 …etc les valeurs des potentiels d’oxydo-réduction montrent que :
F2 déplace Cl2,Br2,I2 Cl2 déplace Br2,I2 Br2 déplace I2
FLUOR : Electrolyse de l’hydrogénobifluorure de potassium (KHF2) fondu (250°C) et anhydre :
2KHF2 → F2 (Anode) + H2 (cathode) + 2KF
CHLORE :
Industrielle : Electrolyse du NaCl fondu (Industrie de chloralcali )
Laboratoire : oxydation de l’acide chlorhydrique avec KMnO4 (ou autre oxydant puissant) :
| 2 HCl(aq) → 2H+(aq) + Cl2(g) + 2e- |
| – + – 2+MnO4 (aq) +8H (aq) + 5e → Mn (aq) + 4H2O(l) |
| – + 2+2 MnO4 (aq) + 6 H (aq) + 10 HCl(aq) → 2 Mn (aq) + 5 Cl2(g) + 8 H2O(l) |
BROME : déplacement du brome d’un bromure (ex.
MgBr2) par le Cl2 :
MgBr2 + Cl2 → Br2 + MgCl2
IODE : déplacement de l’iode d’un iodure (ex.
NaI) par le Cl2 :
2NaI + Cl2 → I2 + 2NaCl
IV .
ETUDE DES CORPS COMPOSES :
IV .1.
LES HALOGENURES D’HYDROGENE ( LES HYDRACIDES HALOGENES) (HX) :
Préparation :
Industrielle : combinaison directe entre X2 et H2 : X2 + H2 → 2HX
| Laboratoire : réactions de déplacement par un acide : | HF :HCl : | CaF2 + H2SO4 → 2HF + CaSO4NaCl + H2SO4 → HCl + NaHSO4 |
| HBr :HI : | NaBr + H3PO4 → HBr + NaH2PO4NaI + H3PO4 → HI + NaH2PO4 |
Pour la synthèse de HF et HCl, on utilise H2SO4 dont le potentiel oxydant est insuffisant pour oxyder les anions F– ou Cl– en F2 et Cl2.
Tandis qu’avec HBr et HI, on utilise H3PO4, acide non oxydant, au lieu de H2SO4, car ce dernier oxyderait les anions Br– ou I– en Br2 et I2 selon les réactions :
2NaBr + 2H2SO4 → Br2 + SO2 + Na2SO4 + 2H2O
2NaI + 2H2SO4 → I2 + SO2 + Na2SO4 + 2H2O
Propriétés :
| HX | Enthalpie de la liaison (kJ/mol) | PE° (°C) | pKa |
| HF | 565 | 19.4 | + 3.2 |
| HCl | 428 | – 85 | – 7 |
| HBr | 363 | – 65 | – 9 |
| HI | 294 | – 35 | – 10 |
Propriétés physiques : les HX sont des composés covalents et volatils, sauf HF (liquide dans CNTP).
Propriétés chimiques :
Force de la liaison, dissociation et acidité : l’examen des enthalpies de liaison H-X indique que la stabilité décroît dans le groupe.
En solution aqueuse, cela se répercute sur la force de l’acidité qui augmente dans le groupe :
HF est un acide faible (dissociation partielle) : HF + H2O ⇋ H3O+ + F–
HCl, HBr et HI sont des acides forts (dissociation totale) : HX(aq) + H2O(l) → X– (aq) + H3O+(aq)
N.B. mis en solution, un halogénure d’hydrogène est appelé acide halogénohydrique (acide fluorhydrique, acide chlorhydrique, etc.)
Dans le cas de HF, son point d’ébullition anormalement élevé et sa faible dissociation en solution, sont dus à la liaison hydrogène formée entre les molécules HF.
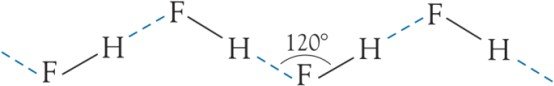
IV.2.
LES COMPOSÉS INTERHALOGÉNÉS :
Les halogènes réagissent entre eux pour former des composés interhalogénés :
Préparation : ils sont préparés par combinaison directe des éléments, ex :
| I2 + Cl2 → 2ICl | Cl2 + 2F2 → 2ClF4 | I2 + 7F2 → 2IF7 |
Formule générale : AXn où : A : halogène le moins électronégatif
X : halogène le plus électronégatif n : 1, 3, 5 ou 7
Il existe donc 4 types : AX, AX3, AX5 et AX7 où l’atome A doit être suffisamment volumineux pour s’entourer de n atomes X.
Les types AX et AX3 sont formés entre deux halogènes dont χX-χA est faible (ex.
ICl, ClF3).
Les types AX5 et AX7 sont formés entre deux halogènes dont χX-χA est grande (ex.
BrF5, IF7).
| Monochlorure d’iode (ICl) | Trifluorure de Chlore(ClF3) | Pentafluorure de brome(BF5) | Heptafluorure d’iode(IF7) |
Propriétés : Les composés interhalogénés sont des composés volatils, polaires (χX-χA) et instables.
Les liaisons A-X étant plus faibles que les liaisons X-X, ils sont plus réactifs que les halogènes moléculaires.
Utilisations : Ils sont utilisés comme oxydants et dans les opérations d’halogénation.
IV.3.
LES OXYDES, OXACIDES ET LEURS SELS :
Les oxydes :
Fluor : Le fluor étant plus électronégatif que l’oxygène, on parle alors de fluorure d’oxygène.
On connait deux fluorures : F2O (E.O. de O : +1) et F2O2 (E.O. de O : +2)
Cl, Br et I : étant moins électronégatifs que O, on considère tous les E.O. allant de +1 à +7.
| Oxydes | E.O. | Cl | Br | I |
| X2O | +1 | | | X |
| XO | +2 | | | |
| X2O3 | +3 | | | X |
| XO2 | +4 | | | X |
| X2O5 | +5 | | X | |
| XO3 | +6 | | | |
| X2O6 | | X | X | |
| X2O7 | +7 | | X | X |
On connait tous les oxydes de chlore, certains oxydes de Br et quelques oxydes de I.
Tous les oxydes sont des composés endothermiques et sont potentiellement explosifs (décomposition violente) excepté le I2O5, solide, stable à température ambiante.
Les oxacides et leurs sels (HXOn/XOn-)
| Oxacide | Oxanion | ||
| HXO | Acide hypohalogéneux | XO– | Anion hypohalogénite |
| HXO2 | Acide halogéneux | –XO2 | Anion halogénite |
| HXO3 | Acide halogénique | –XO3 | Anion halogénate |
| HXO4 | Acide perhalogénique | –XO4 | Anion perhalogénate |
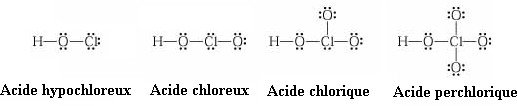
Les oxacides ont des propriétés acides et oxydantes.
Leurs sels sont basiques (bases conjuguées) et oxydants.
Le pouvoir acide augmente avec : Le nombre d’atome d’oxygène : HClO ˂ HClO2 ˂ HClO3 ˂ HClO4
L’électronégativité de l’halogène : HClO ˃ HBrO ˃ HIO
Le pouvoir oxydant diminue avec la stabilité de de la molécule : HClO → HClO2 → HClO3 → HClO4
Pouvoir oxydant diminue
L’ACIDE HYPOCHLOREUX (HClO) ET HYPOCHLORITES (ClO–) :
Préparation :
L’acide hypochloreux (HClO) est préparé par dismutation du chlore dans l’eau :
Cl2(aq) + H2O(l) ⇋ HClO(aq) +H+(aq) + Cl-(aq)
Les hypochlorites sont préparés par dismutation du chlore dans une solution alcaline :
| – Hypochlorite de sodium (NaClO) : | Cl2 + 2NaOH → NaClO + NaCl + H2O |
| – Hypochlorite de calcium (Ca(ClO)2) : | 2Cl2 + 2Ca(OH)2 → Ca(ClO)2 + CaCl2 + 2H2O |
Propriétés :
HClO est un acide faible (pKa = 7.3), les solutions des hypochlorites, sont basiques :
ClO–(aq) + H2O(l) ⇋ HClO(aq) + OH–(aq)
L’acide hypochloreux est un agent oxydant puissant.
Dans les réactions redox, il est réduit en Cl2 :
2HClO(aq) + 2H+(aq) + 2e– → Cl2(g) + 2H2O(l) E° = + 1.64 V
L’anion hypochlorite est un oxydant moins puissant.
Dans une réaction, il est réduit en anion Cl– :
ClO–(aq) + 2H2O(l) + 2e– → Cl–(aq) + 2OH–(aq) E° = + 0.89 V
Application : Le pouvoir oxydant de HClO et des hypochlorites (NaClO, Ca(ClO)2) , est à l’origine de leur effet bactéricide.
Les hypochlorites sont utilisés comme des produits désinfectants (eau de Javel) ou antiseptiques (solution de Dakin).
ASPECTS BIOLOGIQUES ET PHARMACEUTIQUES :
FLUOR : il ne s’agit pas d’un élément essentiel à l’organisme mais sa présence dans l’alimentation, son incorporation dans les eaux de boissons, dans certains médicaments et produits d’hygiène, fait qu’il représenterait en moyenne 0,004 % de la masse corporelle.
Anion fluorure (F-) : l’anion fluorure est introduit dans l’organisme sous forme de fluorure de sodium (NaF) en raison de sa grande solubilité.
Une fois dissout, l’anion fluorure est absorbé par le tube digestif.
| Composé | Solubilité g/100 ml d’eau |
| LiF | 0,27 |
| NaF | 4,20 |
| MgF2 | 0,007 |
| CaF2 | 0,001 |
N.B. l’interaction de l’anion fluorure avec un cation petit et chargé forme un composé insoluble (ex.
CaF2)
Effets de l’anion fluorure dans l’organisme :
Les dents : L’anion fluorure présente un effet cariostatique en s’incorporant dans les couches superficielles de l’émail.
Il se substitue à l’anion hydroxyle (OH–) de l’hydroxyapatite et forme la fluoroapatite (Ca5(PO4)3F).
Cette dernière résiste à l’attaque acide des bactéries cariogènes.
Application : NaF est utilisé (dentifrice, comprimés, solution buvable) dans la prévention des caries dentaires .
Les os : il entre avec le calcium et le phosphore dans la structure
osseuse.
Interaction avec le calcium : la présence de l’anion fluorure dans le plasma sanguin provoque une diminution du taux de Ca2+ par formation de sel CaF2 insoluble.
Cette propriété :
Peut perturber l’activité physiologique des processus incluant le calcium ;
Permet son utilisation comme anticoagulant (voir rôle biologique du calcium).
Médicaments fluorés :
| Actuellement, le cinquième (1/5) des médicaments commercialisés contiennent un ou plusieurs atomes de fluor, principalement sous forme de liaison « C – F » au lieu d’une liaison « C – H » (ex. quelques molécules ci-contre)La fluoration d’une molécule médicamenteuse permet de modifier grandement ses propriétés physicochimiques (pKa, solubilité, stabilité, interactions, etc.) ce qui se répercute sur ses propriétés pharmacologiques (biodisponibilité, métabolisme, fixation, élimination, etc.).L’intérêt de la fluoration peut être résumé comme suit :Le fluor possède un rayon de Van Der Waals (Rvdw = 135 pm) équivalent à celui de l’hydrogène (Rvdw = 110 pm) et par conséquent la substitution de ce dernier par le fluor n’aura pas une modification de l’effet stérique de la molécule.Augmentation de la biodisponibilité du médicament (durée de l’effet) :Enthalpie de liaison (kJ/mol)C – F : 485 C – H : 412La liaison « C – F » étant plus forte qu’une liaison « C –H » confère à la molécule une plus grande stabilité chimique ce qui la rend plus résistante aux mécanismes de dégradation puis d’élimination.Fixation sur les biorécepteurs : la liaison C – F étant très polaire, offre à la molécule médicamenteuse une plus grande interaction (polaire, liaison hydrogène, etc.) avec les biorécepteurs. | |
CHLORE : le chlore est un élément essentiel majeur qui représente 0.12 % de la masse corporel.
L’anion chlorure (Cl–) accompagne généralement le cation Na+ dans son métabolisme.
Il s’agit du principal anion équilibrant la charge électrique des milieux biologiques
| V3. IODE : l’iode est un élément essentiel trace dans l’organisme qui représente 2 x 10-5% de la masse corporel. Il est principalement présent dans les hormones thyroïdiennes.Rôle biologique :L’iode est essentiel au fonctionnement de la glande thyroïde (hormones thyroïdiennes). Sa carence conduit, entre autres, à l’hypertrophie de la thyroïde (goitre).Dans ces hormones, la liaison C-I est apolaire (χI – χC ≈ 0.2) et est comparable à la liaison C-H (χC – χH ≈ 0.3) en terme de stabilité. Cependant, la taille de I (133 pm) permet à la molécule de se fixer dans les cavités des sites actifs enzymatiques.Aspects pharmaceutiques :Agent de contraste : avec sa masse atomique élevée (Z = 53) l’iode est opaque aux rayons X. Il est utilisé comme produit de contraste, notamment dans l’exploration de l’appareil urinaire et de la thyroïde.Biocide et désinfectant (PVP/I2 : Bétadine®) : L’iode est doté d’un pouvoir biocide, il est utilisé en solution comme antiseptique (désinfection des blessures, de la peau avant une intervention chirurgicale). | |
c.
Lévothyroxine (LEVOTHYROX ®) : il s’agit d’une hormone de synthèse prescrite en cas d’hypothyroïdie.
Elle permet de corriger une carence en hormones thyroïdiennes.
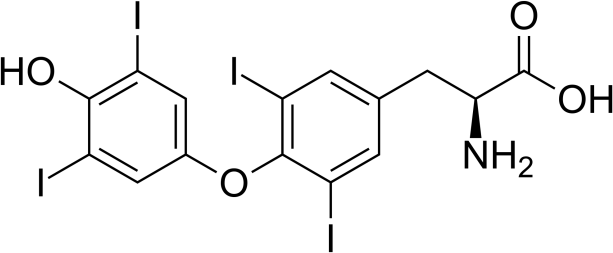
Structure de la lévothyroxine
