LES ELEMENTS DU GROUPE 13
ASPECTS BIOLOGIQUES ET PHARMACEUTIQUES
Introduction:
Le groupe 13 est le premier groupe du bloc p.
Ce groupe n’as pas de nom particulier.Il est constitué des éléments : Bore, Aluminium, Gallium, Indium et Thallium .
Le comportement global des éléments amène au « découpage » grossier : B (non- métal), (Al,Ga ,In,Tl) (métaux).
La ligne diagonale séparant les métaux des non-métaux traverse le bloc p dont les éléments du groupe 13 en constituent le premier groupe.
Ainsi, les différences entre les propriétés des éléments d’un même groupe (métaux et non-métaux) sont évidentes si on leur oppose les éléments du bloc s qui forment un ensemble relativement homogène.
Etat naturel :
Abondance (% massique ) dans l’enveloppe terrestre :
| B | Al | Ga | In | Tl |
| 10-6 | 7.57 | 10-3 | 10-5 | 3.10-5 |
Aucun des éléments du groupe 13 ne se trouve dans la nature à l’état de corps simple.
Pour Al el les éléments plus lourds, ce fait est lié au caractère très réducteur des métaux (Al : E°=-1.66V) ce qui leur confère une réactivité élevée vis-à-vis du dioxygène).
L’Aluminium occupe le troisième rang par ordre d’abondance dans la croute terrestre derrière l’oxygène et le silicium.
Le bore:
À l’état borique H3BO3 (dans les régions volcaniques)
Sous forme de borates:
Borax Na2B4O7 10H2O
Borocalcite CaB4O7 4H2O
L’Aluminium on le retrouve sous forme de :
Silicates et silico-aluminates exemple : Feldspath de sodium Na[AlSi3O8], de potassium K[AlSi3O8] et de calcium Ca [Al2Si3O8] , kaolin, argile et micas
Cryolithe Na3AlF6
Bauxite AlO2H et Al(OH)3
Le spinelle MgAl2O4
Le gallium, l’indium et le thallium n’ont pas de minerai propre
Le gallium: Très dispersé, on le trouve dans la blende associé au Zinc
L’indium : se trouve en très petite quantité :
– dans les blendes sous forme de sulfure,
–et dans les minerais d’étain
Le thallium : dans les blendes et les pyrites de Fer et de Cuivre
PREPARATIONS:
le Bore :
On l’obtient en réduisant : Soit l’oxyde B2O3 par le magnésium Mg ou le sodium Na B2O3 + 3Mg → 2B + 3MgO
Ou en réduisant le chlorure BCl3 par l’hydrogène sur un filament de tungstène : BCl3 +3H2 → 2B +6HCl
La pyrolyse de BI3 donne du Bore très pur
L’Aluminium :
L’aluminium est préparé presque uniquement par électrolyse de l’alumine fondue Al2O3 , selon un procédé appelé « procédé Hall-Héroult »qui comporte 2 étapes :
Décomposition de la bauxite, matière brute selon le procédé de Bayer pour en extraire l’alumine
Electrolyse de l’alumine fondue
Etape 1:
La transformation des bauxites rouges en alumine par le procédé de Bayer.
Ce procédé repose sur l’attaque du minerai broyé par une solution concentrée de soude (NaOH) et à chaud dans des autoclaves en acier
L’alumine Al2O3 passe en solution à l’état d’aluminate c’est-à-dire sous forme d’anions [Al(OH)4]–
Les impuretés (oxydes de fer et de titane) précipitent, ces impuretés restent sur le filtre après filtration
La silice, présente dans le minerai, donne des silico-aluminates de sodium insolubles.
Ce qui entraine une surconsommation de soude et d’alumine.
La perte d’alumine, en particulier, explique la nécessité d’avoir au départ des minerais pauvres en silice
La solution d’aluminate de sodium est diluée à froid avec amorçage, l’hydroxyde d’aluminium cristallin Al(OH)3 précipite alors en deux jours environ:
[Al(OH)4]– → Al(OH)3 + OH–
Après filtration, la calcination vers 1200°C donne Al2O3 alpha ,
La solution diluée de soude ainsi obtenue est concentrée et retourne à l’attaque du minerai
Etape 2 : électrolyse de l’alumine fondue :
Le four d’électrolyse se compose d’une cuve dont le fond recouvert de carbone joue le rôle de cathode
Les anodes : série de blocs plongeant dans l’électrolyte, sont en carbone élaboré à partir de coke de pétrole
L’électrolyse nécessite d’avoir à sa disposition de l’énergie électrique à bon compte
-Le bain d’électrolyse est formé de : 5% Al2O3, 5% CaF2, 7% AlF3 et 83% de cryolithe Na3AlF6
-La température du bain se trouve alors ramenée à 960°C, alors que le point de fusion de Al2O3 est de 2045°C
-La composition du bain et la température sont ajustées de telle sorte que l’aluminium libéré ne vienne pas en surface où il brulerait au contact de l’air, mais tombe au fond de la cuve où il se rassemble et d’où on le fait couler périodiquement
-La tension est réglée de manière que seule l’alumine et non la cryolithe se trouve électrolysée
-On opère sous une tension de 4.2V et une intensité de 280 000A
-Le chauffage est produit par le passage du courant d’électrolyse La réaction s’écrit souvent de façon simplifiée :
Al2O3 (Dissous) → 2Al3+ + 3O2-
Elle est suivie de l’oxydo-réduction électrolytique suivante :
Cathode pôle (-): 2Al3+ +6e– → 2Al (l)
Anode pôle (+): 3O2- → 3/2 O2 + 6e–
-À l’anode l’oxygène qui se dégage brûle peu à peu le coke avec formation de dioxyde de carbone.
-Il se dégage un peu de fluorure de carbone CF4 provenant d’une très faible électrolyse de la cryolithe
-On obtient industriellement de l’aluminium à 99.8% de pureté
-L’affinage électrolytique donne un aluminium à 99.99%.
Gallium, indium et thallium : Ils sont obtenus par Electrolyse de leurs sels en solution aqueuse.
PROPRIETES
PROPRIETES ELECTRONIQUES
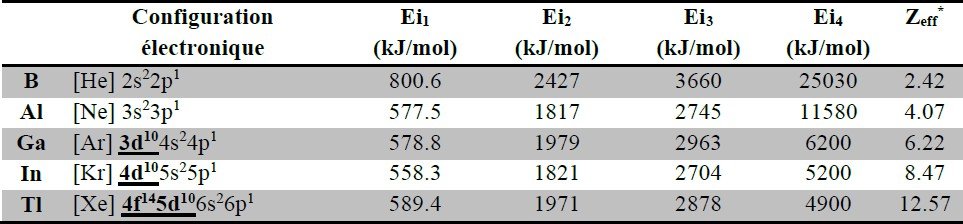
*Charge nucléaire effective selon la table de Clementi et Coll.
Configuration électronique : les éléments du groupe 13 ont une couche de valence de type ns2np1.
Charge nucléaire effective et effet du doublet inerte : les orbitales atomiques n’ont pas la même capacité d’écrantage de la charge du noyau.
Leur efficacité décroit comme suit : s > p > d > f.
Il en résulte une augmentation progressive de la charge nucléaire effective dans le groupe (l’augmentation de Z n’est pas parfaitement compensée par l’augmentation de δ).
Effet du doublet inerte : les électrons de valence des éléments dotés d’orbitales d ou f (dont la capacité d’écrantage est relativement faible) subiront une charge nucléaire effective de plus en plus importante à mesure que nous descendons dans le groupe.
Les éléments du bloc p dont la configuration électronique est de type « ns2npx » verront leurs électrons ns2 de plus en plus retenus à mesure que nous descendons dans chaque groupe.
L’effet du doublet inerte décrit la faible tendance des éléments lourds du bloc p à impliquer leurs électrons ns2 dans des liaisons chimiques.
Cet effet explique par ailleurs, certaines anomalies dans l’évolution des propriétés comme l’énergie d’ionisation ou le rayon.
Energie d’ionisation : là où l’énergie d’ionisation est censée diminuer dans le groupe, on remarque une évolution anormale (voir tableau ci-dessus).
Cette évolution s’explique par l’ajout progressif d’orbitales à faible capacité d’écrantage :


Etats d’oxydation : les éléments du groupe 13 présentent deux états d’oxydation :
Etat d’oxydation +3 : il correspond à la cession des deux électrons ns2 et de l’électron np1.
Cet état caractérise les composés de B et Al.
Il est également présent dans certains composés de Ga.
Les électrons ns2 sont peu retenus par le noyau en raison de la grande capacité d’écrantage des orbitales s et p (B et Al).
Etat d’oxydation +1 : il correspond à la cession de l’électron np1 uniquement.
Cet état se trouve dans certains composés du Ga et In et est caractéristique des composés du Tl.
Les électrons ns2 ne participent pas aux liaisons chimiques en raison de l’effet du doublet inerte (augmentation de la charge nucléaire effective).
Ainsi la stabilité des composés dont E.O. « +3 » diminue dans le groupe, tandis que celle des composés dont E.O. « +1 » augmente dans le groupe.
Ex.
Réaction des éléments du groupe 13 avec H2O : A température ambiante, ces éléments ne réagissent pas avec l’eau.
Ils réagissent avec la vapeur d’eau :
Le bore donne l’acide orthoborique
B + 6H2O → 2H3BO3 + 3H2 E.O +3
Les autres éléments donnent des oxydes :
Al + 3H2O → Al2O3 + H2 E.O +3
Tl + H2O →Tl2O + H2 E.O +1
PROPRIETES PHYSIQUES
A.
Aspect : dans les CNTP, le bore impur (amorphe) se présente sous forme d’une poudre brune, tandis que l’élément pur forme des cristaux brillants gris-argenté.
C’est un non-métal très dur et réfractaire (résiste à la chaleur).
Al, Ga, In et Tl sont des métaux à l’éclat argenté, relativement mous.

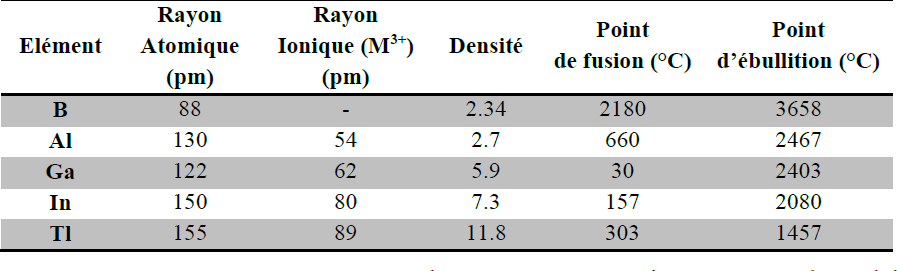
Rayon atomique et rayon ionique :
les rayons augmentent à mesure qu’on descend dans le groupe.
Les rayons de Al, Ga, In et Tl sont toutefois relativement proches.
L’augmentation de Zeff dans le groupe diminue l’effet de l’augmentation de la taille par ajout progressif de couches électroniques ce qui explique la diminution du rayon entre Al et Ga et les tailles quasi identiques de In et Tl.
Densité, point de fusion et point d’ébullition :
B et Al sont particulièrement légers.
Le bore a des points de fusion et d’ébullition très élevé.
Al, Ga, In et Tl ont des domaines liquides très étendus (PF° faible, PE° élevé), en particulier Ga (30 – 2400°C).
Ce dernier possède la propriété de diffuser dans un bon nombre de métaux fragilisant leurs structures cristallines.
PROPRIETES CHIMIQUES
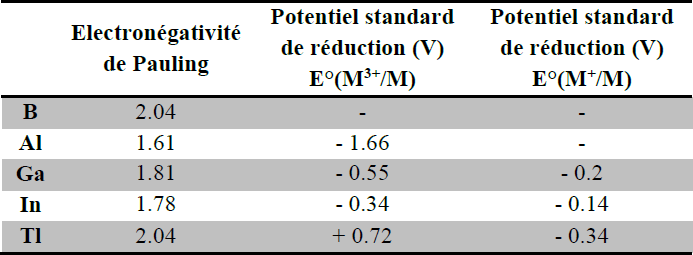
Electronégativité :
L’évolution de l’électronégativité dans le groupe est également sous l’influence du faible écrantage des orbitales d et f.
Pouvoir réducteur : les éléments métalliques du groupe sont des réducteurs, en particulier l’aluminium dont la réaction avec Fe2O3 est très exothermique (2200°C). Al + Fe2O3 → Al2O3 + 2Fe
Nature des liaisons :
B : Le cation B3+ n’a pas été isolé chimiquement.
Tous les composés du bore sont covalents en raison notamment de son électronégativité et son énergie d’ionisation relativement élevées
Al : forme des liaisons ioniques avec les éléments (F, O) ou les groupes d’atomes très électronégatifs (ex.
AlF3).
Avec les éléments moins électronégatifs et les anions polarisables, il forme des liaisons covalentes en raison de son potentiel ionique élevé (ex.
AlCl3, AlBr3).
liaisons ioniques.
Réactivité :
Les éléments du groupe 13 sont moins réactifs que les métaux du bloc s.
Le bore est chimiquement non-réactif sauf à très haute température.
Les autres métaux réagissent avec les éléments oxydants à des températures ambiantes.
Avec l’oxygène et les halogènes, ils forment des oxydes et des halogénures (voir tableau ci-dessous).
La réaction avec l’azote à haute température donne des nitrures.
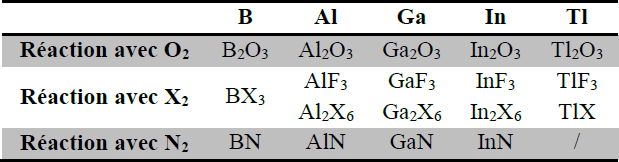
N.B. le bore ne forme pas d’halogénures de formule B2X6, en raison de sa petite taille et de l’encombrement stérique que telles composés impliquent.
ETUDE DES CORPS COMPOSES :
LES HYDRURES
Bien qu’aucun élément du groupe 13 ne réagisse directement avec l’hydrogène on connait de nombreux hydrures intéressants.
-Ceux du bore sont appelés boranes, ils correspondent à deux séries de formule générale :
BnHn+4 et BnHn+6
Ils sont peu stables et présentent un caractère réducteur très marqué, exemple :
BnHn+4 BnHn+6
n=2 B2H6 diborane n=4 B4H10 tétraborane
n=5 B5H9 pentaborane n= 10 B10H16 décaborane
C’est le diborane qui est le plus étudié.
On peut le préparer par plusieurs méthodes :
Mg3B2 + H3PO4 mélange boranes B2H6 2BCl3 + 6H2 B2H6 + 6HCl
4BCl3 + 3LiAlH4 2B2H6 + 3AlCl3 + 3LiCl
Les Boranes sont volatils ; par chauffage, ils se décomposent en bore et hydrogène.
Ils sont décomposés par l’eau et les solutions alcalines
B2H6 + 6H2O 2H3BO3 + 6H2
Tous réagissent avec l’ammoniac NH3 mais les produits sont différents selon les conditions opératoires
En plus des boranes, on connait des borohydrures : complexes plus stables contenant le groupe [BH4]– ; ce sont des réducteurs intéressants en chimie organique.
-L’aluminium donne un hydrure de type (AlH3)n ; on peut l’obtenir par action de LiH sur AlCl3.
Dans l’éther anhydre la réaction donne le tétrahydroaluminate de lithium Li[AlH4] qui est un puissant réducteur en chimie organique.
3LiH + AlCl3 (AlH3)n + 3LiCl
Li[AlH4] + 3LiCl
-Le gallium forme des composés analogues comme Li[GaH4]
-L’indium forme un hydrure polymère In(H 3)n
IV.2LES OXYDES ET HYDROXYDES
Des oxydes de type M2O3 peuvent être formés par tous les éléments du groupe par chauffage dans l’oxygène
Le caractère basique des oxydes augmente en descendant dans le groupe :
L’oxyde du bore B2O3 est un anhydride acide.
En s’hydratant avec une ou plusieurs molécules d’eau, il peut former une série d’acides :
B2O3, H2O ou 2HBO2 – acide métaborique
B2O3, 2H2O ou H4B2O5 –acide pyroborique
B2O3, 3H2O ou 2H3BO3 – acide orthoborique
Ce sont des acides faibles.
Les oxydes de l’aluminium et du gallium (Al2O3 et Ga2O3) et les hydroxydes correspondants sont amphotères.
Les oxydes In2O3 et Tl (Tl2O3 et Tl2O) sont exclusivement basiques ;ils ne donnent ni hydrate ni hydroxyde
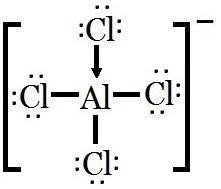
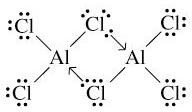
IV.3 LES HALOGENURES (AX3 ou A2X6) :
Deux formules : AX3 (monomère) et A2X6 (dimère).
Les halogénures AX3 des éléments du groupe 13 sont des composés déficitaires en électrons (l’atome central est entouré de 6e-) : ce sont des acides de Lewis.
Ils forment des complexes avec un donneur de doublet électronique (base de Lewis, ex : F, Cl, O, N, etc.) pour atteindre l’octet (8 électrons).
Ceci explique la tendance à la dimérisation (formation de dimères A2X6).
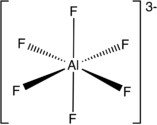
L’orbitale « d » vacante (Al, Ga, In et Tl) permet d’accepter plusieurs doublets.
Ex.
AlF3 peut accepter jusqu’à 3 atomes de fluor supplémentaire pour former l’anion hexafluorure d’aluminium (AlF6)3-.
Ceux du bore BX3 sont covalents, gazeux et subissent l’hydrolyse aqueuse Le fluorure donne le fluoborate : BF3 + H2O H[BF3OH]
Les autres halogénures donnent l’acide borique : BCl3 + 3H2O H3BO3 + 3HCl
-Les fluorures d’aluminium, de gallium, d’indium et de thallium sont ioniques
-Les autres halogénures sont nettement covalents à l’état anhydre
Application : BF3 et AlCl3 sont utilisés en synthèse organique (Réaction de Friedel- Crafts) comme catalyseurs.
Ex. R – Cl + AlCl3 → R+ + [AlCl4]- Ar – H + R+ → Ar – R + H+ H+ + [AlCl4]- → HCl + AlCl3
ETUDE DE L’ALUMINIUM
V.1-Propriétés physiques de l’aluminium
Al est un métal blanc argent un peu bleuté
Avec le temps le brillant de sa surface est voilé par une fine pellicule d’oxyde qui le protège
C’est un métal peu dur (relativement mou)
Il est très malléable
Par laminage on peut obtenir des feuilles de 1/1200 de mm d’épaisseur
Il est ductile et peut être étiré en fils fins
Ses propriétés mécaniques dépendent beaucoup des impuretés qu’il contient
C’est un métal léger d ≈2.7
Relativement fusible Tf = 660°C
C’est un bon conducteur de la chaleur et de l’électricité
Il cristallise dans le système cubique à face centrée
Il possède un seul isotope stable Al 27
V.2-Propriétés chimiques de l’aluminium a/ Oxydabilité:
-L’oxydation de l’aluminium présente un caractère paradoxal :
– Réducteur puissant, l’aluminium en poudre explose par exemple dans l’oxygène liquide.
2Al + 3/2 O2 → Al2O3
-Ce pouvoir réducteur s’illustre notamment par l’utilisation de l’aluminium en métallurgie préparative (aluminothermie) par exemple :
Cr2O3+ Al → Cr + Al2O3
-Le mélange d’aluminium et d’oxyde de fer Fe3O4 enflammé brûle vivement, la température dépasse 2000°C et entraine la fusion du fer produit ( soudure de rails – poutres)
-Avec les sels oxydants, comme les chlorates, la réduction est explosive
-Toutefois l’aluminium en masse est relativement inerte vis-à-vis des agents oxydants.
Il y a en fait, à l’air humide, formation rapide à la surface du métal d’une couche d’alumine extrêmement mince, protectrice, très dure et transparente
-Cette couche d’alumine empêche, sauf destruction mécanique ou attaque chimique locale, une corrosion en profondeur
-De même l’acide nitrique concentré n’attaque pas l’aluminium par formation également d’une couche protectrice d’alumine (passivation)
b/ Action de l’eau :
-L’eau ordinaire n’attaque pas sensiblement l’aluminium à froid en raison d’un phénomène de passivation (Al se recouvre instantanément d’une très fine pellicule d’oxyde hydraté Al2O3XH2O très peu soluble qui entraine l’arrêt de l’attaque)
-Mais la présence de sel favorise la corrosion.
-Par contre le métal décapé est attaqué par l’eau en présence d’ions (Hg2)2+ ou Hg2+
c/ Action des acides et des bases :
-L’aluminium est attaqué par les acides dilués avec dégagement de dihydrogène : 2Al + 6HCl → 2AlCl3 + 3H2
-La réaction avec l’acide chlorhydrique concentré est violente (rôle complexant des ions Cl– )
-Les acides oxydants concentrés n’attaquent pas le métal à froid par formation de la couche passivante d’alumine
-Les acides organiques dilués n’ont pas d’action à froid mais réagissent à l’ébullition
Al est attaqué à froid par les solutions aqueuses de base telles que NaOH et KOH avec dégagement de dihydrogène et formation d’aluminate :
Al (s) + OH– + 3H2O → [Al(OH) ]– 3/2 H2
4 (aq) (g)
-La réaction, lente au début, s’emballe à mesure que la solution s’échauffe: elle peut devenir violente
-Les carbonates alcalins l’attaquent également mais plus doucement
d/-autres réactions :
L’aluminium réagit avec les halogènes avec un grand dégagement de chaleur
La réaction avec le brome liquide est particulièrement vive
Il s’unit à chaud souvent violemment avec le soufre, le sélénium, le tellure en donnant le sulfure , le séléniure et le tellurure
L’azote se combine à haute température avec formation de nitrure d’aluminium AlN
V.3 Composés de l’aluminium :
Les composés courants d’aluminium correspondent à l’état d’oxydation +3.
Ils sont incolores.
Les principaux composés sont l’oxyde et l’hydroxyde, le chlorure et les aluns : a/ Oxyde anhydre:
Al2O3 existe sous plusieurs formes dont les principales sont :
γAl2O3 substance blanche hygroscopique soluble dans les acides et les bases ; c’est un bon absorbant, un catalyseur efficace ; on l’obtient en portant à 300°C des hydroxydes d’aluminium
αAl2O3 substance très dure, insoluble dans les acides et les bases ; on le trouve dans la nature (corindon ou émeri) on l’obtient également en portant le γAl2O3 à plus de 1000°C
Al(OH)3 → γAl2O3 → αAl2O3 Propriétés chimiques de Al2O3:
Sa grande chaleur de formation rend l’alumine difficile à réduire.
H et CO sont sans action
Le carbone n’agit qu’au four électrique qu’à 1800°C; on obtient le carbure d’aluminium :
2Al2O3 +9C → 6CO +Al4C3
Quelques pierres précieuses sont de l’alumine colorée par les oxydes métalliques qu’elle contient (moins de 5%).
Exemple :
Nom oxyde colorant couleur
Rubis chrome(III) rouge
Saphir titane, fer bleu ( blanc) Améthyste vanadium violet Orientale
Topaze orientale manganèse jaune or Emeraude orientale Co, Zn, V, Mg vert
b/ les spinelles:
Oxyde anhydre double de formule MI
O, Al O
et MIIO, Al O , ou MI et MII
2 2 3 2 3
désignent des cations métalliques monovalents et divalents Exemples : spinelle ordinaire = MgO, Al2O3
Spinelle de zinc = ZnO,Al2O3
C/ l’hydroxyde d’aluminium Al(OH)3
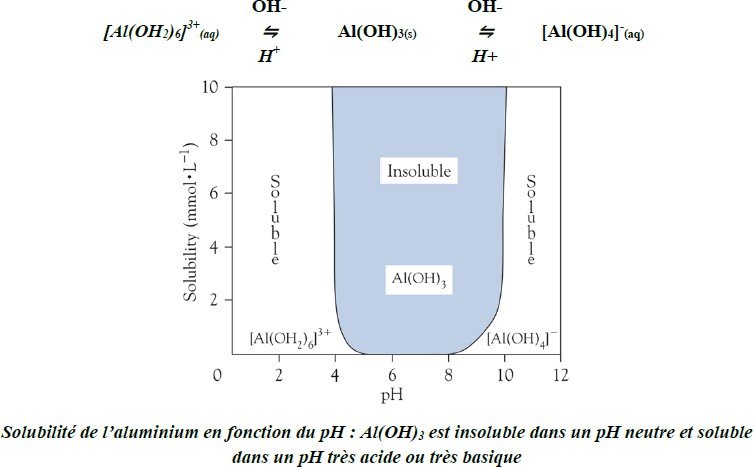
L’hydroxyde d’aluminium [Al(OH)3] en solution :
L’aluminium est amphotère:
En milieu acide : 2Al(s) + 6H+(aq) → Al3+(aq) + 3H2(g)
En milieu basique : 2A(s) + 2OH-(aq) + 6H2O(l) → 3[Al(OH)4]-(aq) + 3H2(g)
En solution aqueuse, le cation Al3+, grâce à un potentiel ionique très élevé, s’entoure de six molécules H2O (sous forme d’ion hexaaquaaluminum [Al(OH2)6]3+).
L’addition de l’anion OH- à une solution d’aluminium (Al3+ hydraté) produit un précipité gélatineux qui correspond à l’hydroxyde d’aluminium [Al(OH)3].
Ce dernier se redissout dans un excès de OH- sous forme d’anion tetrahydroxyaluminate [Al(OH)4]-.
d/ Chlorure d’aluminium :
AlCl3: Cristallisé, incolore, hygroscopique.
Il fume à l’air humide, car il réagit avec l’eau en produisant HCl : AlCl3 + 3H2O → Al(OH)3+ 3HCl
Le chlorure anhydre est soluble dans un grand nombre de solvants organiques
On l’obtient en chauffant des copeaux d’Al dans HCl (gaz)
À l’air humide, à l’état de vapeur et à basse température il est sous forme dimèrisée Al2Cl6.
Au dessus de 800°C la vapeur est monomère AlCl3
AlCl3 forme des composés d’addition avec des éléments organiques ou inorganiques ; c’est ce qui explique peut être son rôle de catalyseur pour le craquage des pétroles par exemple.
e/ les aluns :
Ce sont des sels doubles d’aluminium et d’un métal alcalin.
Ils cristallisent avec 24 H2O
Exemple : K2SO4 Al2(SO4)3 4H2O
Cette classe de composés a été étendue à d’autres métaux trivalents: Fe3+, Cr3+
L’alun ordinaire est l’alun de Potassium ; on l’obtient par action de l’acide sulfurique sur la bauxite ou par calcination de l’alunite
ASPECTS BIOLOGIQUES ET PHARMACEUTIQUES :
BORE :
Le Bore est un élément trace essentiel pour les végétaux.
Pour l’homme, de plus en plus d’études suggèrent son importance pour la prévention de certaines pathologies (arthrose, ostéoporose, etc.) en raison du rôle qu’il jouerait dans la formation des os.
Propriétés chimiques du bore et activité biologique :
Le bore forme 3 liaisons covalentes.
Son orbitale p vacante peut accepter un doublet électronique libre.
Le bore trivalent est un acide de Lewis : lorsqu’un atome de bore trigonal (sp2) accepte une paire d’électrons d’un composé nucléophile, il adopte une configuration tétraédrique (sp3).
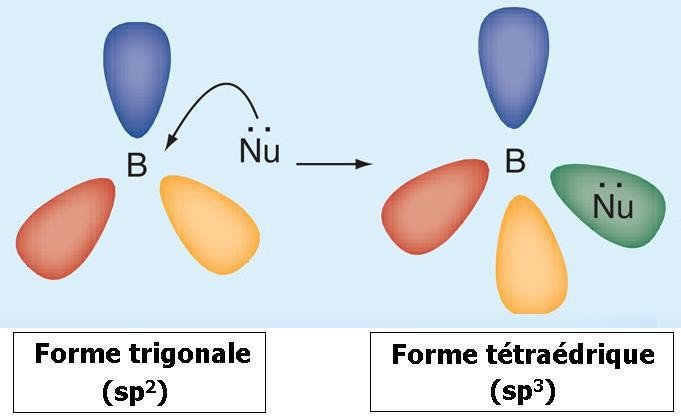
Plusieurs processus enzymatiques passent par la conversion d’un carbone « sp2 » (ex.
R2C=O) en carbone tétraédrique « sp3 » (voir schéma ci-dessous « A ») après la fixation d’un atome nucléophile (ex.
O).
La substitution d’un atome de carbone par un atome de bore permet à ce dernier une conversion de la forme trigonale (sp2) à la forme tétraédrique (sp3).
Seulement, avec le bore, le complexe « Bore-Atome nucléophile » étant très stable, le processus enzymatique se trouve bloqué. (voir schéma ci-dessous « B »).
Plusieurs molécules incorporant le bore comme élément actif, sont en cours de développement afin de les utiliser comme médicaments anticancéreux, antibiotiques, antidiabétiques, etc.
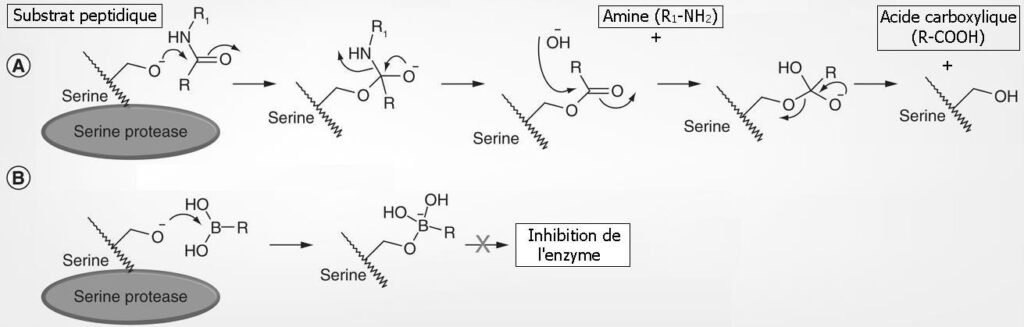
Figure : Mécanisme d’action des composés contenant un atome de bore dans l’inhibition d’une activité enzymatique
(A) Mécanisme d’action d’une sérine protéase (B) L’acide borique (RB(OH)2) forme un état de transition analogue à celui du carbone carbonyle, mais conduit à inhibition de l’enzyme.
Aspects pharmaceutiques du bore :
Acide borique B(OH)3 :
antimicrobien, il est
aujourd’hui abandonné en faveur d’autres agents plus efficaces est moins toxiques.
Toutefois, Il est toujours utilisé comme solution pour lavage oculaire (acide borique/borax).
bien et tampon dans des préparations à usage externe (collyre, pommade, crème, produits cosmétiques)
Bortezomib :
Premier médicament à base de bore, le Bortezomib (Velcade®) est un anticancéreux de la nouvelle classe des inhibiteurs de protéasome indiqué dans le myélome multiple.
L’atome de bore en est l’élément actif.
L’atome de bore présente une grande affinité avec le site catalytique du protéasome sur lequel il se fixe et en inhibe l’action selon le schéma décrit ci-dessus.
VI.2 L’ALUMINIUM
Aspects pharmaceutiques :
a.
Principe actif :
Médicament antiacide (administration per os)
Al(OH)3 (Gaviscon, Maalox) : étant soluble en milieu acide, il libère les anions OH-qui vont neutraliser l’acidité stomacale :
Al(OH)3(s) + 3H+ → Al3+(aq) + 3H2O(l)
AlPO4 (Phosphalugel) : antiacide d’action locale.
Le phosphate d’aluminium est insoluble en milieu acide.
Il tapisse la paroi interne de l’estomac tout en la protégeant de l’acidité gastrique.
Traitement de l’hyperphosphatémie (augmentation du taux du phosphate dans le sang) : On administre Al(OH)3 qui libère le cation Al3+ au niveau de l’estomac.
Lorsqu’il passe au niveau des intestins (pH 6 – 8.5) le cation Al3+ reprécipite sous forme colloïdale amorphe « Al(OH)3 » qui fixe les anions phosphate présent dans la lumière du tube digestive (potentiel ionique élevé de Al).
Le phosphate d’aluminium formé étant insoluble sera éliminé.
B.EXIPIENTS
Les sels d’aluminium (hydroxyde, phosphate, oxydes) sont utilisés comme agent adsorbant.
Adsorption : fixation d’une entité chimique (ion, atome, molécule à la surface d’un solide
Dans les vaccins, l’hydroxyde ou le phosphate d’aluminium sont utilisés comme adjuvants immunologiques.
Les antigènes (substances provoquant la réaction immunitaire) sont fixés sur l’adjuvant puis « présentés » aux cellules immunitaires.
Toxicité de l’aluminium :
Le corps humain élimine efficacement l’aluminium ingéré.
Toutefois et notamment chez les sujets dialysés (insuffisants rénaux), un syndrome appelé « encéphalopathie aluminique », peut apparaitre après une exposition importante d’aluminium (liquide de dialyse contenant de l’aluminium, alimentation, produits de cosmétiques, traitement antiacide).
L’accumulation de l’aluminium dans l’organisme provoque des atteintes cérébrales, hépatiques et osseuses.

