Le métabolisme des glucides
Le métabolisme des glucides
Introduction
Intérêts des glucides
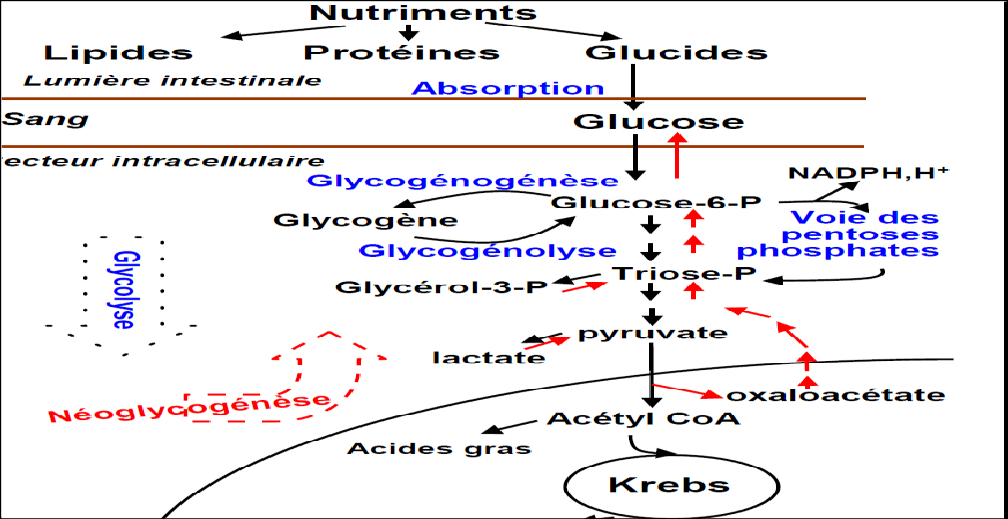
Les différentes voies du métabolisme glucidique
La digestion et absorption des glucides
La glycolyse
Cycle de krebs
Métabolisme du glycogène
Néoglucogenèse
Voie des pentoses phosphates
Introduction
Le mot métabolisme représente l’ensemble des transformations chimiques qui se produisent dans une cellule ou un ensemble de cellules convertissant les nutriments en produits finis, et en énergie.
Au cours de chaque voie métabolique, un précurseur est transformé en un produit « fini » via une série d’intermédiaires appelés « métabolites ».
Deux fonctions essentielles :
production d’énergie nécessaire aux fonctions vitales
synthèse de macromolécules (Acides nucléiques, protéines)
Le métabolisme est constitué de 2 types de processus :
Le catabolisme qui dégrade et oxyde les nutriments apportés par l’alimentation ou par les réserves cellulaires.
Les réactions cataboliques sont généralement exergoniques libère l’énergie ATP.
L’anabolisme permet la synthèse de molécules formées à partir de nutriments ou d’intermédiaires métaboliques de structure chimique simple et aboutissant à la synthèse de molécules complexes et/ou de macromolécules.
Intérêts des glucides
Réservoirs d’énergie : de molécules énergétiques et d’intermédiaires métaboliques.
Participent à la structure de l’ARN et l’ADN (ribose et désoxyribose).
Éléments de la structure de la paroi cellulaire des bactéries et végétaux (cellulose).
Liés aux protéines (glycoprotéines) et lipides (glycolipides).
Ils jouent des rôles clé dans les interactions cellulaires
Les différentes voies du métabolisme glucidique
La digestion et absorption des glucides
Digestion de l’amidon et du saccharose
L’amidon est digéré chez l’homme par les α-amylases salivaires et surtout pancréatiques.
Cette digestion aboutit à des oligomères de glucose (dextrines) puis au maltose et à l’isomaltose.
Au niveau de la bordure en brosse des entérocytes :
Une α-glucosidase (maltase) enlève un par un les résidus de glucose des oligomères linéaires, en partant des extrémités non réductrices.
Un complexe saccharase-isomaltase coupe l’isomaltose (2 molécules de glucose liées en α1 → 6), mais aussi le saccharose (glucose α1 → β2 fructose) en glucose et fructose.
Digestion du lactose
Le lactose est hydrolysé par la lactase de la bordure en brosse des entérocytes qui est le facteur limitant de l’absorption du lactose.
LACTASE
Lactose + H2O D-galactose + D-glucose
Saccharase
Saccharose + H2O D-fructose + D-glucose
maltase
Maltose + H2O 2 D-glucoses
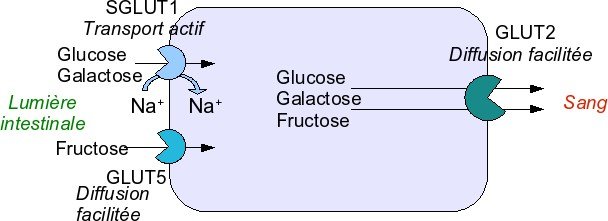
Absorption des oses simples
L’absorption se fait au niveau de la bordure en brosse des cellules épithéliales du duodénum et du jéjunum .
Elle nécessite des protéines transporteuses qui sont différentes selon la molécule à transporter.
Elle est médiée par des transporteurs spécifiques.
L’absorption du glucose se fait par un processus de cotransport d’ions sodium, actif, nécessitant de l’énergie.
Ce gradient dépend de l’activité de la Na+/K+/ATPase
le glucose, Le foie capte du sang porte par un transporteur GLUT-2.
Le fructose est absorbé par l’entérocyte selon un mécanisme passif, indépendant de celui du sodium et du glucose (GLUT-5).
Le galactose utilise le même transporteur actif que le glucose pour son entrée dans l’entérocyte.
Fructose et galactose comme le glucose sortent de l’entérocyte par un processus de transport
passif.

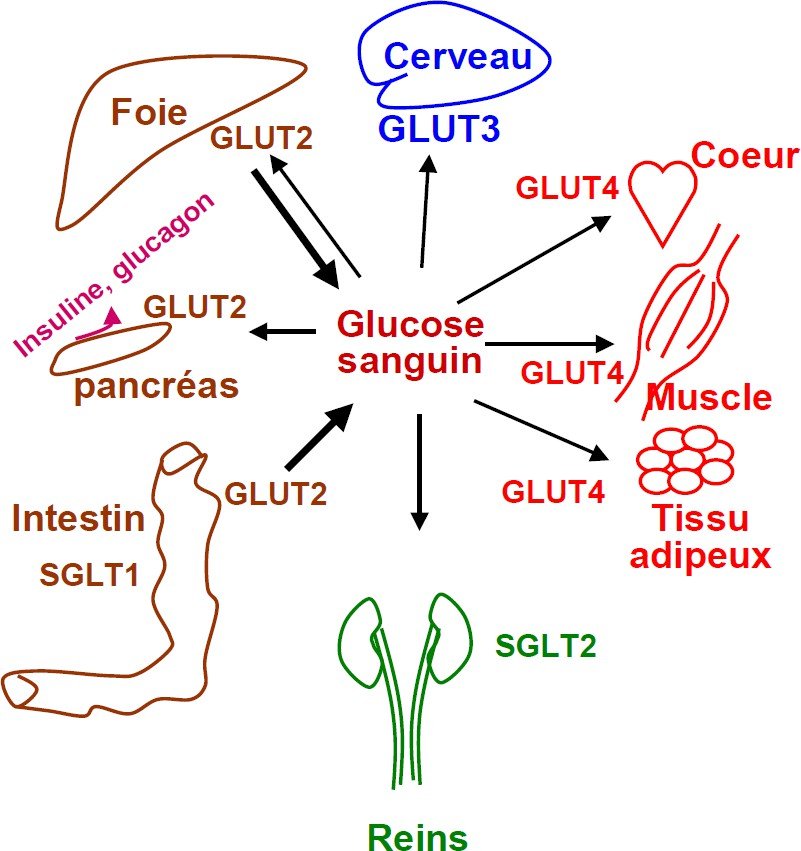
Répartition tissulaire des transporteurs
La glycolyse « voie d’Embden et Meyeroft »
Introduction
C’est la transformation catabolique du glucose au niveau cytosolique en deux molécules de pyruvate.
Au cours des réactions séquentielles, une partie de l’énergie libérée est conservée sous forme d’ATP.
Localisation tissulaire
Partout et toujours : la glycolyse a lieu dans toutes les cellules mais avec intensité différente.
Le globule rouge et le cerveau : sont gluco- dépendants, la glycolyse est importante,
Le muscle et le myocarde: utilisent indifféremment le glucose, surtout en période post- prandial.
Le foie et le tissu adipeux: utilisent peu le glucose, seulement en période post- prandial.
A.
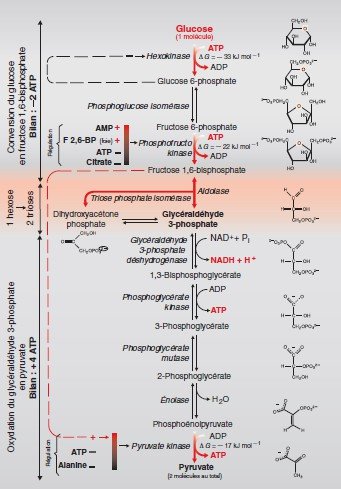
Vue d’ensemble de la voie de la glycolyse.
Elle se déroule en deux phases comportant chacune 5 réactions.
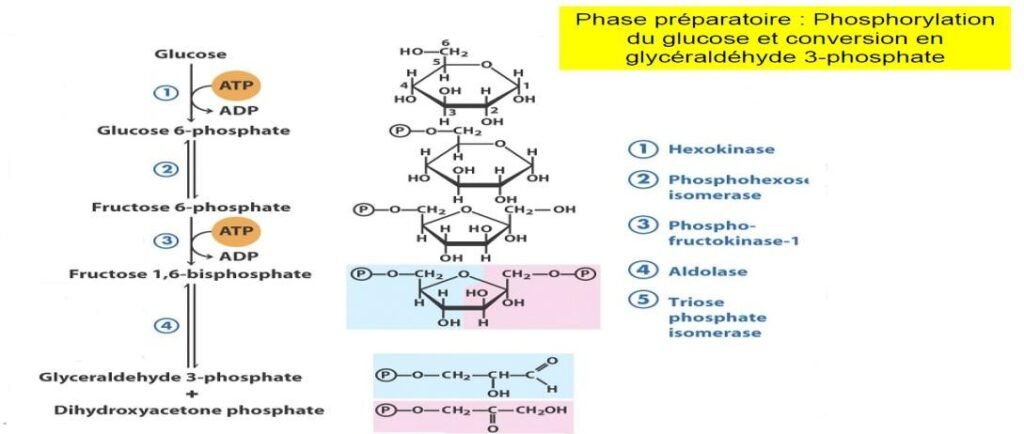
Phase 1 : c’est une phase préparatoire au cours de laquelle le glucose est phosphorylé puis scindé pour
donner 2 molécules de Phospho-glycéraldéhyde.
Phase 2 : c’est la phase de remboursement, les 2 molécules de phospho-glycéraldéhyde sont
transformées en pyruvate entraînant la synthèse de 4 molécules d’ATP.
Equation:
+ +
Glucose + 2 NAD + 2ADP + 2Pi 2 pyruvates + 2NADH, H
+ 2ATP + 2 HOH
Au total trois types de transformations chimiques doivent être remarqués:
la dégradation du squelette carboné du glucose donnant 2 molécules en C3 (pyruvate).
Le devenir du pyruvate dépend du type cellulaire.
la phosphorylation de l’ADP en ATP
+
le transfert d’atomes d’hydrogène et d’électrons au NAD pour former du NADH.
Phase préparatoire Elle utilise 5 réactions successives
Phosphorylation par l’hexokinase.
enzyme relativement peu spécifique et ubiquitaire
catalyse également la phosphorylation d’autres hexoses, comme le fructose et le mannose
Le foie contient une kinase plus spécifique, la glucokinase, soumise à une régulation et qui joue un rôle particulier dans le contrôle de la glycémie.
C’est une réaction d’amorçage : hydrolyse d’une molécule d’ATP.
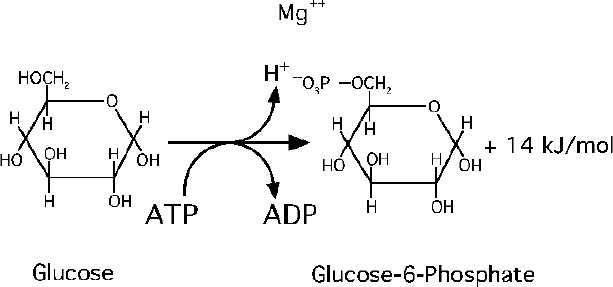
Avantages pour la cellule : la phosphorylation empêche le glucose de sortir par diffusion passive hors
de la cellule Il s’agit d’une réaction soumise à une régulation.
Conversion par la Phosphoglucose isomèrase.
C’est une isomèrisation réversible du Glucose-6P en fructose-6P.
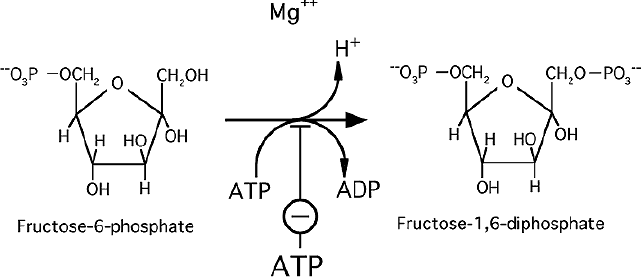
Phosphorylation en fructose-1,6-bisphosphate.
réaction est catalysée par la Phosphofructokinase ou PFK-1.
Cette une étape limitante de la glycolyse
Etape régulée.
C’est une réaction quasiment irréversible dans les conditions cellulaires
L’équilibre de la réaction est en faveur de la formation du fructose-1,6-bisphosphate.
C’est la deuxième réaction de la première phase consommant une molécule d’ATP.
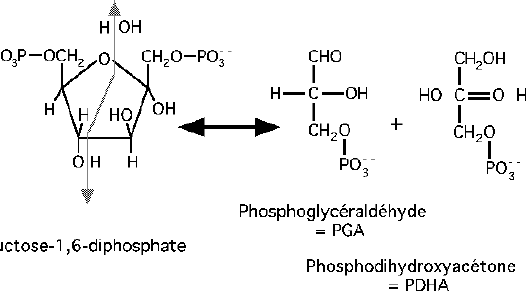
Clivage par l’aldolase.
Il s’effectue entre le C3 et le C4 libérant une molécule de Glycéraldéhyde-3-Phosphate et une molécule de dihydroxyacétone phosphate.
La réaction catalysée par l’aldolase est importante car cette étape marque la scission du glucose en 2 intermédiaires métaboliques importants.
Glycéraldéhyde-3-Phosphate et DHAP participent en effet à la néoglucogénèse.
Interconversion des trioses phosphate
seuls le Glycéraldéhyde-3-Phosphate sera le substrat.
Il faut donc une transformation rapide et réversible du dihydroxyacétone phosphate en glycéraldéhyde-3-Phosphate.
Cette réaction est assurée par le triose phosphate isomèrase.

Résumons
Phase de remboursement de la glycolyse
L’investissement d’énergie (consommation de 2 ATP) au cours de la phase préparatoire sera doublement restitué au cours de cette phase, par la transformation finale en 2 molécules de pyruvate et la synthèse de 4 ATP.
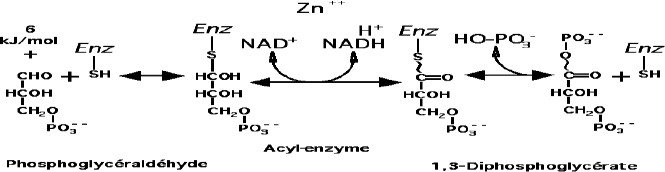
Oxydation du Glycéraldéhyde-3-Phosphate
Cette réaction est catalysée par la Glycéraldéhyde-3-Phosphate déshydrogènase (GAPDH).
+
En présence de NAD et de Phosphate inorganique, il y a formation d’une liaison anhydride carboxy-
phosphorique appelée ici liaison « acyl-phosphate ».
+
Les produits sont le 1,3-Bisphosphoglycerate (composé riche en énergie) et le NADH,H .
Transfert de Phosphate à l’ADP :
action de la Phosphoglycérate kinase.
L’enzyme catalyse le transfert du groupement acyl-phosphate à l’ADP pour former une autre liaison riche « anhydride phosphate » et ainsi donner une molécule d’ATP.
En présence d’ADP, la réaction produit de l’ATP et du 3-Phosphoglycérate
La réaction se déroule à l’équilibre
..
Transformation du 3-Phosphoglycérate en 2-Phosphoglycérate par une mutase
Elle catalyse un déplacement réversible d’un groupement phosphate entre le C2 et le C3 du substrat.
L’ion
magnésium est indispensable à cette réaction.
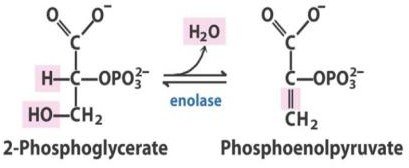
Déshydratation en Phosphoènolpyruvate.
C’est la seconde réaction de la glycolyse qui génère un composé « riche en énergie ».
Elle est catalysée par l’énolase.
Elle provoque l’élimination réversible d’une molécule d’eau du substrat pour donner le
phosphoénolpyruvate.
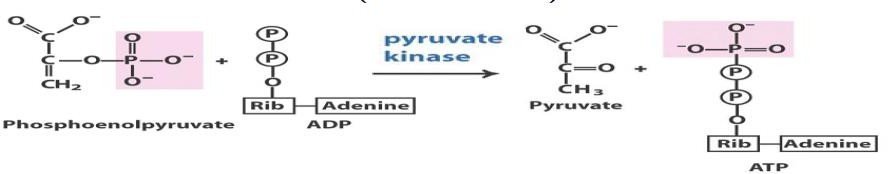
Transfert d’un groupement phosphate à l’ADP :
action de la pyruvate kinase.
C’est la dernière étape de la glycolyse.
C’est une réaction de phosphorylation
La réaction est quasiment irréversible dans les conditions intracellulaires.
Elle nécessite des ions magnésium, potassium et manganèse.
Résumons
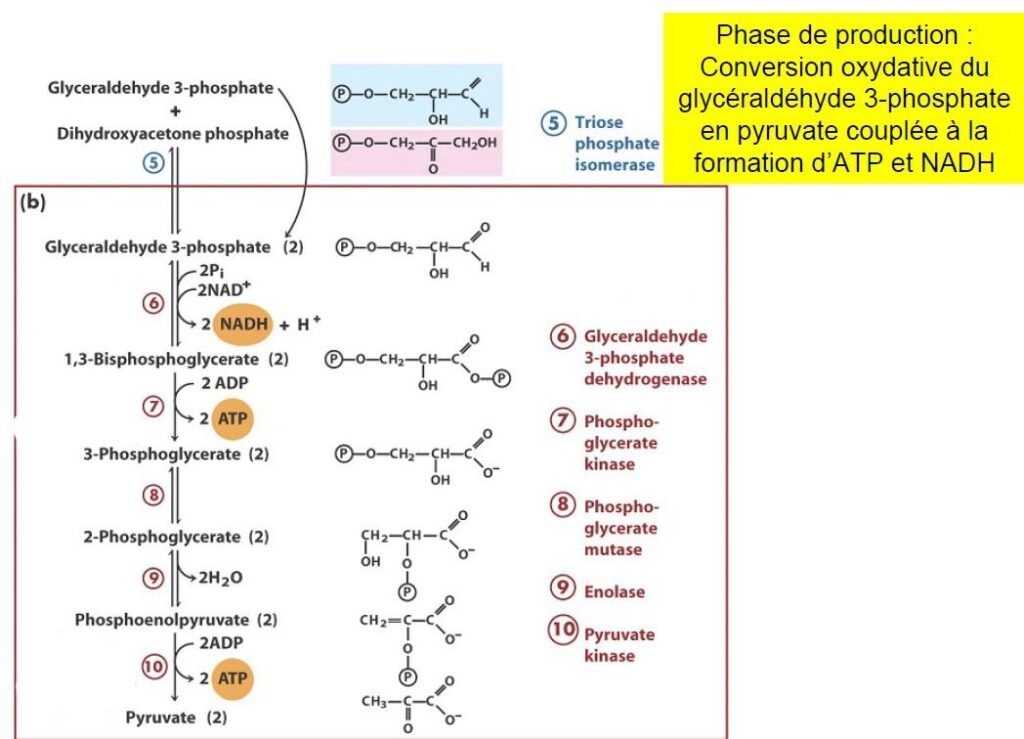
Schéma de la glycolyse
Devenir du pyruvate et du NADH H+ en anaérobie

Devenir du pyruvate et du NADH H+ en aérobie
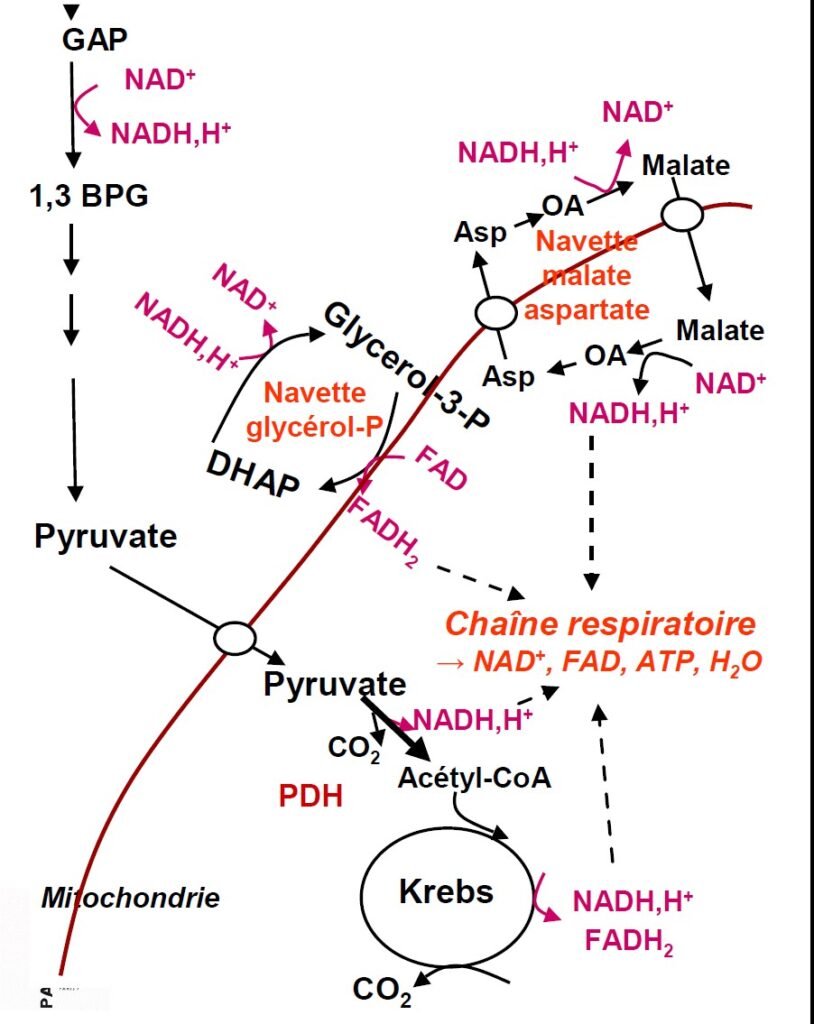
Régulation de la glycolyse.
Le flux de glucose à travers la voie de la glycolyse est régulé pour que les concentrations en ATP restent constantes.
la régulation fait intervenir 2 enzymes clés : La PFK-1 et la Pyruvate kinase.
Cependant la voie d’entrée contrôlée par l’hexokinase est également importante.
Les deux enzymes-clés sont régulés de façon allostérique par des variations de la concentration des métabolites-clés qui reflètent l’équilibre entre production et consommation d’ATP.
Rôle régulateur de l’hexokinase :
L’isoenzyme musculaire est inhibée par le produit, le glucose-6P.
L’isoenzyme hépatique (hexokinase D), appelée aussi glucokinase différe par ses propriétés fonctionnelles.
Son Km, de 10 mM, est plus élevé que la concentration en glucose sanguin.
Ceci permet au foie de jouer son rôle de capture efficace du glucose alimentaire en période post- prandiale.
l’enzyme n’est pas inhibée par le produit de la réaction, mais par le fructose-6P.
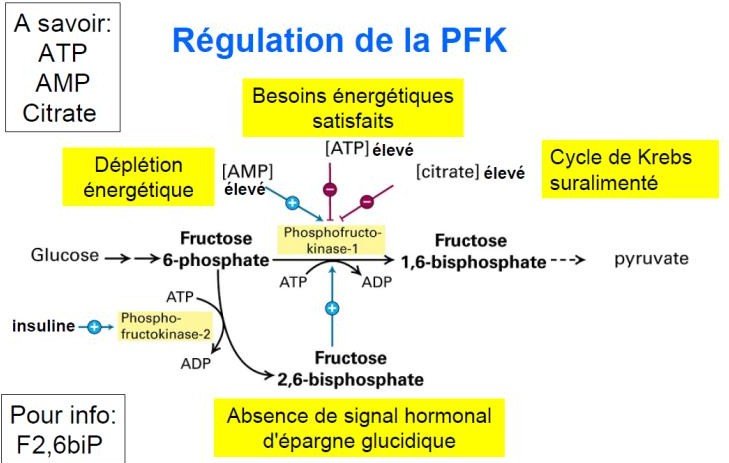
Rôle régulateur de la PFK-1 :
C’est un enzyme allostérique tétramèrique.
L’ATP est à la fois substrat et inhibiteur de la PFK-1.
L’ADP et surtout l’AMP lèvent l’inhibition due à l’ATP.
Le citrate, un intermédiaire-clé dans l’oxydation du pyruvate, représente aussi un régulateur allostérique important de la PFK-1.
Une concentration élevée en citrate augmente l’effet inhibiteur de l’ATP.
fructose 2,6 bisphosphate est l’effecteur allostérique le plus puissant de la PFK-1.
Lors de l’activation de la glycolyse, la néoglucogénèse est inhibée et vice versa.
Rôle régulateur de la pyruvate-kinase :
L’ATP se comporte comme un inhibiteur allostérique en diminuant l’affinité de l’enzyme
pour son substrat, le phosphoénolpyruvate.
Quand la concentration en ATP diminue, l’affinité de l’enzyme pour son substrat augmente,
permettant une augmentation de la vitesse de la catalyse
8- Régulation hormonale :
L’insuline augmente la teneur en glucokinase, phosphofructokinase et en pyruvate kinase
Glucagon diminue leurs activités.
Les voies d’alimentation de la glycolyse
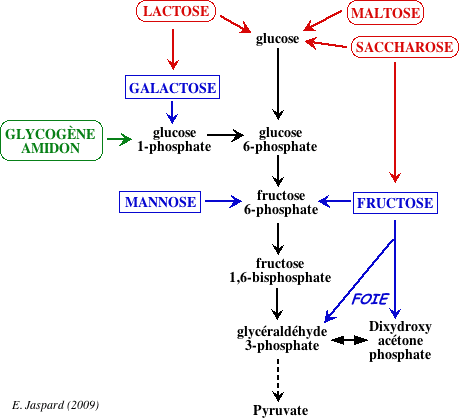
En dehors du glucose, de nombreux autres oses entrent
dans la voie de la glycolyse pour fournir de l’énergie.
le glycogène et l’amidon, les disaccharides
(saccharose, maltose, lactose) et les oses : fructose, galactose et mannose.
Le métabolisme du glycogène et de l’amidon sont proches sauf que le glycogène est le plus souvent d’origine endogène et l’amidon, d’origine alimentaire.
Métabolisme des autres sucres :
le fructose (saccharose et fruits) et le galactose (lactose).
A un degré moindre le mannose (hydrolyse des polysaccharides).
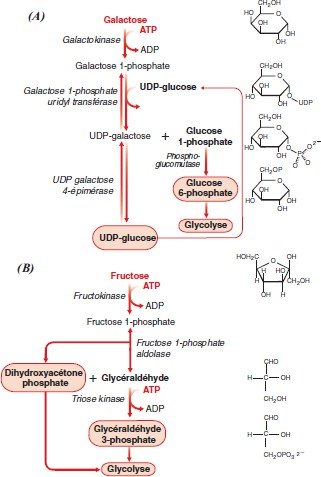
le fructose : Dans le muscle, il est phosphorylé par l’hexokinase et rentre dans la glycolyse.
Dans le foie, le métabolisme est différent la fructokinase catalyse la Phosphorylation du fructose en fructose-1P en présence d’ATP.
Le fructose-1P est clivé par la fructose-1P aldolase en glycéraldéhyde et dihydroxyacétone-phosphate.
Le glycéraldéhyde est phosphorylé en glycéraldéhyde phosphate par une triose kinase et ainsi les 2 produits rentrent dans la voie de la glycolyse.
L’intolérance au fructose, maladie génétique liée à une déficience en fructose-1P aldolase entraîne une hépatomégalie souvent associée à un retard staturo-pondéral.
Le galactose : carburant essentiel des produits laitiers.
Il ne peut être phosphorylé directement car non reconnu par les hexokinases.
Il est phosphorylé par une galactokinase dans le foie en galactose-1P puis épimérisé en glucose-1P
Dans la galactosémie congénitale, maladie génétique caractérisée par l’impossibilité de convertir le galactose en glucose, la galactose-1P uridylyl transférase est déficiente, ce qui conduit à l’accumulation de produits métaboliques toxiques (dont le galactitol).
Le mannose, peut être facilement phosphorylé par l’hexokinase en mannose-6P et ensuite isomérisé par une phosphomannose isomérase en fructose-6P rejoignant ainsi la glycolyse.
Schéma du métabolisme du galactose et du fructose
Le cycle de l’acide citrique
C’est une voie de dégradation oxydative commune aux procaryotes et aux eucaryotes
Appelé aussi cycle des acides tricarboxyliques ou cycle de Krebs.
Il constitue le carrefour principal du métabolisme permettant l’oxydation de la plupart des oses, des acides gras et des acides aminés, et fournit de très nombreux métabolites intermédiaires des réactions de biosynthèse.
C’est le véritable centre du métabolisme intermédiaire.
Vue d’ensemble du cycle de Krebs.
8 réactions successives organisées en une voie métabolique cyclique,
assure l’oxydation de l’acétyl-CoA en 2 molécules de gaz carbonique
permet de récupérer l’énergie libre disponible pour la synthèse d’ATP via l’alimentation de la chaîne
+
respiratoire par 3 NADH,H et un FADH2.
se déroule dans la matrice mitochondriale à l’aide de 8 enzymes dont sept solubles et un fixé sur la
membrane mitochondriale interne MMI (succinate deshydrogènase).
Origine et formation de l’acétyl-CoA.
produit commun de l’oxydation des sucres, des acides gras et des acides aminés,
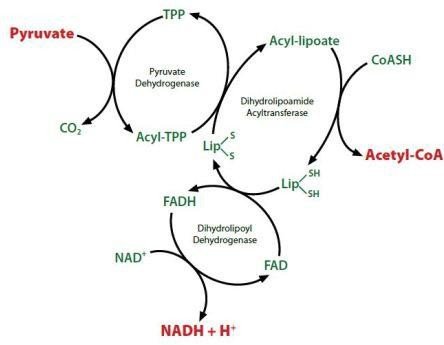
Le pyruvate est oxydé pour fournir de l’acétyl-CoA et du gaz carbonique par un ensemble de 3 enzymes, le complexe pyruvate déshydrogénase, localisé dans les mitochondries.
La réaction catalysée est une décarboxylation oxydative :
Structure du complexe pyruvate déshydrogénase
Il nécessite la participation de 3 enzymes et de 5 coenzymes.
Enzymes : E1 : pyruvate deshydrogènase ; E2 : dihydrolipoyl transacétylase ; E3 : dihydrolipoyl deshydrogènase.
Coenzymes : Thiamine pyrophosphate (TPP); FAD, Coenzyme A, NAD et acide lipoïque.
Etapes de la décarboxylation oxydative du pyruvate en acétyl-CoA.
– Etape 1 : Réaction du pyruvate avec E1
formation d’un dérivé hydroxyéthyle-TPP.
-Etape 2 : Transfert de 2 électrons et du groupement hydroxyéthyle au groupement lipoyl-lysine de l’enzyme E2 avec formation d’un acétyl-thioester.
-Etape 3 : Transestérification en présence de CoA
avec formation d’acétyl-CoA etde dithiol-lipoyl-lysine de E2.
-Etape 4 : Transfert de 2 électrons de E2
(lipoyl-lysine réduite) au FAD de E3 restaurant ainsi la forme oxydée du groupement lypoyl-lysine de E2, avec libération de FADH2.
+
-Etape 5 : Transfert d’un ion hydrure de E3 au NAD
+
pour former du NADH,H .
Les réactions du cycle de l’acide citrique.
Formation du citrate.
C’est la condensation de l’acétyl-CoA avec l’oxaloacétate catalysée
par la citrate synthase :
Formation de l’isocitrate.
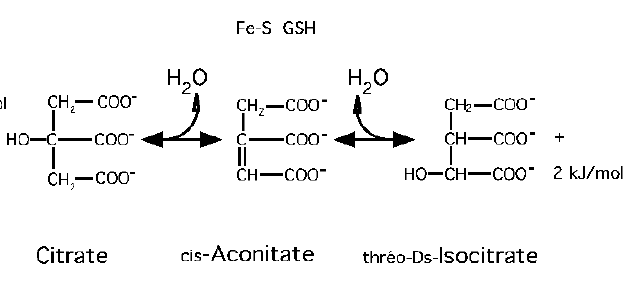
Il s’agit d’une isomèrisation réversible du citrate en isocitrate par l’aconitase.
Oxydation de l’isocitrate par l’isocitrate déshydr Il s’agit d’une décarboxylation oxydative :
ogénase
Oxydation de l’alpha-cétoglutarate en succinyl-CoA.
Il s’agit aussi d’une décarboxylation oxydative catalysée par l’alpha-cétoglutarate deshydrogènase :
+
Alpha-cétoglutarate + CoA-SH + NAD
+
NADH, H + succinyl-CoA + CO2
alpha-cétoglutarate deshydrogènase thioester riche en énergie
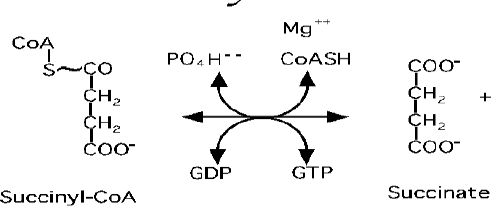
Transformation du succinyl-CoA en succinate par la succinyl-CoA synthétase
L’énergie libre de la liaison thioester est utilisée pour permettre la synthèse d’une molécule de GTP à partir du GDP.
Les 5 premières étapes du cycle de Krebs conduisent :
l’incorporation de 2 carbones.
sont libérées 2 molécules de CO2,
2 NADH
1 GTP (équivalent d’un ATP)
Oxydation du succinate en fumarate
Cette réaction est catalysée par une flavoprotéine, la succinate déshydrogénase, seul enzyme de cette voie lié à la membrane mitochondriale.
Succinate + FAD Fumarate + FADH2
Succinate déshydrogénase
Hydratation du fumarate en malate par la fumarase : réaction réversible
Fumarate + HOH malate Fumarase
Oxydation du malate en oxaloacétate.
C’est la dernière réaction du cycle, catalysée par la malate deshydrogènase.
+
Malate + NAD
+
oxaloacétate + NADH,H
Malate déshydrogénase Schéma cycle de krebs
Bilan énergétique et moléculaire du cycle de Krebs
Les transformations chimiques essentielles du cycle peuvent être ainsi résumées :
Un groupe acétyle est oxydé en 2 molécules de CO2.
3NAD sont réduites en 3 NADH (1NADH = 3 ATP via la chaîne respiratoire) = 9 ATP
1FAD est réduite en FADH2 ( 1FADH2 = 2 ATP) = 2 ATP.
Une liaison riche en énergie est formée sous la forme de GTP qui sera transformée en 1ATP.
Au total 12 molécules d’ATP qui seront formées à chaque tour de cycle.
Le bilan énergétique complet de l’oxydation d’une molécule de glucose :
Glycolyse : transformation du glucose en pyruvate : 8 ATP
Pyruvate déshydrogénase : 2 NADH
6 ATP formés.
Cycle de Krebs : 24 ATP
Soit un total de 38 ATP formés par molécule de glucose.
Régulation du cycle de Krebs.
La plupart des réactions se déroulent à l’équilibre sauf trois:
le point d’entrée est régulé au niveau du pyruvate déshydrogénase.
Le citrate synthase,
l’isocitrate déshydrogénase
l’alpha-cétoglutarate déshydrogénase.
Le cycle de l’acide citrique :
est accéléré lorsque les besoins énergétiques cellulaires sont insatisfaits, reflété par l’augmentation des rapports :
NAD”/NADH,H+,
ADP/ATP
coenzyme A/acétyl-CoA ;
est freiné lorsque les besoins énergétiques sont satisfaits, reflété par la diminution de ces rapport Le succinyl-COA, inhibe les 1ère et 3ème réactions du cycle.
La néoglucogenèse
La biosynthèse de glucose est une nécessité absolue chez l’homme, parce que le cerveau, la médullosurrénale, les érythrocytes utilisent le glucose comme unique source d’énergie.
La néoglucogenèse consiste en la synthèse de glucose à partir de précurseurs non glucidiques.
Elle est effectuée essentiellement par le foie (80 à 90%) et accessoirement par le rein,.
A l’opposé, les organes consommateurs de glucose n’en produisent que très peu.
La voie de la néoglucogenèse
Durant les 24h qui suivent un jeûne, 70% du glucose produit par le foie provient de la néoglucogenèse.
Parmi les précurseurs non glucidiques de cette voie,
le lactate,
le pyruvate,
certains intermédiaires du cycle de Krebs et les squelettes carbonés de la plupart des acides aminés.
Tous ces composés doivent d’abord être transformés en oxaloacétate, véritable point de départ de cette voie métabolique.
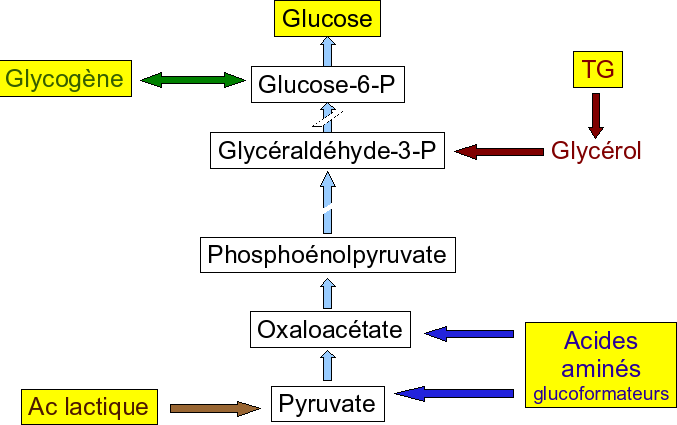
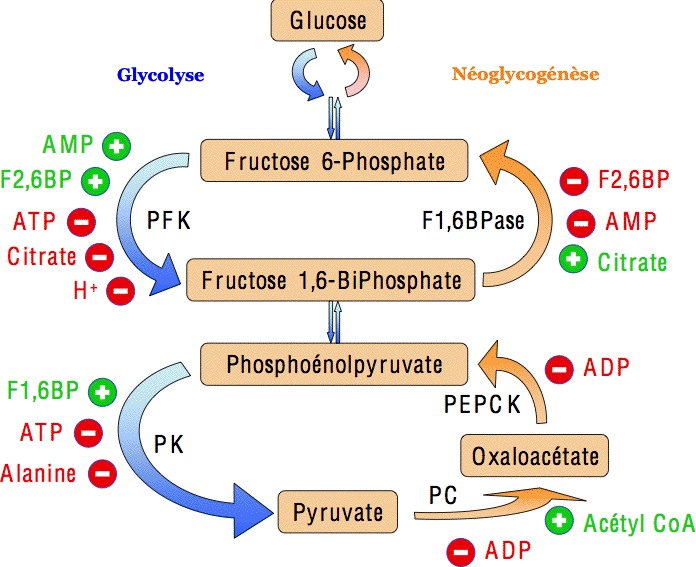
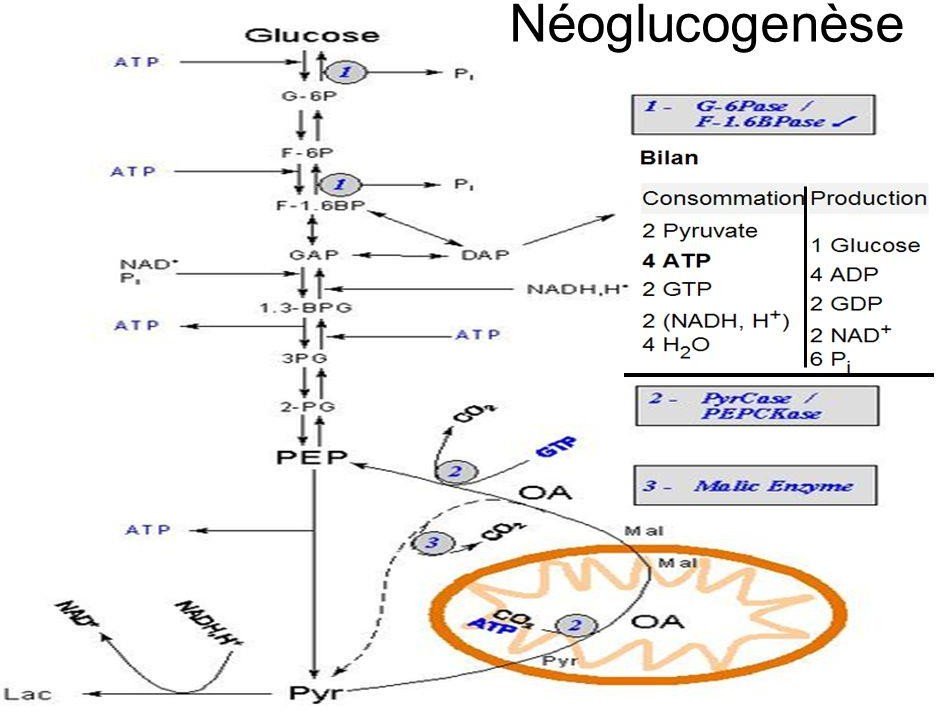
Sur les réactions de la néoglucogenèse,
7 sont des réactions en sens inverse des réactions de la glycolyse.
3 étapes sont totalement irréversibles
hexokinase,
PFK-1
pyruvate kinase.
Ces trois étapes sont effectuées par des enzymes différents
Contournement par conversion du pyruvate en phosphoénolpyruvate.
Cette étape nécessite l’action de 2 enzymes distincts.
Elle nécessite le transport du pyruvate du cytosol vers la mitochondrie. .
–
Pyruvate + HCO3 + ATP oxaloacétate + ADP + Pi
Pyruvate carboxylase
Cette réaction représente la première étape régulatrice de la voie: l’acétyl-CoA est un effecteur positif de
l’enzyme.
Dans une deuxième étape, toujours mitochondriale, l’oxaloacétate est réduit par la malate deshydrogènase :
+
Oxaloacétate + NADH, H
+
malate + NAD
Malate deshydrogènase
Le malate sort alors de la mitochondrie dans le cytosol et est réoxydé en oxaloacétate avec production de NADH cytosolique.
Intervient alors la PEP-carboxykinase qui catalyse la réaction suivante : Oxaloacétate + GTP phosphoénolpyruvate + CO2 + GDP
Contournement par conversion du fructose-1,6-bisphosphate en fructose-6P
Dans le cytosol, 5 étapes communes à la glycolyse mais effectuées en sens inverse, conduisent à la production de fructose-1,6-bisphosphate.
La réaction catalysée par la PFK-1 est contournée.
Fructose 1,6-bisphosphate + HOH fructose-6P + Pi
Fructose-1,6-bisphosphatase
Contournement de la troisième étape : action de la glucose-6 phosphatase
Après isomérisation du fructose-6P en glucose-6P, le glucose est libéré exclusivement par le foie sous l’action
de la glucose-6 phosphatase.
Remarquons que cet enzyme est absent du cerveau et des muscles où il n’y a pas de néoglucogénèse.
Glucose-6P + HOH Glucose + Pi
Coût énergétique de la néoglucogenèse.
Le bilan des réactions de biosynthèse conduisant du pyruvate au glucose est donc :
+
2 pyruvate + 4ATP + 2GTP + 2NADH + 4 HOH Glucose + 4ADP + 2GDP + 6Pi + 2NAD
+
+ 2H
L’énergie nécessaire est fournie par l’hydrolyse de 4 ATP et de 2 GTP.
Autres molécules glucoformatrices
-Le lactate : érythrocytes et muscles.
-Acides aminés glucoformateurs en fonction de leurs métabolites d’entrée :
| Acids amines | Intermediaires métaboliques |
| Ala, Ser, Cys, Gly, Trp | pyruvate |
| Asp, Asn | oxaloacétate |
| Arg, Glu, Gln, His, Pro | alpha-cétoglutarate |
| Ile, Met, Thr, Val | succinyl-CoA |
| Phe, Tyr | fumarate |
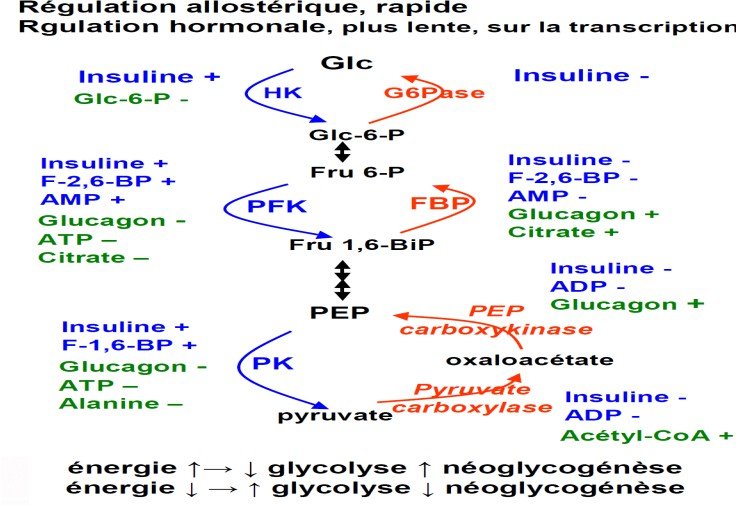
Régulation de la néoglucogenèse.
1) Régulation allostérique
La néoglucogenèse et la glycolyse sont régulées de façon séparée
Le point de contrôle se situe à 2 niveaux la pyruvate déshydrogénase et la pyruvate carboxylase
Le pyruvate carboxylase
Activée par l’acétyl-coA, le NADH, H+ et l’ATP la pyruvate déshydrogénase
Inhibée par l’acétyl-coA, le NADH, H+ et l’ATP
Les 2 réactions entre le fructose-6-phosphate et le fructose-1,6-bisphosphate,
catalysées dans le sens de la néoglucogenèse par la fructose-1,6-bisphosphatase
catalysée dans le sens de la glycolyse par la phosphofructokinase-1.
| PFK1 | Fructose 1,6 biphosphatase |
| Inhibée par le citrate et l’ATP | Inhibée par le fructose 2,6 BiP |
| Activée par le fructose 2.6 BiP | Activée par le citrate et l’ATP |
c) Régulation hormonale de la néoglucogenèse Excès de glucose:
L’insuline entraine une augmentation de la concentration de F2.6 BiP ce qui stimule la glycolyse et inhibe la néoglucogenèse.
Baisse de glucose
le glucagon entraine une baisse de la concentration du F2.6 BiP ce qui stimule la néoglucogenèse et inhibe la glycolyse.
Pathologie de la néoglucogenèse
Une stimulation de la néoglucogenèse est observée lors du diabète sucré et contribue à l’hyperglycémie.
Une diminution de la néoglucogenèse s’observe dans diverses situations entraînant hypoglycémie et hyperlactatémie.
On observe un déficit spécifique en glucose-6-phosphatase lors de la glycogénose de type I, où s’observe une mauvaise tolérance au jeûne et une hypoglycémie.
Le métabolisme du glycogène
Introduction :
Le glycogène est un polysaccharide de réserve capable de délivrer à la demande, du glucose.
Sous forme de granules cytoplasmiques de 10 à 40 nm de diamètre
il est particulièrement réparti dans le tissu musculaire (2% de la masse cellulaire) et dans le foie (5 à 8% de la masse cellulaire).
la cellule utilise le glycogène pour 3 raisons :
– Les muscles ne peuvent pas mobiliser les triglycérides aussi rapidement que le glycogène.
Les acides gras ne peuvent être mobilisés en anaérobiose.
Les animaux ne peuvent convertir les acides gras en glucose.
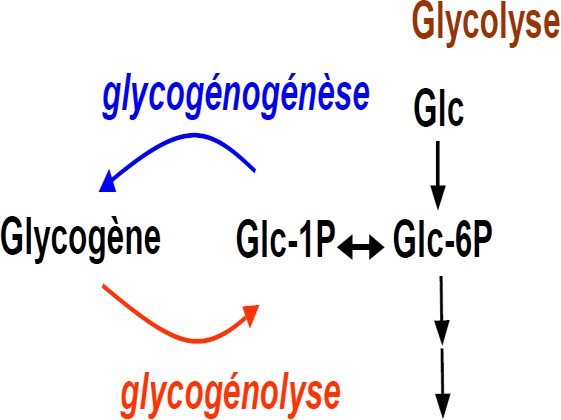
Dégradation du glycogène : la glycogénolyse
Elle fait intervenir 3 enzymes :
la glycogène phosphorylase,
l’enzyme de débranchement,
la phosphoglucomutase.
Action de la glycogène-phosphorylase
Elle catalyse la phosphorolyse d’un résidu de glucose (au moins 5 unités d’un point de branchement).
Glycogène (n) + P Glycogène (n-1) + Glucose-1P
Le phosphate de L-pyridoxal est un cofacteur indispensable à la réaction.
L’enzyme agit de façon répétitive sur toutes les extrémités non réductrices des ramifications jusqu’à atteindre un point situé à 4 unités d’un point de branchement où elle devient inefficace.
L’enzyme produit donc de la dextrine « limite ».
Elle reprend son action catalytique après action de l’enzyme débranchant.
Action de l’enzyme débranchant.
C’est une oligo (α1−6) / (α1−4) glucanetransférase qui catalyse le débranchement en 2 étapes successives :
* Activité transférase : c’est une (α1−4) qui transfère un oligosaccharide transglycosylase constitué de 3 glucoses unis-en (α1−4) sur l’extrémité non réductrice de la ramification la plus proche.
*Activité glycosidasique : c’est une (α1−6) glucosidase qui hydrolyse le sucre unique uni en (α1−6) à la
chaîne branchée sous-jacente.
Les 2 activités catalytiques sont portées par le même enzyme.
Action de la phosphoglucomutase.
Elle convertit les produits des 2 réactions précédentes Glucose-1P en Glucose-6P Schéma de la glycogénolyse
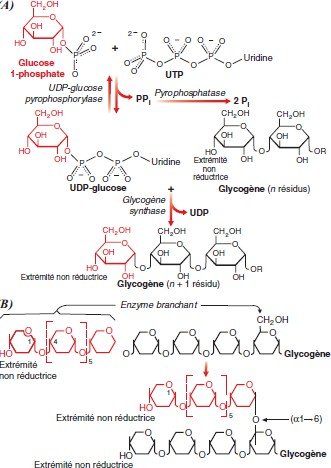
Synthèse du glycogène
La synthèse du glycogène = Glycogènogénèse.
Glycogènogénèse.et glycogènolyse s’établissent donc par des voies distinctes
Trois réactions successives sont nécessaires pour la glycogènogénèse :
l’UDP-Glucose pyrophosphorylase,
la glycogène-synthétase,
l’enzyme branchant
L’UDP-Glucose pyrophosphorylase
Catalyse la première réaction
Apporte l’énergie nécessaire à l’action de la synthétase.
Glucose-1P + UTP UDP-Glucose + PPi Activité pyrophosphorylase
PPi + HOH 2 Pi
Activité pyrophosphatase
La glycogène-synthase
-catalyse le transfert d’un glucose sur le C4 d’une des extrémités non réductrices du glycogène pour établir une liaison osidique (α1−4).
-La régénération de l’UTP est catalysée par une nucléoside diphosphate kinase :
UDP + ATP UTP + ADP
-La réaction catalysée par la synthase ne peut qu’allonger une chaîne de glucane existante.
Pour initier donc la synthése de glycogène, l’enzyme utilise une protéine, la glycogènine : une amorce
dont le résidu Tyr194 reçoit un glucose par l’action d’une glycosyltransférase
Glycogénine Tyr194 + UDP-Glucose Glycogènine-Tyr-Glucose + UDP
allongement par l’addition séquentielle de 7 glucoses, effectuée par l’action glucosyl-transférase autocatalytique de la glycogènine.
la Glycogène-synthase prend le relais en allongeant la chaîne de glycogène et en la dissociant de la glycogènine.
L’action combinée de la glycogène-synthase et de l’enzyme branchant termine la particule de
glycogène.
Action de l’enzyme branchant
La structure ramifiée du glycogène est liée à l’action d’l’enzyme branchant ou amylo (α1−4) (α1−6)
transglycosylase.
une activité glycosyl (4-6) transférase catalyse le transfert d’un fragment linéaire de 6 ou 7 glucoses depuis l’extrémité d’une branche contenant au moins 11 résidus de glucose sur le groupe hydroxyle en C6 d’un glucose de la même chaîne ou d’une ramification proche créant ainsi un nouveau point de branchement.
D’autres glucoses peuvent alors être rajoutés par la glycogène synthase allongeant ainsi cette nouvelle ramification.
L’effet global des ramifications est d’augmenter la solubilité du glycogène et d’augmenter le nombre des terminaisons non réductrices, facilitant ainsi la sensibilité du glycogène aux opérations de synthèse et/ou de dégradation.
Schéma Glycogénogénèse.
Régulation du métabolisme du glycogène.
glycogènogénèse et glycogénolyse sont 2 voies qui ne peuvent fonctionner simultanément
elles sont donc régulées rigoureusement en fonction des conditions métaboliques de la cellule.
La régulation met en jeu des mécanismes allostèriques et des modifications covalentes sous contrôle hormonal.
Glycogénolyse et glycogénogenèse sont soumises à une régulation réciproque
contrôle allostérique, les mêmes effecteurs ayant des effets contraires ;
contrôle par modification covalente
(phosphorylation-déphosphorylation) sous dépendance hormonale ; la phosphorylation a des effets contraires : tandis qu’elle active la glycogène phosphorylase, elle inactive la glycogène synthase.
Les maladies de stockage du glycogène
Ces maladies de cause génétique, sont dues à un dérèglement du métabolisme du glycogène et sont dénommées glycogénoses.
Exemple le Type I.
Si la glucose-6 phosphatase est déficiente, on observe une accumulation de Glucose 6P dans le foie, qui provoque une accumulation anormale de glycogène de structure normale dans le foie et les reins .La maladie se manifeste aussi par une impossibilité de libérer du glucose en réponse au glucagon ou à l’adrénaline.
Voie des pentoses phosphates, shunt des hexoses monophosphate, voie du 6- phosphogluconate, ou voie de Dickens-Horecker.
C’est une voie du métabolisme énergétique, mais n’a pas pour but de produire de l’énergie.
Rôles
+
La production de NADPH,H ,coenzyme réduit (pouvoir réducteur) nécessaire à :
O Des réactions de synthèse réductrices : acides gras, hormones stéroïdes, cholésterol.
o Des réactions de réductions particulières : réduction du glutathion dans l’érythrocyte.
La production de pentoses : ribose-5-phosphate : synthèse coenzymes pyridiniques
+ +et NADP ), des coenzymes flaviniques (FMN et FAD), la biosynthèse des nucléotides
(NAD
La production d’érythrose-4-phosphate, précurseur d‘acides aminés aromatiques.
II/ LOCALISATION
La voie des pentoses phosphates est ubiquitaire, mais a lieu surtout dans : Le foie : synthèse des acides gras, cholestérol ;
Le tissu adipeux : synthèse des acides gras.
La glande mammaire : synthèse des acides gras (lactation).
Les tissus stéroïdogènes : synthèses des hormones stéroïdes (testicules, ovaires, surrénales) ; Les hématies : réduction du glutathion
Elle se déroule dans le cytosol
NB : la voie des pentoses phosphates est très faible dans le muscle où les synthèses réductrices sont rares et le glucose est réservé à la production d’énergie .
III/ VUE D’ENSEMBLE
La voie des pentoses phosphates peut être décomposée en 3 phases :
–Phase oxydative : oxydation du glucose-6P et formation du ribulose-5- phosphate, avec production du NADPH,H+, irréversible.
Phase d’isomérisation des pentoses: réversible.
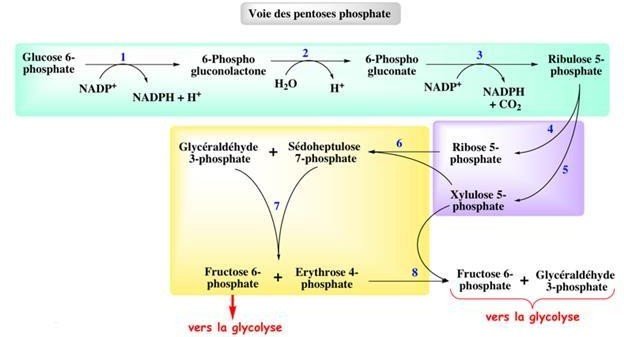
Figure 1 : vue d’ensemble de la voie des pentoses phosphates
– Phase non oxydative : réversible.
IV/ LES REACTION DE LA VOIE DES PENTOSES PHOSPHATES
1/ La phase oxydative
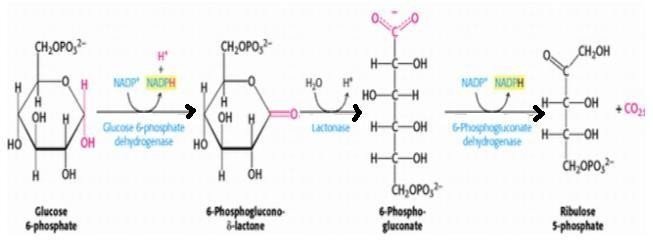
Catalysée par : la glucose -6- phosphate déshydrogénase (G6PD) => enzyme clé.
+
Apparition de deux molécules de NADPH,H .
Cette phase est irréversible.
2/ La phase d’isomérisation des pentoses
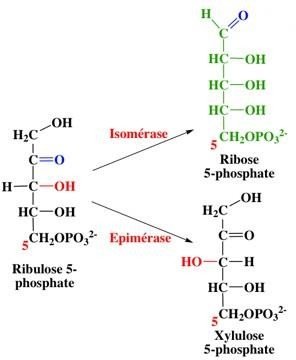
Intervention de deux enzymes : Epimérase : cétose cétose.
Cette phase est réversible.
Ismomérase : cétose aldose

3/La phase non oxydative
Elle est caractérisée par trois réactions ;
*La première réaction
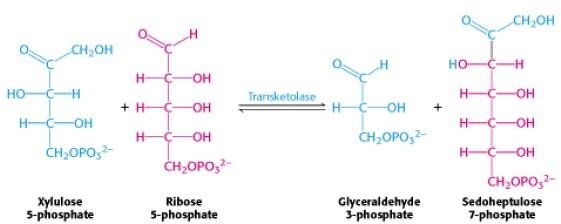
*La deuxième réaction
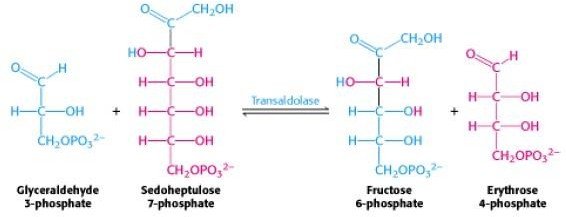
*La troisième réaction
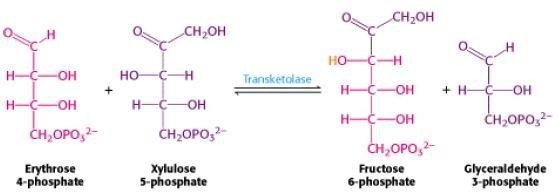
Cette phase permet d’établir une liaison entre la voie des pentoses phosphates et la glycolyse grâce à deux enzymes :
La transcétolase : transfert une unité à deux carbones.
La transaldolase : transfert une unité à trois carbones
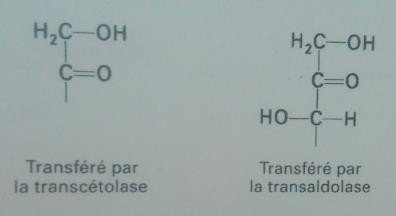
L’ose donneur des unités de deux ou trois carbones est toujours un cétose.
L’ose accepteur est toujours un aldose.
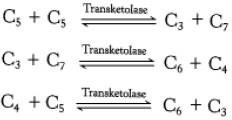

Tableau récapitulatif des réactions de la voie des pentoses phosphates

V/FONCTIONNEMENT DE LA VOIE DES PENTOSES PHOSPHATES
Le devenir du glucose-6-phosphate (dans la voie des pentoses phosphates) est fonction des besoins cellulaires en ribose en en NADPH,H+ ;
Trois situations (modes) cellulaires différentes sont possibles :
Situation ou mode 1
Les besoins en ribose-5-phosphate sont supérieurs au besoins en NADPH,H+ ex : les cellules à multiplication rapide.
La phase oxydative est court-circuitée.
La phase non oxydative (avec la phase d’isomérisation) est renversée (les réactions de transcétolisation et de transaldolation sont réversible).
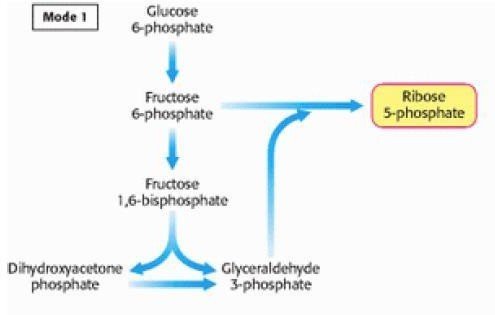
Figure 2 : mode 1 du fonctionnement de la VPP.
Situation ou mode 2 Les besoins en ribose-5-phosphate et NADPH,H+ sont équilibrés ;
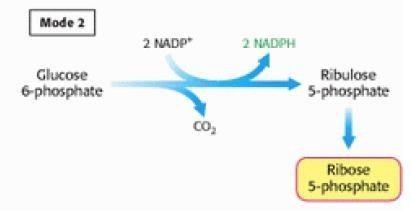
Figure 3 : mode 2 du fonctionnement de la VPP
Situation ou mode 3
Les besoins en NADPH,H+ sont supérieurs aux besoins en ribose-5- phosphate ; Les deux phases sont menées à terme ;
Le fructose est soit:
Interconverti en glucose-6-phosphate, qui entre à nouveau dans la voie, ex : le globule rouge (figure A).
Ou entre dans la glycolyse, si besoin est, ex : tissu adipeux (figure B).
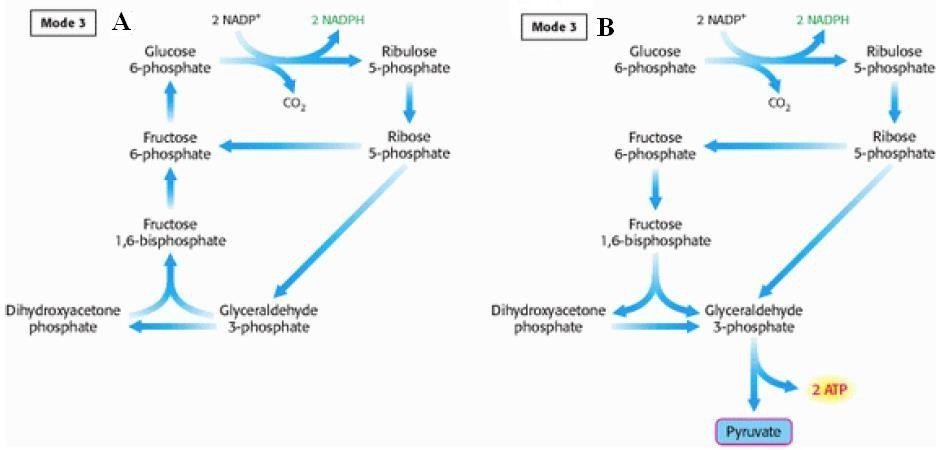
Figure 4 : mode 3 e fonctionnement de la VPP, situation A et B.
VI/ PATHOLOGIE : DEFICIT EN G6PD ET L’ANEMIE HEMOLYTIQUE
Le glutathion réduit par NADPH,H+ protège le globule rouge des dommages causés par des molécules oxydantes (stress oxydatif).
Les hématies sont exposées à une grande réactivité de l’oxygène =>
formation de radicaux libres oxygénés et du peroxyde d’hydrogène
Ces radicaux libres sont des produits toxiques : ils réagissent avec les lipides membranaires du globule rouge et fragilisent cette dernière d’où sa destruction => lyse du globule rouge.
Action du glutathion : élimination des radicaux libres.
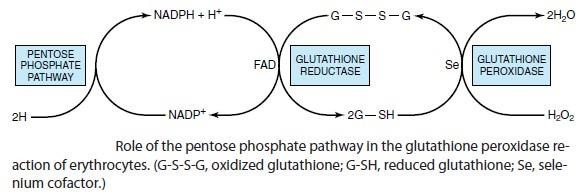
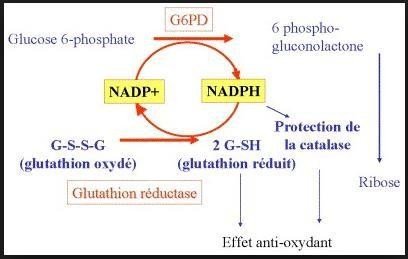
Figure 5: voie des pentoses phosphates et réduction du glutathion
Un déficit en G6PD : diminution du pool globulaire du glutathion réduit
=> Anémie hémolytique déclenchée par les infections ou l’ingestion
d’aliments comme les fèves ou de médicaments (cf. tableau) oxydants.
C’est une maladie dont la transmission est récessive liée à X
NB
Une forte ingestion des fèves (saison du printemps) entraine une forte anémie hémolytique : Favisme
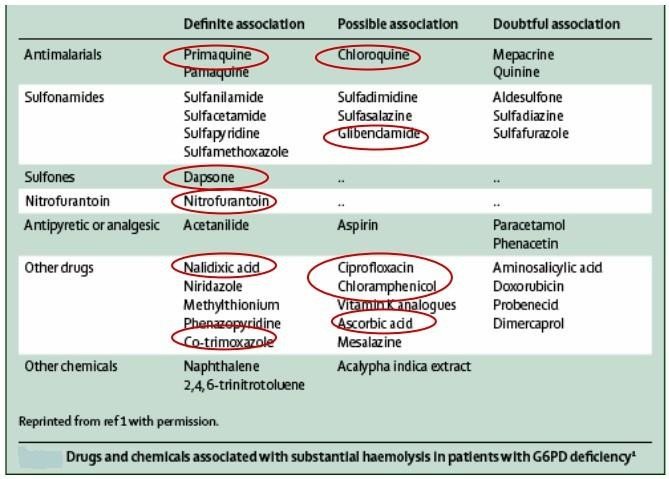
Tableau 1 : liste de médicaments déclenchant une hémolyse en cas de déficit en G6PD.
40

