Groupe 1
| GROUPE 1 |
|---|
| Groupe 1Plan :I-Etat naturel II- Préparations des AlcalinsIII -Propriétés atomistiques et physiquesIV – Propriétés chimiques générales V- Relations diagonales et propriétés particulières du lithium VI – Composés du sodiumVII- Usages des alcalins |
| Élément | Symbole | Numéro Atomique | Configuration électronique |
|---|---|---|---|
| Lithium | Li | 3 | [He] 2s1 |
| Sodium | Na | 11 | [Ne] 3s1 |
| Potassium | K | 19 | [Ar] 4s1 |
| Rubidium | Rb | 37 | [Kr] 5s1 |
| Césium | Cs | 55 | [Xe] 6s1 |
| Francium | Fr | 87 | [Rn] 7s1 |
Le groupe I ou le groupe des métaux alcalins, situé dans le bloc s, est un groupe homogène qui comprend les éléments suivants :
I-Etat naturel :
Les deux éléments alcalins les plus abondants dans la croûte terrestre sont le sodium et le potassium
En raison de leur caractère très réducteur, les métaux alcalins n’existent pas sous forme élémentaire mais seulement dans des composés minéraux ou sous forme de sels dissous dans l’eau de mer.
Les alcalins sont présents dans le nature dans de très nombreux minéraux silicatés mais à l’état trop dispersé pour que ces derniers puissent constituer en général des sources exploitables des éléments.
Le lithium fait exception.
Lithium : Il est présent en faible quantité dans presque tous les minerais ; il accompagne notamment le sodium et le potassium en petite quantité dans leurs minerais.
Son minerai le plus important est le spodumène LiAl( SiO3)2
On le retrouve également dans des composés phosphorés : Triphyline Li Fe (PO4)
Sodium :
Il est très répandu sur la terre ferme et dans les mers.
Les mers constituent un réservoir inépuisable de sodium ; elles contiennent en moyenne 3% de NaCl dissous.
Les principaux minerais et sels de sodium sont :
Le chlorure de sodium NaCl ( Sel gemme ou Halite), le feldspath Na[AlSi3O8] , le nitrate de sodium NaNO3 , la cryolithe Na3AlF6 , la sylvinite KCl-NaCl , le borax Na2B4O710H2O, le carbonate de sodium Na2CO3.
Potassium :
Beaucoup moins abondant dans l’eau de mer que le sodium( il n’ y a que 0.08% de potassium dans l’eau de mer)
Par contre, il est retenu préférentiellement par les autres sédiments et plantes terrestres.
Les sels et minéraux les plus importants sont :
La sylvine : KCl
La sylvinite : KCl- NaCl
La carnallite : KCl-MgCl2 6H2O
La kaïnite : KCl-MgSO4 3H2O
Le nitrate : salpêtre KNO3
Le feldspath de potassium : K[AlSi3O8]
Des sels de sodium et de potassium se trouvent également dans les résidus d’évaporation des mers anciennes sous forme de : sel gemme, sylvine, sylvinite, carnallite.
Rubidium et césium :
Le rubidium est aussi abondant que le nickel, le cuivre ou le zinc mais aucune espèce minéralogique ne contient du rubidium pur, c’est un sous produit de l’obtention du lithium à partir d’un alumino-silicate : la lépidolite
Le césium, beaucoup plus rare, forme un silicate, la pollucite, (Cs,Na)2(Al2Si4O12),2H2O.
Comme le Rb , Cs est un sous produit de l’obtention du lithium
Le francium :
Le 223Fr, élément radioactif, est présent dans les minerais d’uranium.
La masse totale présente dans la croûte terrestre n’atteint pas 30g
II. préparation des alcalins :
La fabrication du lithium et du sodium s’effectue, en raison de leur pouvoir réducteur, par électrolyse en milieu anhydre :
-d’un mélange fondu vers 450°C de LiCl et KCl pour le lithium
-d’un mélange fondu vers 580°C de NaCl et CaCl2 pour le sodium
Le dichlore Cl2 est obtenu comme sous-produit à l’anode.
Le mélange de chlorures permet d’abaisser la température de fusion du mélange et de diminuer notablement le coût du procédé.
Le sodium fondu, moins dense que les chlorures NaCl/CaCl2 est récupéré en surface, à l’abri de l’air.
Le potassium, le rubidium et le césium volatils s’obtiennent par réduction de leurs chlorures respectivement par Na pour le K (vers 850°C), et Ca (calcium) fondu pour le Rb et Cs (vers 750°C).
On opère sous pression réduite, par exemple pour K :
(K+ , Cl- ) (l) + Na (l) → K (g) + (Na+ , Cl- )(l) Δν (g)> 0
Il est également possible, pour de faibles quantités, de dissocier thermiquement les azotures :
2MN3 → 2M + 3N2
III -Propriétés atomistiques et physiques :
La structure électronique des éléments du groupe 1 est de type : [gaz rare ] ns1
Exemple : Li : [He] 2s1 Na : [Ne] 3s1
Tous les éléments du groupe possèdent donc dans leur couche externe, un seul électron s dans une orbitale sphérique.
Leurs ressemblances doivent conduire à un comportement chimique semblable
-Les couches électroniques immédiatement inférieures sont saturées et stables : la monovalence est donc la valence exclusive de ces éléments
-Ce sont les atomes de ce groupe qui sont les plus gros dans chaque période correspondante.
D’autre part, si on enlève l’électron externe pour former l’ion positif, celui-ci est plus petit que l’atome correspondant ; ces ions restent cependant très gros et leur volume augmente encore de Li à Fr
-Les électrons externes étant éloignés (volume élevé des atomes) leur extraction est relativement facile donc les potentiels d’ionisation sont faibles et la réactivité des métaux alcalins est grande en donnant des espèces cationiques M+ qui réagissent avec des espèces anioniques.
-Les valeurs des électronégativités dans ce groupe sont très faibles, avec pour conséquences :
Dans les composés qu’ils forment avec les autres éléments, les différences d’électronégativité des deux atomes seront probablement considérables, ce qui entraînera la formation de liaisons ioniques.
Et la chimie des métaux alcalins est surtout la chimie de leurs ions.
Une grande réactivité des métaux alcalins avec les éléments très électronégatifs.
La stabilité des sels
Le caractère fortement basique des hydroxydes (exemple : NaOH)
-Les alcalins sont des métaux solides de faible dureté
-Nette évolution du caractère métallique en allant du lithium au césium
-Ce sont de bons conducteurs d’électricité
– Les métaux alcalins sont de couleur argenté sauf le césium qui est jaune d’or
-Les points de fusion et d’ébullition sont très faibles et diminuent quand augmente la dimension.
– Tous les composés du groupe 1 sont blancs sauf si le radical acide est coloré (Exemple : chromate de potassium jaune, ou le permanganate de potassium violet)
– Les sels volatils colorent la flamme d’un bec bunsen en donnant une teinte caractéristique :
Lithium : rouge carmin 670.8nm
Sodium : jaune 589.6/589 nm
Potassium : rouge violet 769.9/766.5 nm
Rubidium : rouge foncé 794.8/780 nm
Césium : bleu violet 459.3/455.5nm
IV – Propriétés chimiques générales :
Chimiquement les métaux alcalins sont très réactifs ; leurs propriétés chimiques reposent sur leur caractère très réducteur.
Leur réactivité croît avec le numéro atomique, donc en allant de Li à Cs.
Réaction des métaux alcalins avec l’eau :
Tous les métaux alcalins décomposent l’eau avec dégagement d’hydrogène et formation d’hydroxyde ( qui sont les bases les plus fortes que l’on connaisse)
2Na +2H2O → 2 NaOH + H2
La réaction est de plus en plus violente en allant de Li à Cs
Réactions des métaux alcalins avec l’oxygène :
Les métaux alcalins forment essentiellement trois familles de composés oxygénés : oxydes , peroxydes et superoxydes.
Ils sont tous connus pour tous les alcalins
La combustion dans l’air conduit à un composé oxygéné prédominant, différent selon l’alcalin :
Le monoxyde Li2O pour le lithium
Le peroxyde Na2O2 pour le sodium
Les superoxydes KO2, RbO2 et CsO2 pour le potassium, le rubidium et le césium respectivement.
Les peroxydes et les superoxydes réagissent avec l’eau et les acides avec formation de H2O2 et O2
Les métaux alcalins et l’hydrogène :
Les métaux alcalins forment avec l’hydrogène des hydrures ioniques MH( M+ H–) , dont le plus stable est l’hydrure de lithium.
2M + H2 → 2MH
Les métaux alcalins et les halogènes :
Les réactions des alcalins avec les dihalogènes sont souvent violentes, puisqu’elles mettent en jeu des corps simples dont les éléments présentent la plus grande différence d’électronégativité
La réaction est de plus en plus violente en allant du lithium vers le césium, on obtient des halogénures alcalins stables MX ou X = halogène
Avec le carbone :
Le carbone agit à température élevée seulement sur le lithium en formant le carbure Li2C2 hydrolysable avec dégagement d’acétylène.
Solubilité et hydratation :
– Les sels alcalins sont, de façon générale, solubles dans l’eau.
La plupart des sels de lithium, de nombreux sels de sodium mais peu de sels de potassium peuvent cristalliser avec des molécules d’eau d’hydratation.
Les sels de rubidium et de césium cristallisent toujours à l’état anhydre.
L’hydratation des cations est d’autant plus aisée que le cation est plus petit.
Réaction avec l’azote :
L’azote réagit facilement avec le lithium en formant le nitrure Li3N ; les autres métaux alcalins n’agissent pas sur l’azote.
Formation de complexes :
Dans les acides organiques, les métaux alcalins remplacent l’hydrogène et forment des sels ioniques, comme l’acétate de sodium ou le benzoate de potassium.
Les ions métalliques sont trop gros pour former facilement des complexes, mais on obtient, avec des molécules organiques comme l’aldéhyde salicylique ou l’acétylacétone, des composés chélatés où le métal montre habituellement un nombre de coordination de 4 ou 6. (voir figure ci –dessous)
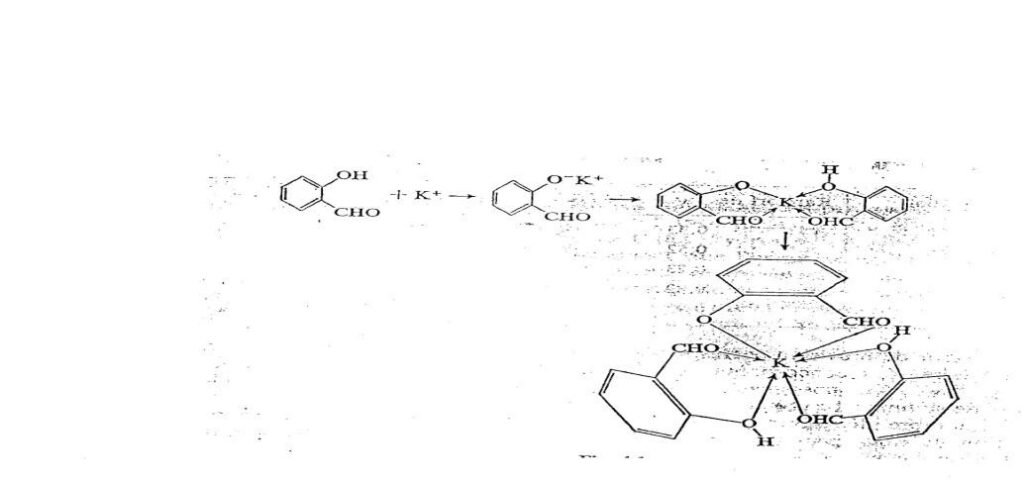
V- Relations diagonales et propriétés particulières du lithium :
Sur les diagonales qui traversent le tableau périodique se manifestent certaines ressemblances.
Moins prononcées habituellement qu’à l’intérieur d’un groupe, elles sont spécialement nettes pour les couples d’éléments suivants :
Li Be B C
Na Mg Al Si
Les types et la force des liaisons formées ainsi que les propriétés des composés se ressemblent souvent, malgré des valences différentes.
Ces ressemblances diagonales sont surtout importantes avec les éléments plus légers.
Par plusieurs aspects, les réactions du lithium ne sont pas typiques du groupe 1 mais ressemblent à celles des éléments du groupe 2, en particulier le magnésium:
Les points de fusion et d’ébullition ainsi que la dureté du lithium sont plus élevés que les autres éléments.
Li est le seul qui forme un nitrure Li3N comme le groupe 2.
Les carbonates, phosphates, fluorures de lithium sont insolubles dans l’eau comme les composés du magnésium correspondants.
L’ion Li+ et ses composés sont plus fortement hydratés que ceux du groupe 1.
Li est moins électropositif, beaucoup de ses composés sont moins stables.
VI- composés du sodium :
Les composés du sodium sont très nombreux.
On peut citer :
L’hydroxyde NaOH
L’oxyde Na2O
Le peroxyde Na2O2
Les halogénures NaCl – NaF – NaBr – NaI
Les sels oxygénés du chlore = hypochlorite NaClO
Les chlorates NaClO3
Le cyanure de sodium NaCN
Les sulfures NaHS et Na2S
Les sulfates NaHSO4 Na2SO4
Les nitrates NaNO3
Les phosphates
Le carbonate Na2CO3 et le bicarbonate NaHCO3
Les silicates Na2SiO3
1-L’hydroxyde de sodium NaOH :
L’hydroxyde de sodium NaOH, également appelé « soude caustique », est une base forte qui se présente à température ambiante sous forme de cristaux blancs translucides fortement hygroscopiques : laissé à l’air , l’hydroxyde de sodium absorbe l’eau de l’humidité atmosphérique ( hygroscopicité) et se dissout dans cette eau de solvatation ( l’hydroxyde de sodium est dit déliquescent).
Le NaOH est un composé ionique ( Na+, OH–) très soluble dans l’eau à température ambiante ; la dissolution s’accompagne d’un important dégagement de chaleur ; la solution saturée obtenue, très visqueuse et très caustique, porte le nom de lessive de soude.
Dans le commerce le NaOH est livré soit sous forme solide ( pastille , bâton cylindrique, bloc, poudre , perle ,écaille) ou sous forme aqueuse ( lessive) à différentes concentrations.
Le NaOH est une base forte qui se combine aux acides pour donner des sels en général très solubles dans l’eau exemple : NaOH + HCl → NaCl + H2O
Préparation du NaOH :
Deux méthodes sont utilisées :
Par caustification:
La soude NaOH est obtenue en traitant une solution de carbonate de sodium par un lait de chaux, la réaction suivante a lieu :
Na2CO3 + Ca(OH)2 ↔ 2 NaOH + CaCO3
On opère à ébullition, on filtre pour éliminer l’excès de chaux et le carbonate de calcium, on évapore ; la soude obtenue est impure car elle renferme une petite quantité de carbonate de sodium.
Par électrolyse du chlorure de sodium NaCl :
On effectue une électrolyse d’une saumure de NaCl , les ions Na+ et Cl– libres se dirigent respectivement vers la cathode et l’anode .
Le sodium libéré à la cathode attaque immédiatement l’eau par une réaction secondaire, il se forme de l’hydroxyde de sodium et il se dégage de l’hydrogène
Na +H2O → NaOH +1/2H2
L’ensemble peut théoriquement se formuler :
2 NaCl(s) + 2 H2O → Cl2(anode) + H2(cathode) + 2 NaOH(s)
Si on ne prend pas la précaution d’isoler le chlore de la soude il se forme de l’hypochlorite NaClO :
2 NaOH + Cl2 → NaCl + NaClO + H2O
On peut éviter cette réaction en employant un diaphragme poreux inaltérable au chlore ou des membranes.
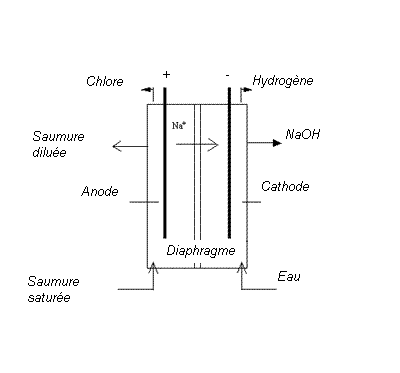
Figure 1 : Electrolyseur avec diaphragme
Dans un autre procédé on utilise une cellule à cathode de mercure comportant un électrolyseur et un décomposeur.
Dans l’électrolyseur le chlore se dégage sur l’anode en titane recouvert d’oxyde de titane et de ruthénium.
Le sodium s’amalgame à la cathode jusqu’à une concentration voisine d’environ0.5%.
Cette cathode est une nappe de mercure de quelques millimètres d’épaisseur circulant grâce à une faible pente du fond de l’électrolyseur
L’amalgame recueilli de façon continue est ensuite traité par de l’eau
L’hydrogène se dégage doucement et l’on obtient des solutions de soude très concentrées et très pures.
2(Na, xHg)l +2H2O → 2(Na+,OH–)(aq) + 2xHg + H2(g)
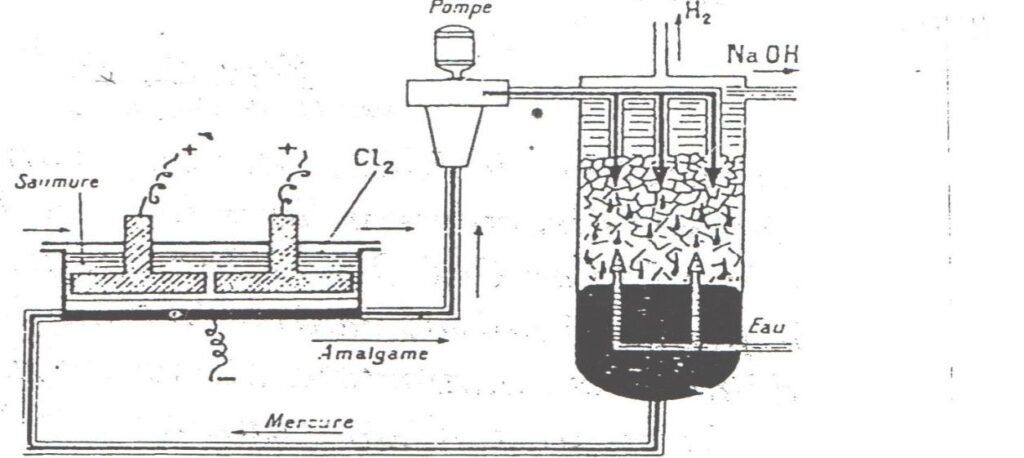
Figure 2 : Cellule à cathode de mercure
Le carbonate de sodium :
Il est peu abondant dans la nature, et on est obligé de le préparer.
C’est la « soude » du commerce.
Préparations :
L’histoire du carbonate de sodium se confond avec celle de deux noms : Leblanc en France et Solvay en Belgique.
Le carbonate de sodium est encore couramment désigné sous le terme de « soude de Solvay ».
Le procédé Leblanc :
Il met en jeu 2 étapes
Attaque acide du chlorure de sodium :
2NaCl(s) + H2SO4(aq) 500-600°C→ Na2SO4(s) + 2HCl(g)
b-le sulfate de sodium est fondu (≈1000°C) en présence de coke ( carbone) et de calcaire (CaCO3) :
Na2SO4(s) + 2C(s) → Na2S(s) + 2CO2(g)
Na2S(s) + CaCO3(s) → Na2CO3(s) + CaS(s)
Après refroidissement, le mélange est traité par l’eau : le sulfure CaS reste insoluble et le carbonate est obtenu par évaporation des eaux récupérées.
Le CaS , un polluant (odeur nauséabonde) est un résidu de fabrication sans utilisation.
2-Le procédé Solvay :
C’est le plus répandu ; il permet la préparation à partir de deux réactifs peu coûteux : le calcaire CaCO3 et le sel NaCl
La transformation que l’on désire réaliser est la suivante :
CaCO3 + 2 NaCl ⬄ Na2CO3 + CaCl2
La réaction de double décomposition est impossible à réaliser directement dans le sens désiré : le procédé Solvay réalise la transformation par une voie détournée comportant plusieurs étapes :
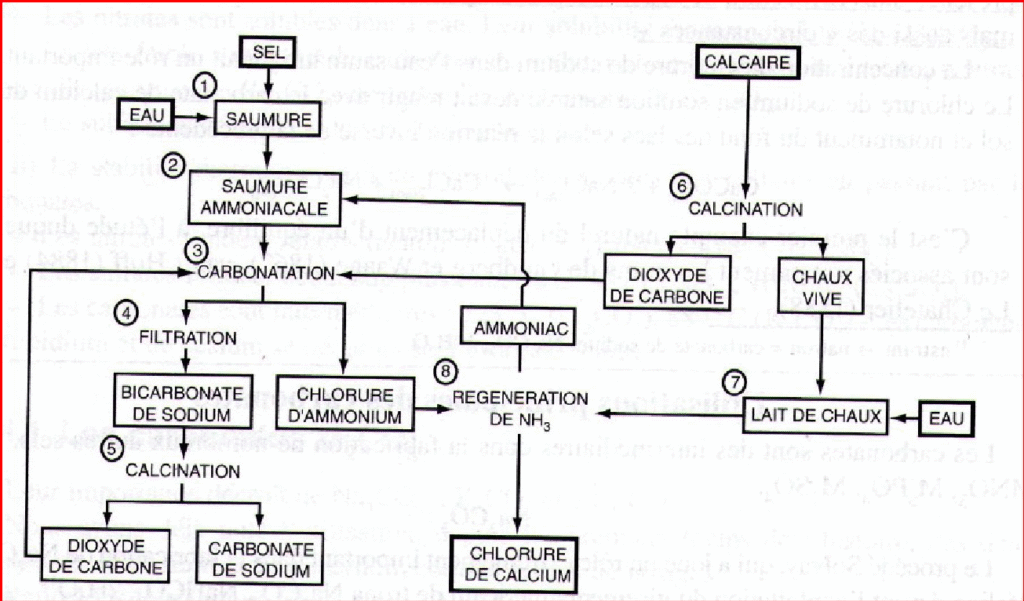
Figure 3 : Les étapes du procédé Solvay
Préparation d’une saumure de chlorure de sodium NaCl
La saumure est saturée par l’ammoniac recyclé provenant de (8) : obtention d’une saumure ammoniacale NaCl(dissous) + H2O + NH3(aq)
Carbonatation de la saumure ammoniacale par CO2 provenant de (5) et (6)
NH3(g) +CO2(g) + H2O → [(NH4)+,(HCO3)–](aq)
L’hydrogénocarbonate d’ammonium dissous formé [NH4)+,(HCO3)–] réagit dans la saumure saturée en NaCl avec précipitation de NHCO3
[(NH4)+,(HCO3)–](aq) + (Na+ , Cl–)(aq) → [(NH4)+,( Cl–)](aq) +NaHCO3(s)
Cette réaction de précipitation est l’étape essentielle du procédé Solvay
Séparation du NaHCO3 solide de la solution de chlorure d’ammonium par filtration.
Décomposition thermique de l’hydrogénocarbonate NaHCO3 (bicarbonate de sodium).
C’est l’étape de formation de Na2CO3 avec dégagement de CO2
2NaHCO3(s) 150-200°c→ Na2CO3(s) +H2O(g) + CO2(g)
Calcination du calcaire : formation de CO2 et de chaux vive CaO
CaCO3(s) 1100°c→ CaO(s) +CO2(g)
Hydratation de la chaux vive en lait de chaux.
CaO(s) +H2O(l) → Ca(OH)2 (suspension)
Régénération de NH3 par réaction entre le lait de chaux précédent et la solution de chlorure NH4Cl récupérée de l’étape (4) de filtration.
2[(NH4)+,( Cl–)](aq) +Ca(OH)2(suspension) → 2 NH3(g) + CaCl2(s) + 2H2O
VII-Usages des alcalins :
Industriels
– Le sodium est utilisé pour la préparation du peroxyde de sodium utilisé pour ses propriétés oxydantes ainsi que la préparation de certains métaux par réduction.
– Le sodium liquide est utilisé comme réfrigérant dans les réacteurs nucléaires.
– l’éclairage public fait appel à des lampes à décharge au sodium.
– Le lithium est utilisé dans les batteries et en aéronautique (sous forme d’alliage).
– Les composés du potassium sont des engrais.
– Le rubidium et surtout le césium sont employés dans les cellules photoélectriques.
-L’hydroxyde de sodium NaOH :
Utilisé en quantités considérables dans l’industrie du verre et dans beaucoup de fabrications minérales et organiques.
Utilisé comme additif alimentaire.
C’est la moins chère des bases fortes et solubles.
La saponification des esters organiques se fait avec la plus grande facilité par la soude en donnant des sels solubles :
RCOOR’ + NaOH → RCOONa +R’OH
C’est ainsi que l’on prépare les savons durs.
Les graisses, triesters de la glycérine, chauffées avec de la soude caustique, donnent le sel de sodium correspondant (savon).
On peut représenter cette fabrication par l’équation suivante : Graisse + Soude → Glycérine + savon
Il est utilisé pour le traitement de la cellulose du bois.
Dans le blanchiment de la pâte à papier.
Utilisé pour la fabrication de l’eau de Javel
–Chlorure de sodium NaCl :
Assaisonnement de l’alimentation (sel de cuisine).
Conservation de la viande, du poisson, du fromage.
Fabrication industrielle de la soude caustique, du carbonate de sodium (soude Solvay), du chlore, du chlorure d’hydrogène et de l’eau de javel.
Industrie du textile et du papier.
Sel de déneigement.
-Carbonate et hydrogénocarbonate de sodium :
Fabrication des verres.
Adoucissement des eaux.
Fabrication des détergents.
Fabrication des sels minéraux.
Usages en papeterie.
Fabrication des boissons : limonades.
Fabrication de « levures de cuisine »
Dans les extincteurs à poudre
-Chromates de potassium et bichromates de potassium : oxydants puissants, utilisés dans les allumettes, les feux d’artifice et la teinture textile.
-Le nitrate de potassium KNO3 : oxydant employé dans les allumettes, les explosifs et la conservation de la viande.
-KMnO4 : oxydant puissant utilisé au laboratoire.
-Le chlorure de potassium KCl et le nitrate de sodium NaNO3 : utilisés comme engrais chimiques.
-Le bromure de potassium KBr : dans les bains révélateurs en photographie.
-Le carbonate de potassium : dans la fabrication de savons mous
2-Médicaux :
On utilise le soluté d’hydroxyde de sodium officinal ou lessive de soude ou lessive des savonniers qui contient 400g/l de NaOH soit 30% p/p de NaOH: ce soluté entre dans la composition de la crème au stéarate de sodium.
Le chlorure de sodium NaCl qui est présent à la concentration de 9 pour 1000 dans le sérum physiologique est utilisé sous forme de solution physiologique :
* En usage externe pour le lavage (fosses nasales, yeux,..)
* Par perfusions dans les états de choc et de déshydratation.
Le chlorure de potassium KCl est utilisé pour le traitement des hypokaliémies ; le KCl est également employé comme soluté physiologique (en association avec d’autres sels comme le NaCl et le CaCl2)dans les états de choc ou pour l’étude de certains organes.
Le fluorure de sodium NaF : utilisé dans les dentifrices et comme antiseptique.
L’iodure de potassium peut être utilisé comme expectorant.
Le sulfate de sodium Na2SO4 : lavement purgatif.
Le permanganate de potassium KMnO4 : est un sel qui se présente sous forme de cristaux violets.
C’est un oxydant très caustique ; on l’utilise en solution très diluée (1 pour 2000, 4000 ou 5000) comme antiseptique en usage externe
Les sels de lithium : en psychiatrie (troubles bipolaires).
Carbonates et bicarbonates de sodium : utilisés par voie orale pour neutraliser l’acidité de l’estomac et comme excipients dans de nombreux médicaments.
