Enzymologie
Enzymologie
Introduction
Le déroulement rapide et efficace des réactions biochimiques doit se faire en présence de Biocatalyseurs.
Certaines protéines sont douées d’activité catalytique spécifique ; il s’agit des enzymes, ces dernières occupent une place importante dans le métabolisme intermédiaire en assurant le déroulement ordonné et régulé des processus physiologiques et maintenir leur homéostasie.
L’étude de la structure, des caractéristiques et de la cinétique des enzymes est indispensable pour la compréhension des activités enzymatiques.
Définitions et propriétés générales des enzymes
Définitions
Enzymes
Les enzymes sont des protéines douées d’activité catalytique spécifique : Biocatalyseurs
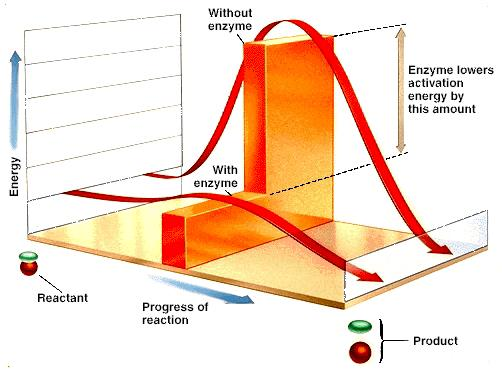
Catalyseurs : augmentent la vitesse d’une réaction en diminuant l’énergie d’activation, sans en modifier l’équilibre.
Biologiques : produits par la cellule, toutes les enzymes sont des protéines sauf les ribozymes (ARN catalytiques).
Ces enzymes interviennent dans diverses réactions de dégradation, ou de synthèse.
Substrat
Molécule qui entre dans une réaction pour y être transformée grâce à l’action catalytique d’une enzyme.
Produit
Molécule qui apparaît au cours d’une réaction catalysée par une enzyme.
Cette molécule résulte de la transformation du substrat.
Ligand
Corps chimique ayant une liaison spécifique avec une enzyme.
Pour chaque ligand, il existe au moins un site de fixation sur la protéine qui le reçoit.
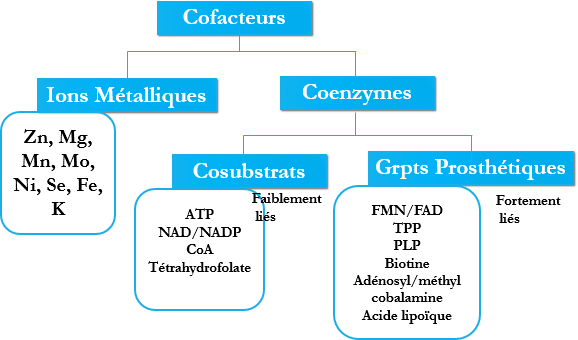
Cofacteur
Certaines enzymes sont actives par elles-mêmes, sans autres groupes fonctionnels, d’autres au contraire nécessitent la présence d’un composé non protéique appelé : Cofacteur. Ce sont des corps chimiques (non protéiques) indispensables à l’activité de certaines enzymes.
Deux types :
Ions métalliques.
Molécules organiques : coenzymes, sont de deux types :
Les cosubstrats : faiblement liés à l’enzyme.
Les groupements prosthétiques : fortement liés à l’enzyme.
De nature non protéiques
Composés organiques de faible PM
Indispensables à la catalyse enzymatique
Agissent au niveau du site catalytique
Sont Thermostables
Le terme Holoenzyme désigne le complexe enzymatique catalytiquement activé par le cofacteur
Apoenzyme : La partie protéique de l’enzyme.
Coenzyme : La partie non protéique.
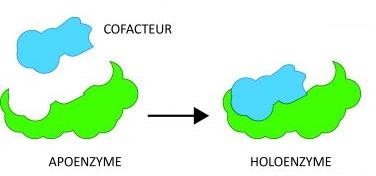
Holoenzyme
Structure des enzymes
Les enzymes sont des protéines globulaires (sauf les ribozymes = ARN et les abzymes qui sont des anticorps catalytiques) qui adoptent plusieurs degrés d’organisation :
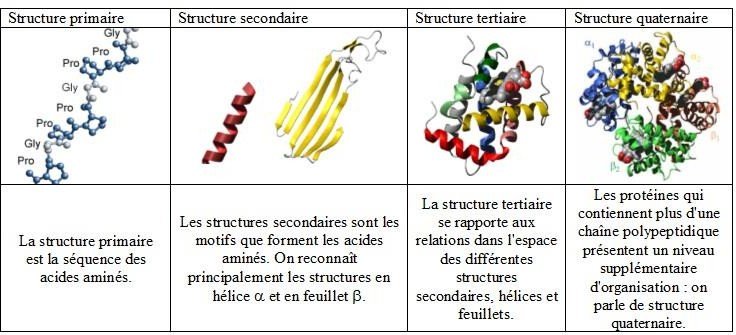
Structure primaire : se définit par la séquence en acides aminés.
Structure secondaire : la séquence en acides aminés subit des repliements pour former des motifs (hélices α et feuillet β).
Structure tertiaire : former par l’association de plusieurs motifs, donnant une forme spatiale à la protéine.
Cette organisation entraine une localisation:
Des acides aminés polaires en surface externe ;
Les acides aminés non polaires vers l’intérieur de la molécule (zone hydrophobe interne).
C’est au niveau de cette zone que se situe le site actif d’une enzyme.
Pour qu’une enzyme soit fonctionnelle, il faut qu’elle adopte une structure tertiaire.
Structure quaternaire : résulte de l’association de plusieurs chaines protéiques en un oligomère ; Cette structure est adoptée par les enzymes régulatrices.
Le site actif :
Le site actif (SA) est une zone privilégiée, qui a la forme d’une cavité, située dans la zone interne hydrophobe de la protéine, au niveau de laquelle s’exerce électivement le pouvoir catalytique de l’enzyme.
Il est subdivisé en 2 parties :
Site de liaison, fixation, et reconnaissance : Reconnait la complémentarité de forme avec un substrat spécifique de l’enzyme.
Site catalytique : Permet la réaction transformant le substrat en produit.
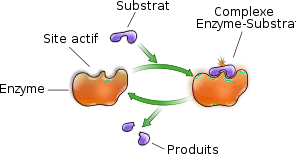
Le site actif
Le site actif comprend 3 types d’acides aminés :
Acides aminés contributeurs : Permettent à la protéine enzymatique d’adopter une conformation spatiale pour que le ligand puisse s’y adapter.
Acides aminés auxiliaires : Assurent la mobilité des zones situées au voisinage du centre actif.
Acides aminés de contact : His, Lys, Ser, Cys, Asp, Glu.
Lieu de la réaction enzymatique.
Fait intervenir des groupements particuliers de ces AA de contact, qui interagissent avec un ou plusieurs groupements particuliers du substrat.
Propriétés générales des enzymes
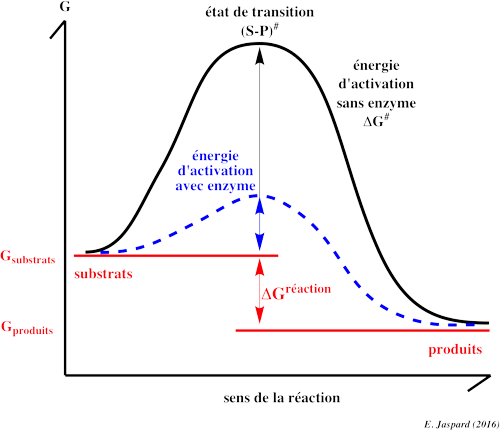
Catalyse enzymatique : C’est le processus par lequel une enzyme accélère la vitesse d’une réaction.
Les enzymes sont des catalyseurs biologiques :
Augmentent la vitesse des réactions catalysées en diminuant l’énergie d’activation.
Ne modifient pas l’état d’équilibre de la réaction catalysée mais permettent de l’atteindre plus rapidement.
Agissent à faible concentration.
Retrouvées intact à la fin de la réaction.
Permettent des interactions spécifiques, d’où la spécificité enzymatique et une régulation possible de l’activité.
Nature
Toutes les enzymes sont des protéines sauf les ribozymes, et de ce fait elles se dénaturent sous l’effet de la chaleur (Thermolabiles).
Spécificité des enzymes :
Les enzymes sont hautement spécifiques :
Spécificité d’action : l’enzyme ne catalyse, pour un substrat donné, qu’un seul type de réactions
Kinases : Ne catalysent que les réactions de phosphorylation en présence d’ATP ;
Décarboxylases : catalysent la décarboxylation des molécules contenant un groupement carboxyle.
Spécificité de substrat : l’enzyme agit sur un substrat ou une classe de substrats, on distingue :
Spécificité absolue : l’enzyme n’agit que sur un substrat unique.
Exemple : Glucokinase : ne phosphoryle que le glucose.
Spécificité large : l’enzyme agit sur plusieurs substrats d’une même classe.
Exemple : Hexokinase : phosphoryle divers hexoses, dont le glucose.
Régulation de leurs activités catalytiques :
L’activité des enzymes est contrôlée par des modulateurs :
Les activateurs : augmentent l’activité.
Les inhibiteurs la diminuent.
Ce qui permet l’ajustement de l’offre métabolique à la demande cellulaire.
Exemple : La phosphofructokinase : activée par l’AMP et inhibée par l’ATP.
Cette modulation active ou inhibe la glycolyse selon que la charge énergétique est faible ou élevée.
Variétés moléculaires :iso-enzymes
Les isoenzymes catalysent la même réaction sur le même substrat, elles diffèrent par certaines de leurs propriétés :
Physico-chimiques (pH, mobilité électrophorétique, Température) ;
Cinétique (Km, Vmax) ;
Sensibilité à certains effecteurs (activateurs, inhibiteurs) ;
Répartition dans les différents tissus de l’organisme.
La mesure de l’activité d’une iso-enzyme renseigne sur l’état du tissu dont elle est spécifique.
Cette différence est due à des variations au niveau de leurs structures primaires
Exemple : Lactate déshydrogénase(LDH)
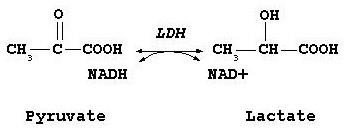
Réaction catalysée par la LDH
Tétramère : 2 protomères différents ; H (muscle cardiaque) et M (muscle squelettique et foie).
L’association de protomères conduit à 5 iso-enzymes différents :
LDH1 (H4): Cœur.
LDH2 (H3M1): érythrocytes.
LDH3 (H2M2): Leucocytes, rate, et ganglions.
LDH4 (H1M3): muscle utérin, poumon.
LDH5 (M4): Foie.
Nomenclature et classification des enzymes
La commission des enzymes et l’union internationale en biochimie biologie moléculaire (IUBMB) a établi une classification et une nomenclature systémique, comportant :
6 classes
Chacune subdivisée en sous classe
Oxydoréductase : assure une oxydoréduction
Transférase : assure un simple transfert
Hydrolase : assure une hydrolyse
Lyase : assure une addition sur une double liaison
Isomérase : assure une réaction d’inter conversion d’isomères
Ligase ou synthétase : catalyse les réactions de création de liaisons (C-C/ C-N / C-S)
La nomenclature officielle
A chaque enzyme est attribué un numéro à 4 chiffres par la commission des enzymes (EC) (EC W.X.Y.Z).
Le numéro de code spécifie :
1er chiffre : Classe
2ème chiffre : sous classe de l’enzyme
3ème chiffre : sous sous classe de l’enzyme
4ème chiffre : groupe
La nomenclature systématique
Ce nom précise la nature du donneur, la nature de l’accepteur et le type de réaction catalysée.
Le nom commun recommandé
C’est l’appellation consacré pour l’usage, désigné souvent sous forme d’abréviation.
Ex : Glucokinase (GK), Lactate déshydrogénase (LDH), Aspartate aminotransférase (ASAT)
Exemple d’enzyme : Glucokinase « GK » :
La nomenclature officielle EC : EC. 2.7.1.2
2 : transférase ;
7 : le groupement transféré est un phosphore ;
1 : l’accepteur est un groupement alcool (du glucose) ;
2 : le numéro d’ordre de la GK.
La nomenclature systématique : l’ATP, D-glucose 6-phosphotransférase.
Le nom commun : la Glucokinase (GK).
Mécanismes d’action entre l’enzyme et le substrat
Les interactions entre enzymes et substrat font intervenir des liaisons non covalentes :
Liaisons hydrogènes
Liaisons de Van der waals
La réaction enzymatique fait appel à la fixation du substrat au niveau du site actif, ce dernier doit être dans une conformation spatiale de telle sorte que le substrat puisse s’y fixer, il existe différents modèles :
Modèle de Fisher (1980) : Clé-serrure
Dans ce modèle, la formation du complexe enzyme-substrat (ES) nécessite une interaction entre un ou plusieurs groupes fonctionnels ou domaines du substrat avec des motifs de la cavité enzymatique.
Ce modèle explique la spécificité de l’enzyme pour son substrat, mais il n’explique pas l’effet des effecteurs.
Modèle de Fisher
Modèle de Koshland (1985) : Ajustement induit
L’association enzyme-substrat (ES) est permise après une modification de la conformation de l’enzyme induite par l’entrée partielle du substrat.
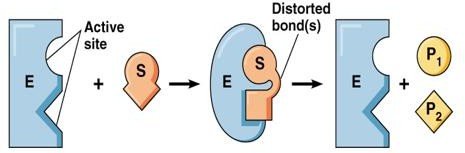
Modèle de Koshland
Mécanismes de la catalyse enzymatique
La Catalyse enzymatique est le processus par lequel une enzyme accélère la vitesse d’une réaction.
Trois types :
| Catalyse générale acide- base | Catalyse impliquant les ions métalliques | Catalyse covalente |
| Implique le transfert de protons entre chaînes latérales et le substrat;Mode de catalyse le plus fréquemment rencontré | Plusieurs enzymes utilisent les ions métalliques lors de la catalyse (Mg+2, Mn+2, Zn+2, Fe+2, Cu+2);L’ion métallique peut agir de diverses façons:Orientation du substrat par rapport à l’enzyme;Participation au transfert de protons/électrons; | Implique la formation d’une liaison covalente entre l’enzyme et le substrat; |
La cinétique enzymatique
Définition
C’est l’étude de la vitesse maximale d’une réaction catalysée par une enzyme et ses modifications en réponse aux changements des conditions environnementales (des conditions expérimentales).
Les intervenants d’une réaction enzymatique :
Les différentes phases de la réaction enzymatique
Soit la réaction:
E + S ES E + P
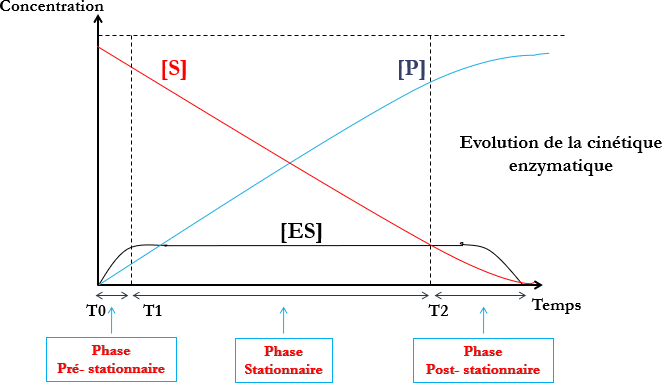
| Pré-stationnaire | Stationnaire | Post-stationnaire |
| Enzyme mise en présence d’excés de substrat.Combinaison ES très rapide. | Enzyme saturée par le substrat.Combinaison ES est à concentration maximaleVitesse de la réaction est constante :Vitesse initiale(Reste constante tant que le substrat est à concentration saturante de l’enzyme) | Diminution de S de manière significative au bout d’un temps plus au moins long selon l’enzyme. |
Les différentes phases de la réaction enzymatique
Notion d’ordre :
Décrit les variations de la vitesse en fonction de la concentration des réactants
Forte concentration de S : La vitesse de la réaction est indépendante de la concentration en substrat : Réaction d’ordre 0.
Faible concentration de S : La vitesse de la réaction est proportionnelle à la concentration en substrat : Réaction d’ordre 1
→ Travailler en concentration saturante en substrat.
La vitesse de la réaction enzymatique
S’exprime par :
La quantité de substrat transformé (dS) par unité de temps (dt)
V= – dS / dt
Ou la quantité de produit (dP) formé par unité de temps (dt)
V= dP / dt
(Dans les conditions optimales).

Variation de la concentration en produit en fonction du Temps
Notion de Vitesse initiale :
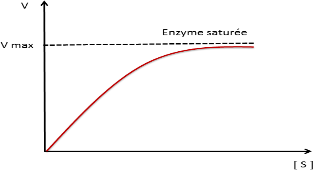
En catalyse enzymatique la vitesse initiale croit avec la concentration initiale de S jusqu’à Vmax (saturation de l’enzyme par S)
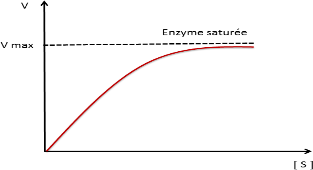
Courbe de saturation
La vitesse initiale est la vitesse tout au début de la réaction ;
La phase initiale (pré-stationnaire) est très brève=> vitesse initiale est la vitesse à la phase stationnaire ou l’enzyme est saturée par son substrat
La vitesse étudiée est toujours la vitesse initiale.
Influence de la concentration de l’enzyme sur la vitesse initiale
Il est indispensable d’étudier la vitesse initiale de réaction dans les conditions ou la : [S] ˃ [E]
Si le temps de la réaction est très court, la modification de [S] est négligeable, et [S] peut être considéré comme constante.
Lorsque la concentration de l’enzyme augmente → la vitesse initiale augmente aussi

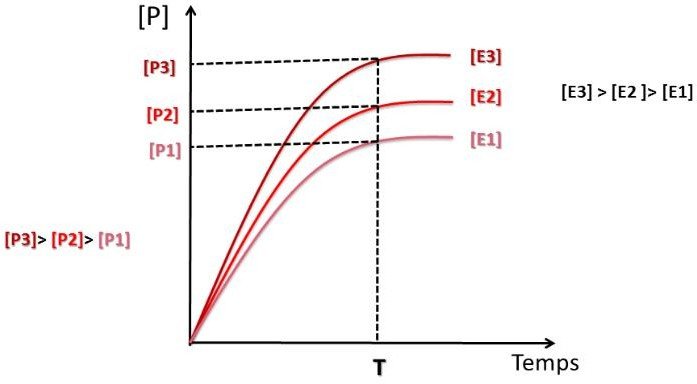
Influence de la concentration de l’enzyme sur la vitesse initiale
Influence de la concentration du substrat sur la vitesse initiale
Lorsque la concentration du substrat augmente → la vitesse initiale augmente aussi.
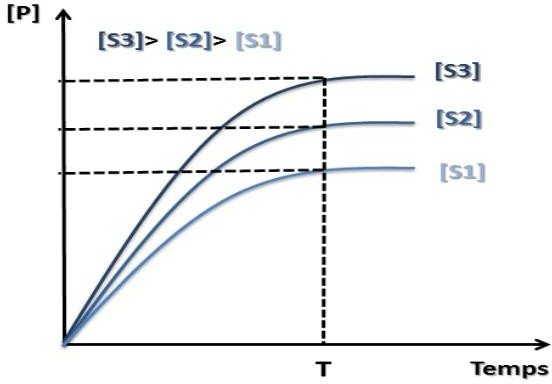
Influence de la concentration du substrat sur la vitesse initiale
Conclusion :
[S] est saturante : L’enzyme est en pleine activité et tous les sites actifs sont saturés.
En pratique : Détermination d’une activité enzymatique lorsque [S] est saturante (en excès)
Hypothèse de Michaelis-Menten
Cinétique enzymatique à un substrat :
Soit la réaction suivante :
(K1,K2 et K3 = constantes de vitesse )
K1
E + S
ES
K3
E + P
K2
Formation du complexe ES :
V1
E + S
ES
V2
(Etape rapide et réversible)
Dissociation du complexe ES:
V3
ES
E + P
Disparition de S.
Apparition de P.
Régénération de E.
La constante de Michaelis Menten :
D’après la loi d’action de masse : V1 = k1 [E][S] ……. (1)
V2 = k2 [ES] (2)
La vitesse d’apparition des produits : dP/d t = V3 = k3 [ES] (3)
La vitesse de disparition du substrat est égale à la vitesse d’apparition du produit : – dS/dt = dP/dt (4)
La vitesse de disparition du substrat : – dS/dt = V1-V2 (5)
Donc
V1-V2 = V3
Et selon (1),(2),(3),(4) et (5): k1 [E][S]= (k2 + k3 )[ES]
k2 + k3
K1
[E] [S]
[ES]
Km
Km: constante de dissociation du complexe ES = constante de Michaelis
La valeur de Km est d’autant plus élevée que la dissociation du complexe ES est forte et donc que l’affinité de l’enzyme pour son substrat est faible.
L’équation de Michaelis Menten :
[Et]: Concentration de l’enzyme présente dans le système
=[Et]-[ES]
Km = [E][S] = ([Et]-[ES]) [S] [ES] [ES]
Km+ [S]= [Et] [S] [ES]= [Et] [S]
[ES] Km+ [S]
V= vitesse de la réaction enzymatique = V3 V= V3= k3 [ES]
V = k3. [Et] .[S]
Km+ [S]
La vitesse de la réaction dépend de la :
Concentration en enzyme totale
Concentration en substrat
De la constante de Michaelis
La vitesse est maximale lorsque [ES] sera la plus grande possible : Lorsque la totalité de l’enzyme sera combiné au substrat.
[Et] =[ES] → Vm = k3 .[Et]

Signification de la vitesse maximale Vmax et de la constante de Michaelis –Menten Km
Vmax :
Correspond à la vitesse initiale quand l’enzyme est saturée par son substrat ;
Renseigne sur l’efficacité catalytique de l’enzyme Vmax = k3 [Et] → Vmax = kcat[Et]
kcat : Turn Over Number « TNO », nombre de molécules de substrat transformé en produit par unité de temps, c’est l’efficacité catalytique de l’enzyme : la fréquence de l’activité catalytique (s-1 ).
Km :
Affinité de l’enzyme pour le substrat, Km est d’autant plus élevé que l’affinité de l’enzyme pour le substrat est plus faible (inversement proportionnelle à l’affinité).
Correspond à la concentration initiale de substrat pour laquelle Vi= Vmax/2.
Quand [S] >>> Km → Vi= Vmax = kcat[Et]
Quand [S] <<< Km → Vi= (kcat/Km) [Et].[S]
kcat/ Km : constante de spécificité liée au substrat, permet de déterminer le meilleur substrat pour une enzyme.
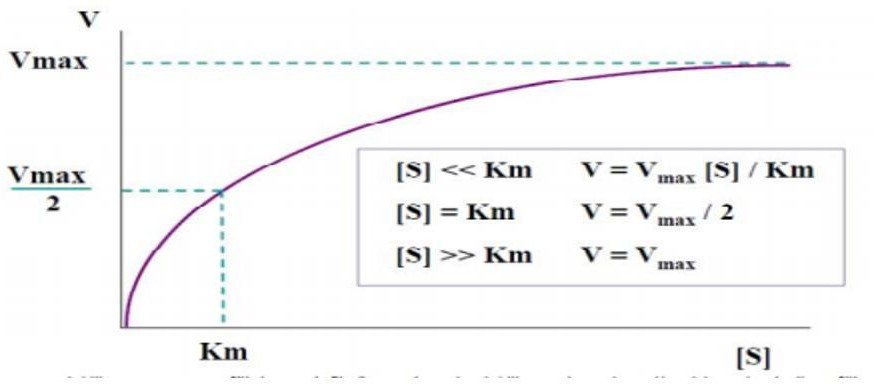
Hyperbole de Michaelis
Détermination de la constante de Michaelis :
Méthode arithmétique:
V = Vmax/2 → Km = [S]
Méthode graphique de Line Weaver et Burk :
C’est la transformation algébrique de l’équation de Michaelis Menten (double inverse).
On obtient une courbe linéaire : y = ax +b au lieu d’une hyperbole.
Elle permet de mesurer plus facilement les constantes cinétiques (Vmax , Km )
Où : a = Km/Vmax, b = 1/ Vmax
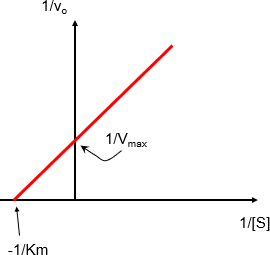
Représentation en double inverse de Line weaver et Burk
Méthode graphique d’Eadie Hofstee:

Représentation en double inverse d’Eadie Hofstee
Définition des unités enzymatiques
Unités enzymatiques
C’est la quantité d’enzyme qui catalyse la transformation d’une certaine quantité de substrat par unité de temps
L’unité internationale « UI »
C’est la quantité d’enzyme qui catalyse la transformation d’une micromole de substrat par minute
dans les conditions optimales de mesure
UI = µ mol/min
Le katal « kat » : la quantité d’enzyme qui catalyse la transformation d’une mole de substrat par
seconde.
Kat = mol/sec
L’activité enzymatique spécifique : Nombre de molécules de substrat transformées par min et par
milligramme de protéine enzymatique
µ mol/min
mg de protéine
UI
mg de protéine
Mesure le degré de pureté d’une préparation enzymatique
Activité spécifique moléculaire : Nombre de molécules de substrat transformées par min et par
molécule d’enzyme
µ mol/min UI µ mol de protéine µ mol de protéine
Détermination de l’activité enzymatique
La détermination la plus utilisée est la mesure cinétique : en mesurant la disparition du substrat ou l’apparition du produit en fonction du temps.
Cette mesure est possible par la mesure de la variation d’absorbance ΔDO.
L’absorbance est donnée par la loi de Beer-Lambert :
Do= ε .
C. l C= Do. 1/ ε .1/l
Activité enzymatique en UI/l =(Δ Do/ Δt) . (1/ ε) .( 1/l) .( Vt/Ve) .10 6
Δt : temps de mesure en min
ε : coefficient d’absorption molaire (mol-1.l.cm-1)
l : trajet optique = 1 cm
Vt : volume du mélange réactionnel total où se fait la mesure
Ve : volume du milieu contenant l’enzyme à doser
Les facteurs influençant la réaction enzymatique
Influence des agents physiques
Influence de la température
2 effets sur la réaction enzymatique :
Elle accélère la réaction en fournissant l’énergie nécessaire au franchissement de la barrière due à l’énergie d’activation.
Une température élevée fragilise les liaisons et rend la structure tertiaire instable, avec dénaturation.
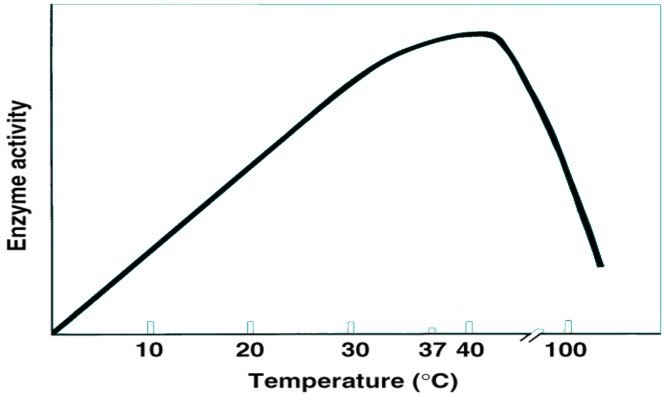
L’activité enzymatique augmente jusqu’à une température optimale puis diminue pour atteindre une activité nulle à de grandes températures.
A la température optimale l’activité enzymatique est la plus importante.
Cette température optimale varie d’une enzyme à un autre.
Influence de la température sur l’activité enzymatique
Influence du pH
Le pH joue sur l’ionisation des molécules → Modification de la conformation de l’enzyme et du substrat.
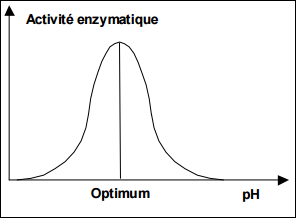
Aux valeurs extrêmes : dénaturation de la protéine enzymatique.
Aux valeurs intermédiaires : modification de la conformation du site actif et celle de substrat.
pH optimum : activité enzymatique est optimale.
Influence du pH sur l’activité enzymatique
Force ionique :
La présence d’ions dans le milieu réactionnel joue un rôle important :
Certaines enzymes nécessitent des activateurs (ions métallique).
Solubilité maximale pour une concentration faible en sels neutres.
Effet des radiations :
Les émissions radioactives α, β, γ, rayons X, et les neutrons peuvent directement ou indirectement entrainer l’inactivation des enzymes :
Effet Direct : Ionisation des molécules.
Effet Indirect :
Ionisation du milieu réactionnel.
Formation de radicaux libres qui attaquent les enzymes.
Influence des agents chimiques Un effecteur :
Est tout corps chimique, minéral ou organique capable de modifier la cinétique des réactions enzymatiques.
Il peut être soit activateur ou inhibiteur.
Activateurs enzymatiques :
Est tout agent chimique, qui par sa liaison avec l’enzyme accélère la vitesse de la réaction enzymatique.
Ions métalliques :
Se fixent par coordinance à des atomes d’oxygène des groupements COOH, et d’azote des groupements NH2 des enzymes
Ils confèrent une grande stabilité dans le site actif de l’enzyme
L’ion métallique favorise :
Une bonne conformation de l’enzyme
La fixation du substrat
Participe de manière directe à la catalyse
Exemple : Kinases activées par Mg +2
Activation des pro-enzymes inactifs :
La plupart des enzymes protéolytiques sont synthétisés sous forme de précurseurs inactifs, L’élimination d’une séquence d’acides aminés par clivage spécifique le rend actif (permettant l’apparition du site actif).
Trypsinogène Trypsine + Hexapeptide.
Activation par fixation covalente d’un groupement chimique :
L’enzyme peut exister entre deux formes interconvertibles, l’une active et l’autre non-active, par addition d’un groupement chimique le plus souvent le phosphate.
Exemple : phosphorylation et déphosphorylation.
Phosphorylase b inactive hosphorylase a active

Phosphorylation d’un résidu séryl par une kinase:
Phosphorylase b kinase
Les inhibiteurs enzymatiques :
Est tout effecteur, qui par sa liaison avec l’enzyme ralentit la vitesse de la réaction enzymatique
Intérêt :
Mécanisme essentiel de contrôle des systèmes biologiques.
Source d’information sur le mécanisme d’action des enzymes.
Les inhibiteurs irréversibles :
Se lient de façon irréversible avec l’enzyme
Agissent brutalement en dénaturant l’enzyme
Exemple : 5Fluoro-uracile utilisé en chimiothérapie anti-cancéreuse
Inhibe la thymidilate synthase ; enzyme qui intervient dans la synthèse de la thymine (ADN) → Arrêt de la multiplication des cellules tumorales
Les inhibiteurs réversibles :
Perturbent la cinétique et peuvent stopper la réaction
L’inhibition peut être levée dans des conditions réactionnelles particulières
Ont un grand intérêt puisqu’ils permettent une étude très fine des mécanismes moléculaire de la catalyse.
Les inhibiteurs compétitifs :
Comportent une analogie structurale avec le substrat
Entre en compétition avec les molécules de substrat pour se lier au site actif
Se lie de façon réversible
Diminuent la vitesse de catalyse en abaissant la proportion de molécules d’enzyme liées au substrat
A concentration élevée en substrat, le substrat entre en compétition avec les molécules inhibitrices pour se lier au site actif, et les déplacés des centres catalytiques



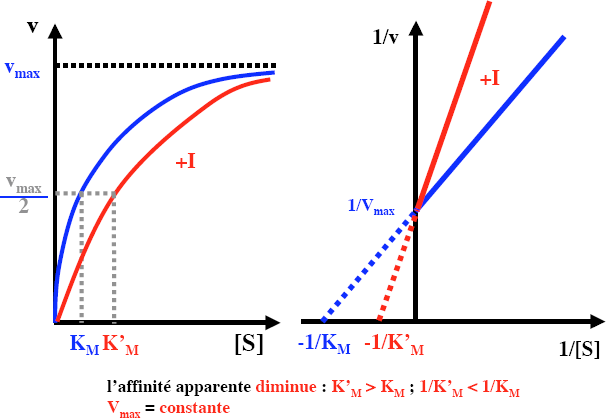
V max inchangée Km est augmentée
Exemple : l’acide malonique, analogue de l’acide succinique est un inhibiteur compétitif de la succinate déshydrogénase.
Les inhibiteurs non compétitifs :
Se lient de façon réversible à un site autre que le site actif.
Il provoque une modification de la conformation de l’enzyme.
L’enzyme peut se lier :
l’inhibiteur ;
au substrat ;
à l’inhibiteur et au substrat à la fois.
L’enzyme est inactivée quand l’inhibiteur est lié, en présence ou non du substrat.
L’effet de l’inhibiteur n’est pas inversé par l’augmentation de la concentration en substrat.
a. L’inhibiteur diminue la concentration de l’enzyme active.
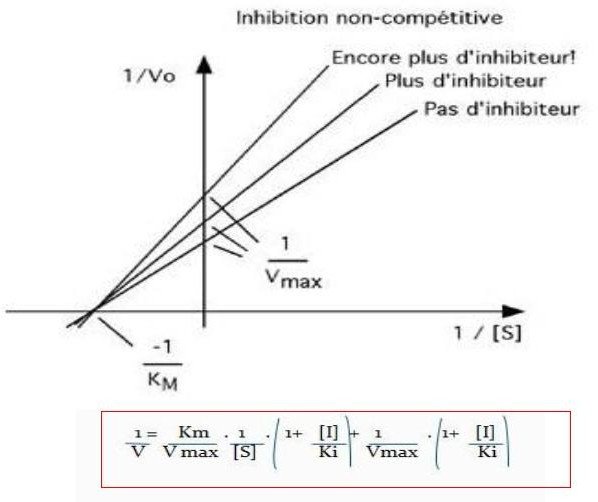
V max diminuée Km est inchangée
Exemple : l’acétazolamide est un inhibiteur non compétitif de l’anhydrase carbonique.
Les inhibiteurs incompétitifs :
L’inhibiteur ne se lie pas à l’enzyme libre, mais uniquement au complexe ES
Pente non modifiée Vmax diminue
Km diminu
Exemple : Le lithium est un inhibiteur incompétitif de l’inositol monophosphatase.
Cinétique enzymatique à deux substrats :
L’étude des mécanismes à 2 substrats, se fait par la généralisation des notions établies pour les réactions à 1 substrat.
Les enzymes adoptant ce model cinétique catalysent généralement un transfert de groupement G
GX + Y Enzyme X+ GY
GX : 1er substrat – X: 1er produit
Y: 2e substrat – GY : 2e produit
Cette cinétique à 2 substrats implique différents mécanismes, qui peuvent être:
Séquentiels :
Ordonnés
Aléatoires
Ping pong
Mécanisme séquentiel (à complexe ternaire/ à transfert simple)
Appellation due à la formation d’un complexe ternaire : [Enzyme-1er Substrat -2ème Substrat] (E-GX-Y)
La réaction est dite à transfert simple, car le groupement passe du substrat donneur (GX) au substrat accepteur (Y).
Dans ces réactions tous les substrats doivent se fixer sur l’enzyme, avant qu’aucun produit ne soit libéré.
Selon l’existence d’un ordre précis de fixation des substrats, ou de libération des produits, on distingue 2 mécanismes :
Bi-Bi aléatoire
Bi-Bi ordonné
Réaction type Bi-Bi aléatoire
Aucun ordre n’est observé dans ce type de mécanisme, la fixation des substrats se fera aléatoirement, il en est de même pour la libération des produits.
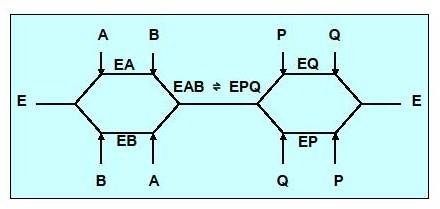
Cinétique à 2 substrats ,mécanisme BiBi aléatoire
Exemple de mécanisme Bi Bi aléatoire :
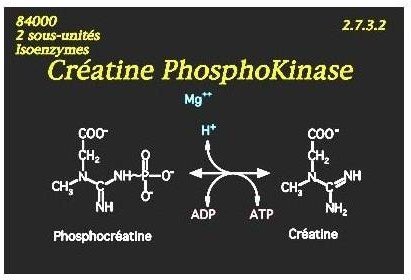
La CPK catalyse le transfert d’un radical phosphoryl du substrat: phospho-créatine, vers l’ ADP (co-enzyme transporteur)
L’affinité de l’enzyme pour ces 2 substrats étant voisine
Réaction type Bi-Bi ordonné
Il y a fixation du Substrat A en premier, puis B se fixe secondairement, donnant naissance au complexe EAB
La suite de la réaction conduit à la libération d’un premier produit P et ensuite du second produit Q.
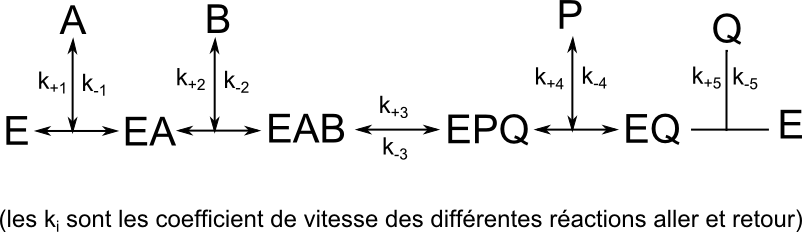
Cinétique à 2 substrats, mécanisme BiBi ordonné
Exemple de mécanisme Bi Bi ordonné

L’enzyme n’a pas d’affinité pour le malate, si elle n’est pas préalablement associée au NAD+ (co-enzyme )
Réaction type Ping-pong (à complexe binaire)
Un ou plusieurs produits sont libérés par l’enzyme, avant que tous les substrats ne soient fixés.
Il y a formation d’un complexe binaire
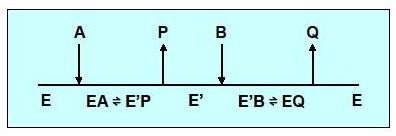
Cinétique à 2 substrats ,mécanisme Ping-pong
Exemple de mécanisme Ping-pong
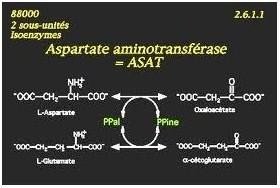
Fixation du 1er Substrat: L-Aspartate.
Départ du (–NH2 )et sa fixation du PLP (co-enzyme)qui se transforme en phosphate de pyridoxamine
Libération du 1er Produit: Oxalo-acétate
Fixation du 2emesubstrat: α cétoglutarate .
Transfert du groupement (–NH2) du phosphate de pyridoxamine vers l’α-cétoglurate
Libération du 2eme produit: L-glutamate
Enzymes allostériques
Définitions
Allostérie :
Propriété de certaines protéines actives, qui peuvent changer de conformation, lorsqu’elles se lient à un effecteur allostérique en un site différent du site actif.
Cette liaison se traduit par une modification de l’activité.
Régulation allostérique :
Mécanisme de modulation de l’activité de certaines enzymes, employé par la cellule pour contrôler le flux global d’une voie métabolique.
Les enzymes allostériques sont formées par plusieurs sous unités appelées : Protomères Ils contiennent :
Plusieurs sites actifs identiques ;
Plusieurs sites allostériques identiques.
Cette régulation est définie par :
L’effet allostérique :
Dans un système multi-enzymatique, l’enzyme clé (catalysant l’étape d’engagement d’une voie métabolique) est inhibé par le produit final de cette voie : Rétro-contrôle.
Les effets allostériques sont les interactions indirectes entre sites de fixation distincts.
Les effecteurs allostériques :
Sont des ligands dont le site de fixation est différent du site de fixation du substrat.
Si le ligand est la molécule de substrat : Effet allostérique homotrope.
Si le ligand est une molécule différente : Effet allostérique hétérotrope.
La transition allostérique :
Enzyme allostérique : structure protéique avec au moins 2 sites fonctionnels
Site actif : Substrat
Site allostérique : Effecteur allostérique
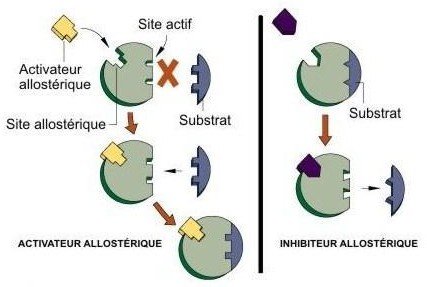
Site actif et site allostérique
La combinaison de l’effecteur allostérique entraine une modification structurale discrète réversible au niveau de l’enzyme : Transition allostérique → Modification de la conformation du site actif → Modification de l’activité de l’enzyme.
La transition allostérique modifie les forces de liaisons qui associent les sous unités entre elles, mais sans aller jusqu’à leur dissociation.
La molécule apparait soit dans un état Tendu ou relâché, qui diffère par leur affinité au substrat :
T : Faible affinité pour S
R : Forte affinité pour S
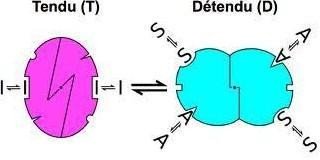
La transition allostérique
La coopérativité
L’enzyme allostérique contient :
Plusieurs sites actifs identiques
Plusieurs sites allostériques identiques
Ces sites n’agissent pas de façon indépendante l’un par rapport à l’autre, mais au contraire ils montrent une coopérativité.
La coopérativité traduit que la fixation sur l’enzyme d’un effecteur allostérique, influe sur la fixation du substrat.
Cinétique des enzymes allostériques :
– Cinétique selon une représentation de Hill
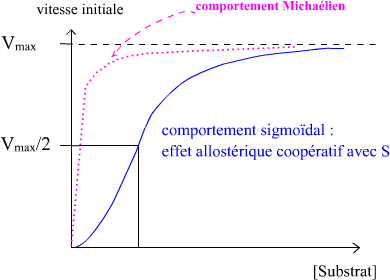

Présentation de Hill
Deux modèles sont décrits :
Modèle symétrique :
Toutes les enzymes sont soit en conformation T (absence du substrat), soit en conformation R (en présence du substrat)
Chaque molécule de substrat qui se lie augmente la probabilité de transition de la forme inactive à la forme active
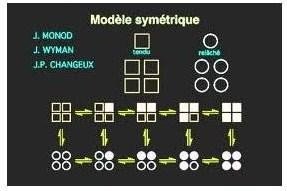
Modèle symétrique des enzymes allostériques
Modèle séquentiel :
Il y a 2 conformations, mais les sous unités passent de la forme inactive à la forme active individuellement
La fixation de la molécule de substrat, induit la transition de la première s/u, ce qui facilite la transition de la s/u voisine et ainsi de suite.
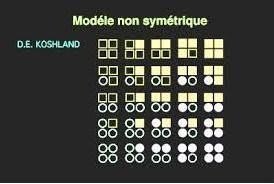
Modèle séquentiel des enzymes allostériques
Application de l’enzymologie
Application diagnostique-Pronostique :
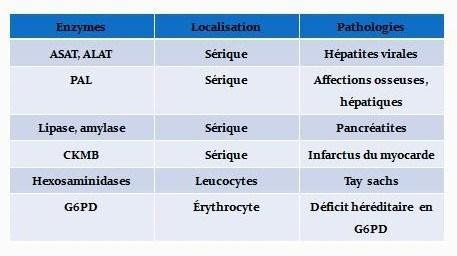
Application industrielle :
Evaluer la qualité des aliments.
Vérification des processus de stérilisation et de pasteurisation.
Synthèse d’hormones, et de médicaments.
Application thérapeutique :
Utilisation des anti-métabolites en chimiothérapie anticancéreuse (5 FU)
Application en génétique :
Utilisation des enzymes pour les réactions d’amplification in vitro.
Utilisation des enzymes de restriction pour le diagnostic de certaines maladies génétiques.

