Devenir du médicament dans l’organisme
Métabolisme et Excrétion
Année universitaire 2020-2021
ntroduction
Le terme biotransformation désigne les diverses modifications chimiques que subissent les médicaments dans l’organisme pour donner naissance à des métabolites
Se rencontre dans de nombreux tissus comme le foie, les reins, les intestins, les poumons, les glandes surrénales, la peau et le plasma.
Font intervenir des systèmes enzymatique.
Un médicament peut subir plusieurs biotransformations aboutissant à la formation de plusieurs métabolites.
Diminuent la liposolubilité et augmentent la polarité des substances métabolisées, dans le but de faciliter leur excrétion hors de l’organisme (urines, bile..)
les métabolites formés:
-des structures chimiques différentes;
-sont moins lipophiles et moins facilement résorbés au niveau de la membrane plasmique;
Formation d’un métabolite inactif à partir d’une substance initialement active
Phénobarbital
P-hydroxyphénobarbital
Formation d’un métabolite actif à partir d’une substance initialement active
Imipramine démethylimipramine Carbamazépine Epoxycarbamazépine
Formation d’un métabolite actif à partir d’une substance initialement inactive
Cyclophosphamide 4-hydroxy-cyclophosphamide
Spironolactone Canrénone
le métabolisme de certains médicaments donne naissance à des dérivés toxiques qu’on appelle métabolites réactifs.
Le N-acétyl-p-benzo-quinone-imine, métabolite toxique du paracétamol, est responsable de l’hépatite cytotoxique.
principaux lieux de biotransformation

cerveau
poumon
foie +++
rein tube digestif
sang
le foie organe épurateur
le flux sanguin très important par rapport aux autres organes
Les hépatocytes contiennent un grand nombre d’enzymes impliquées dans la transformation des médicaments (1,5 litres de sang par minute (1,2 l par la veine porte et 0,3 l par l’artère hépatique)
II-Principaux types de réactions
Phase I: réactions de fonctionnalisation
Modifient la structure primaire de la drogue,
Donne naissance à des métabolites actifs, inactifs ou toxiques.
Les métabolites formés par les réactions de phase I ont des groupes fonctionnels hydroxyles (OH), amines (NH2) ou carboxyles (COOH) qui peuvent ensuite être conjugués par les réactions de phases II.
Les réactions de phase I sont des réactions de :
− Réduction :
Moins fréquentes et peu explorées.
Au niveau du foie et l’intestin ( la flore bactérienne)
− Hydrolyse :
Réaction très rapide, souvent non spécifiques,
Ont lieu au niveau des organes (rein, foie, intestin, poumon..) mais aussi au niveau du plasma.
Les principales cibles sont des esters ou des amides.
− oxydation :
Elles ont essentiellement lieu au niveau des microsomes hépatiques.
Différents systèmes enzymatiques sont impliqués au centre de ce dispositif:
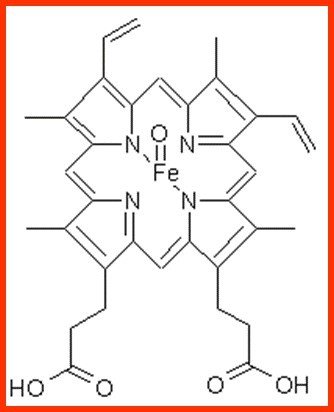
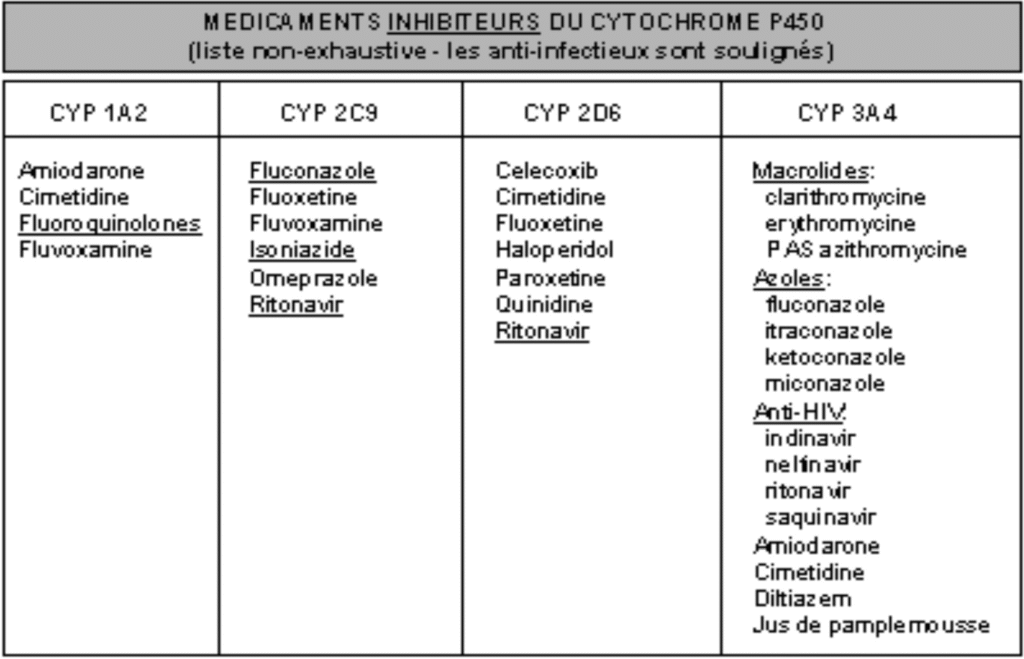
Cytochrome P 450
Superfamille de mono-oxydase; ce sont des protéines à noyau hème qui catalysent des réactions d’oxydation nécessitant de l’oxygène et du NAPDH.

Un CYP n’est pas spécifique d’un substrat: un CYP métabolise plusieurs substrats différents et un substrat peut être métabolisé par plusieurs CYP.
Il y a actuellement 14 familles, divisées elles mêmes en sous- familles

Isoenzymes les plus impliqués dans le métabolisme des médicaments :
– CYP 3A4, CYP 2D6, CYP 2C9, 2C19 et CYP 1A2
Rôle des cytochromes P450:
Biotransformation de substrats endogènes.
cholestérol
vitamines
hormones stéroïdiennes
acides biliaires
– …
Biotransformation de xénobiotiques.
La majorité des médicaments a un métabolisme cytochromedépendant!
| Réactions | Enzymes | Médicaments |
| OxydationC et N- hydroxylationN et S- oxydationDéalkylationDéamination | Cytochrome P-450 | Phénytoine Barbituriques Chlordiazépoxide Antihistaminiques |
| 1) Nitro-réduction | Flavoprotéine | Chloramphénicol |
| 1) Hydrolyse | Estérase | Procaine |
| Amidase | Indométacine | |
| Lipase | Erythromycine / Acide gras |
Phase II: Ajout de groupements – conjugaison
Les réactions de conjugaison résultent d’un transfert de groupements polaires sur la molécule
Les groupes transférés sont activés par des coenzymes dont les enzymes correspondantes sont appelées « transférases »
Ce sont des réactions de conjugaison avec des acides organiques qui aboutissent à des métabolites inactifs hydrosolubles facilement éliminées par les urines ou la bile.
15
| Réactions | Enzymes | Substrats | Médicaments |
| GlucuronoconjugaisonSulfoconjugaisonGlycylconjugaisonConjugaison acide mercapturique | Glucuronyl transférase | Acide glucuronique | Aspirine |
| Sulfokinase | Acide sulfonique | Isoprenaline | |
| Transacylase | Glycocolle | Salicylate | |
| Glutathion transférase | Glutathion | Paracétamol | |
| Methylation | Catéchol-o-méthyl transférase | Groupement méthyle | Isoprénaline |
| Acétylation | N-acétyltransférase | Acide acétique | Isoniazide |
III-Facteurs modifiant la biotransformation des médicaments
Age :
Pour le NN, vitesse de réaction de phase I plus lentes.
Personnes âgées, diminution de l’ensemble des capacités du foie.
Sexe : diminution de l’oxydation des œstrogènes et benzodiazépines chez les femmes par rapport aux hommes.
Polymorphismes génétiques:
L’activité de certaines voies métaboliques est contrôlée génétiquement.
Présence au sein d’une population d’au moins 2 variants d’une même d’enzyme 2 populations: Métaboliseurs lents et Métaboliseurs rapides:
Environ 8% de la population manifeste une faible activité d’hydroxylation et montrent une réponse exacerbée et prolongée aux médicaments comme le propranolol et le métoprolol.
variabilité d’acétylation chez les acétyleurs lents ou rapides: Une acétylation lente est due à un gène autosomique récessif associé à une diminution de l’activité de la N-acétylase hépatique exp isoniazide
Facteurs pathologiques :
insuffisance cardiaque diminue la clairance hépatique de certains médicaments.
L’insuffisance hépatique entraine une diminution du métabolisme des médicaments
Interaction médicamenteuse :
Induction enzymatique:
augmentation de l’activité de l’isoenzyme du CYP suite à l’exposition à une substance inductrice
Certains substrats sont capable d’augmenter la synthèse et l’activité enzymatique de certains CYP450
Peu spécifique
Effet inducteur maximal obtenu après 10 ou 15 jours
L’effet inducteur peut se manifester sur le propre métabolisme de l’inducteur : on parle d’autoinduction
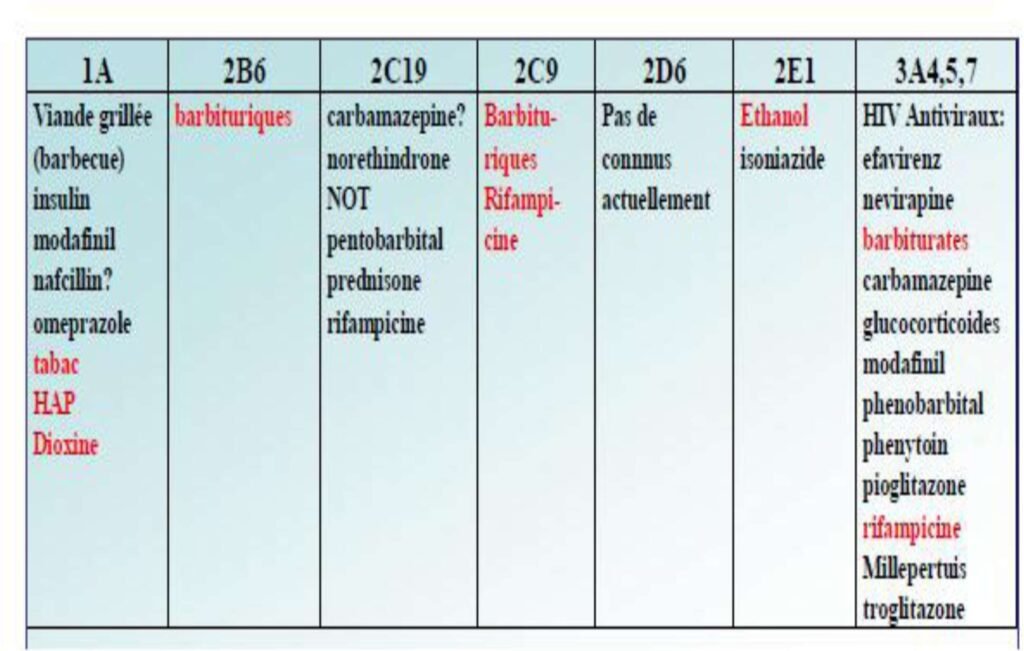
Inhibiteurs enzymatiques:
Compétition entre 2 médicaments pour le site catalytique d’une même enzyme.
le plus souvent compétitive
se manifeste rapidement
↑ concentration plasmatique du médicament
risque de toxicité
IV.
Quantification du métabolisme
Le coefficient d’extraction (varie de 0 à 1) permet de distinguer les :
-Les médicaments à coefficient d’extraction élevé. (E>0,7) Cl dépendante du débit (FPH élevé) exp: morphine, propanolol
-Les médicaments à coefficient d’extraction faible.(E<0,3) Cl indépendante du débit exp: phénytoïne, diazépam, théophylline
Excrétion des médicaments
Introduction
L’excrétion des médicaments et de leurs métabolites se fait par plusieurs mécanismes et par de nombreux organes.
Les propriétés physico-chimiques des molécules médicamenteuses influencent directement leur excrétion
I-Excrétion rénale
A-Mécanisme
Le rein qui reçoit à pression élevée environ 1400 ml/mn de sang, élimine les médicaments comme diverses autres substances de l’organisme.
Du point de vue physiologique, le néphron, unité élémentaire du rein, agit par trois mécanismes différents :
Filtration glomérulaire.
Sécrétion tubulaire.
Réabsorption tubulaire.
Filtration
Tubule
proximal
Tubule
distal
Glomérule
Sécrétion
(active)
AnsedeHenle
Réabsorption (passive)
Tubulecollecteur
28




la Filtration:
Le glomérule se comporte comme un filtre semi-perméable qui laisse passer les molécules dont le poids moléculaire ne dépasse pas
68.000.
Seule la fraction libre des médicaments est filtrée par le glomérule.
la Sécrétion tubulaire:
C’est un mécanisme actif qui survient essentiellement dans le tube contourné proximal du néphron.
Il nécessite un transporteur et de l’énergie.
La sécrétion tubulaire concerne uniquement les molécules ionisées hydrosolubles.
Une interaction entre deux médicaments au niveau du même transporteur peut être exploitée pour prolonger l’effet thérapeutique de l’un des médicaments. (probénicide-pénicilline G)
Réabsorption tubulaire
Touche uniquement les formes liposolubles non ionisées des médicaments.
Se fait par un mécanisme passif au niveau des tubes proximal et distal; ou par un mécanisme actif.
Le pourcentage de la fraction non ionisée qui subit la réabsorption tubulaire dépend de deux facteurs:
le pKa de la molécule médicamenteuse;
les valeurs du pH urinaire qui varient entre 4,5 et 7,5.
lors d’une intoxication au phénobarbital (acide faible), on procède a l’alcalinisation des urines afin d’ioniser la molécule qui ne peut plus subir une réabsorption tubulaire.
l’excrétion digestive
A- l’excrétion biliaire
Mécanisme
Par diffusion passive : dans le sens du gradient de concentration Par transport actif : contre le sens de gradient de concentration
La sécrétion biliaire est d’autant plus importante que la molécule présente:
un poids moléculaire supérieur ou égal à 300 D;
une grande polarité;
Le cycle entérohépatique
Les médicaments excrétés dans la bile peuvent être à nouveau réabsorbés au niveau intestinal, soit directement soit après hydrolyse pour les médicaments conjugués.
élimination biliaire
Lumière duodénale
barrière intestinale
foie
circulation
générale
B- Excrétion salivaire
Se fait par diffusion passive et dépend du pKa, de la liposolubilité et de la fraction libre du principe actif dans le plasma.
Certains médicaments passe dans la salive par un mécanisme de transport actif (lithium, de la phénytoine, antibiotiques)
D-Autres voies d’excrétion
Excrétion pulmonaire
responsable de l’élimination des substances gazeuses et volatiles.
Les poumons constituent un organe épurateur particulier car il présente :
une grande surface d’échange ;
un débit sanguin qui correspond à la totalité du débit cardiaque ;
un équipement enzymatique important.
Excrétion lactée
Elle est accessoire comme voie d’élimination chez la femme.
Les mécanismes impliqués peuvent être passifs ou actifs.
Les médicaments bases faibles se trouvent plus concentrés dans le lait que les médicaments acides faibles.
III. Notions de clairance (ou clearance):
La clairance plasmatique est définie comme le volume de plasma totalement épuré du médicament par unité de temps. (Une clairance est mesurée en unités de débit par exemple des ml/min).

