Cours sur l’Hydrogène
Généralités
De symbole H, l’hydrogène est le premier élément de la classification périodique, le plus simple de tous, il a été découvert en 1766 par H.CAVENDISH.
L’élément est nommé hydrogène, du grec udor et genos = qui engendre l’eau.
L’hydrogène est l’élément le plus abondant de l’univers et se situe au 3ème rang sur la terre, sa faible proportion sur la terre est due à sa volatilité lors de la formation de la planète.
L’hydrogène est l’un des éléments les plus importants de la croute terrestre, il est, avant le carbone, l’élément donnant le plus grand nombre de composés chimiques, notamment les composés organiques.
Son intérêt double pour le dihydrogène H2, certains voient en lui un combustible d’avenir, énergétique et non polluant, après stockage éventuel dans des «éponges » à hydrogène. À cela s’ajoute l’espoir encore lointain de maîtriser la « fusion » des noyaux d’hydrogène, source de l’énergie solaire.
Comme l’atome de l’hydrogène ne possède qu’un seul électron, on pourrait penser que ses propriétés chimiques sont sans intérêt, mais c’est loin d’être le cas.
L’hydrogène possède des propriétés chimiques très diverses, car malgré son électron unique, il peut dans certaines circonstances se lier simultanément à plus d’un atome.
En outre, son caractère acido-basique couvre une gamme qui s’étend d’une base forte de Lewis (sous forme de l’ion hydrure H–) à un acide fort de Lewis (sous forme de proton H+).
Classification :
Premier élément du tableau périodique, il possède la structure électronique la plus simple avec un noyau de charge +1 et un seul électron célibataire situé dans une orbitale sphérique « s ».
11H : 1s1
L’hydrogène ne s’intègre pas facilement dans le tableau périodique :
On le place parfois au-dessus des métaux alcalins ; dans le groupe 1 en tenant compte du fait que l’hydrogène et les métaux alcalins n’ont qu’un seul électron de valence.
Toutefois cette position, n’est pas entièrement satisfaisante d’après les propriétés physico-chimiques de cet élément.
En particulier l’hydrogène n’est pas un métal dans les conditions standards et pour arriver à une forme métallique il doit être soumis à de très fortes pressions qui ne peuvent être atteintes au laboratoire.
Moins souvent on place l’hydrogène au-dessus des halogènes dans le groupe 17, parce que comme les halogènes, il lui faut un électron pour saturer sa couche de valence et comme nous le verrons il existe effectivement un certain parallélisme entre ses propriétés et celles des halogènes.
Etat naturel :
L’hydrogène est l’élément le plus abondant de l’univers et au point de vue de nombre d’atomes il se situe au 3ème rang (après l’oxygène et le silicium) sur la terre.
On le trouve :
A l’état non combiné : Il n’existe qu’en très faible proportion (H2 constitue moins de 1% en volume de l’atmosphère).
Il existe à l’état de traces dans l’air, il provient des gaz naturels tel que ceux des volcans et des gisements pétrolifères, on peut aussi le trouver en petites quantités sous forme d’inclusions gazeuses dans certains minerais et certaines roches.
A l’état combiné : Il est beaucoup plus abondant, il s’agit d’un :
Constituant de l’eau (H2O) ;
Composant des matières organiques notamment des hydrocarbures (pétrole, gaz naturel et de la houille…etc)
Composant des matières inorganiques.
Préparation de l’hydrogène
Les préparations de l’hydrogène sont extrêmement nombreuses ; nous allons nous intéresser aux plus importantes d’entre elles :
Préparation à partir du méthane;
Préparation par électrolyse de l’eau;
Préparation par réduction de l’eau;
Préparation par action d’un acide sur le zinc.
Actuellement la majorité de l’hydrogène (70%) est produit à partir d’un gaz naturel, par reformage à la vapeur ; ce processus de fabrication n’est néanmoins pas tenable à long terme en raison des réserves limitées du gaz naturel et du problème non résolu d’émissions de CO2.
Mais il faut signaler que l’hydrogène obtenu par électrolyse est le plus pur mais le plus couteux.
Préparation à partir du méthane
Le gaz naturel est composé en majeure partie de méthane CH4, mais contient aussi du CO2 et du soufre, ce dernier doit être d’abord éliminé avec la désulfuration.
Le méthane CH4 peut être décomposé par la chaleur à 1000°C en présence de catalyseur soit par :
Craquage simple
CH4 (g) C (s) + 2 H2(g) + 19 Kcal
Craquage oxydant
2 CH4(g) + O2(g) 2 CO(g) + 4 H2(g) – 14 Kcal
Craquage en présence de H2O/CO2
CH4 (g) + H2O (g) CO (g) + 3 H2 (g) + 51kcal (1)
CH4 (g) + CO2(g) 2CO(g) + 2 H2(g) + 61 Kcal (2)
Les reactions (1) et (2) sont généralement suivies d’une deuxième réaction (3), à chaud et en présence d’un catalyseur, due à la nécessité d’éliminer le CO, appelée souvent réaction de déplacement,
CO (g) + H2O (g) + Cat CO2 (g) + H2 (g) (3)
On élimine une grande partie du CO2 en le faisant réagir avec une solution d’hydroxyde de sodium (NaOH) : le CO2 se dissout alors sous forme d’ions carbonates.
Électrolyse de l’eau
L’eau pure conduit à peine le courant électrique, par contre l’addition d’un électrolyte
(acide ou base) va la rendre conductrice.
Les acides ont l’inconvénient d’être corrosifs, ainsi on utilise surtout des bases comme la potasse KOH ou la soude NaOH.
On utilise des électrolyseurs qui sont des bacs.
Généralement les électrodes sont en platine en milieu acide ou en fer en milieu alcalin.
Une différence de potentiel de 2,2 volts est nécessaire en pratique pour décomposer l’eau et une température de 100°C.
La réaction chimique consiste en une dissociation de la molécule d’eau par une réaction d’oxydo-réduction (Voir figure 1):
A la cathode (réduction) : 4H2O + 4 e– 2H2 + 4 OH–
A l’ anode (oxydation) : 4OH– 2 H2O + O2 + 4e– En tout : 2 H2O (énergie électrique) 2 H2 (cathode) + O2 (anode)
Souvent on utilise des diaphragmes poreux ou en amiante pour empêcher la diffusion de gaz dans chacun des compartiments
Résultats
On obtient de l’hydrogène presque pur mais qui peut renfermer des traces :
D’oxygène éliminé par passage sur du platine
D’H2O éliminée par séchage en faisant barboter l’hydrogène dans un flacon laveur contenant H2SO4 + CaO .
L’électrolyse de solution de NaCl et NaOH donne également de l’hydrogène à la cathode.
Ce type de préparations par électrolyse est utilisé dans les régions ou l’énergie électrique est abondante.
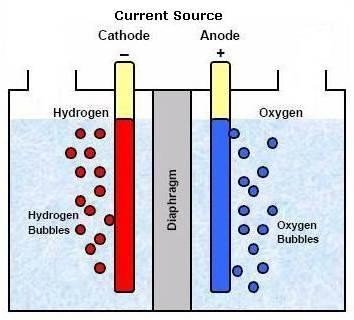
Figure 1 : Electrolyse de l’eau.
Réduction de l’eau :
Trois types de réducteurs sont utilisés dans ces préparations : fer, carbone et phosphore.
Par action du fer :
On utilise le fer car il est peu cher et peut être régénéré facilement En fonction de la température on obtient plusieurs réactions
T° < 570°C T°> 570°C
3 Fe + 4 H2O Fe3O4 + 4 H2 + 35 Kcal (1) Fe + H2O FeO + H2 + 6 Kcal (2)
3 Fe + 4 H2O Fe3O4 + 4 H2 + 7 Kcal (3)
En pratique c’est la réaction 3 qui est la plus utilisée.
Cet oxyde de fer formé en (3) sera réduit à chaud par le monoxyde de carbone qui va libérer du CO2 et le fer pourra de nouveau rentrer dans le cycle de réaction
En résumé
Fe3O4 + 4 CO 3 Fe + 4 CO2
3 Fe + 4 H2O Fe3O4 + 4 H2 Fe3O4 + 4 CO 3 Fe + 4 CO2
Cette réaction fournit une partie importante de l’H2 .
Le CO2 est éliminé par dissolution dans de l’eau sous pression, les traces sont ensuite fixées par une lessive alcaline.
Préparation par réaction entre les acides dilués et les métaux : A partir d’un acide sur le zinc (Zn)
On obtient de l’hydrogène gazeux.
Il est obtenu par action des acides qui réagissent sur les métaux qui précèdent l’hydrogène dans la liste des potentiels redox ; la réaction la plus utilisée est la suivante :
Zn + H2SO4 ZnSO4 + H2(g)
Qualité du zinc : Ne doit pas renfermer des impuretés tel que le phosphore, l’arsenic et le silicium qui sont transformés en hydrures PH3, AsH3, SiH4 .
Choix de l’acide :
H2SO4 dilué est recommandé.
HCl trop volatil serait entrainé en petite quantité avec de l’hydrogène.
HNO3 a des propriétés oxydantes, il serait réduit par l’hydrogène naissant avec production de vapeurs nitreuses.
Précautions à prendre
H2SO4 utilisé doit être dilué, si l’acide est très concentré il se forme SO2 provenant de la réduction de H2SO4 .
Il faut surveiller la température. Si elle est trop élevée la réduction peut aller jusqu’à H2S.
le zinc très pur n’est pas attaqué par le H2SO4, Si l’on ajoute une trace d’un sel de cuivre, le cuivre se dépose sur le zinc, il se forme une pile Zn-Cu et l’attaque se déclenche.
Purification :
Consiste à faire passer l’hydrogène impur sur du cuivre (tournure) placé dans un four à une température de 500 °C, on élimine ainsi H2S selon la réaction :
H2S + Cu H2 + CuS
Propriétés de l’Hydrogène :
Propriétés Physiques
V.1.1- Hydrogène atomique
Dans les conditions convenables de température (T°) et de pression (P) les molécules diatomiques H2
se dissocient en donnant bien à l’équilibre.
H2 2 H + ∆ H
La dissociation est fortement endothermique, elle est favorisée par une élévation de la température et par un abaissement de la pression.
L’hydrogène atomique est chimiquement plus actif que l’hydrogène moléculaire. Des réactions d’hydrogénation sont ainsi rendues possibles à température ordinaire.
Citons celles du soufre, du phosphore, de l’arsenic, de l’antimoine et la formation des hydrures des métaux alcalins LiH, NaH .
Les propriétés physiques de l’hydrogène atomique :
Configuration électronique 1s1
Degrés d’oxydations dont +1 ou -1
Énergie d’ionisation élevée (1310 KJ /mol ; 13.6 eV)
Affinité électronique faible mais positive 77 KJ/mol
Électronégativité de Pauling 2.2.
Isotopes : L’élément hydrogène existe sous 3 formes isotopiques naturelles (Voir figure 2).
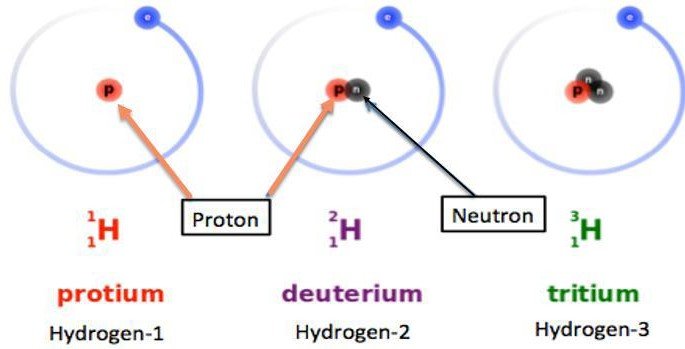
Figure 2 : Isotopes naturels de l’Hydrogène.
Le protium ou hydrogène léger 𝟏𝐇 dont le noyau ne comporte qu’ un proton ;
𝟏
Le deutérium ou hydrogène lourd 𝟐𝐇 ou 𝟐𝐃 , dont le noyau est formé d’un proton et d’un
𝟏 𝟏
neutron ;
Le tritium ou hydrogène très lourd 𝟑𝐇 ou𝟑𝐓, dont le noyau est formé d’un proton et de 2
𝟏 𝟏
neutrons.
Il est radioactif et se désintègre en perdant une particule β– pour donner un isotope rare mais stable de l’Hélium; la demi-vie de cette désintégration est de 12.4 ans.
𝟑𝐇 𝟑𝐇𝐞 + β –
𝟏 𝟐
L’hydrogène naturel que l’on prépare à partir de l’eau a une composition isotopique constante.
Il contient essentiellement du H 99,984 %, D 0,0016 % et T < à 1 / 1017 atomes.
Les configurations électroniques et les propriétés chimiques restent essentiellement les mêmes, mais les différences de masses entrainent des différences dans les propriétés physiques ; d’un point de vue réactionnel les seules différences se manifestent sur les constantes d’équilibre et les vitesses de réactions.
D’autres isotopes, particulièrement instables, (de 4H à 7H) ont été synthétisés en laboratoire mais jamais observés dans la nature.
V.1.2- Hydrogène moléculaire
Deux atomes d’hydrogène sont dans les conditions ordinaires associés en une molécule H2 (forme stable de l’H élémentaire) dans laquelle :
Les spins des deux électrons sont antiparallèles ;
L’énergie de cette association est minimale, elle est inferieure à la somme des énergies des atomes pris séparément.
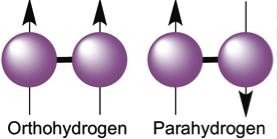
L’hydrogène moléculaire H2 est un mélange de deux formes: L’ortho- hydrogène (o-H2) et le para-hydrogène (p-H2) (Voir figure 3).
Figure3 : o-H2 et p-H2
L’existence des deux variétés trouve son origine dans la rotation des deux protons H+ autour de l’axe qui les joint dans la molécule.
En effet, comme 1’électron, le proton possède un spin nucléaire de valeur 1/2. Le sens de rotation des protons est le même dans l’o-H2 (↑ ↑) et inversé dans le p- H2 (↑ ↓).
Les deux formes sont en équilibre :
o-H2 < —- > p-H2 + ∆ H
La transformation de la variété ortho en variété para est exothermique. Un abaissement de la température déplace l’équilibre en faveur de la variété para.
En accord avec ce fait l’hydrogène contient 25 % de p-H2 pour 75% d o-H2 à température ordinaire et à basse température on a 100% de p-H2 .
Il résulte de l’existence de ces 2 formes une différence entre les énergies de rotation de la molécule.
Différence qui se répercute dans :
Les spectres de bande dans l’infrarouge;
Variation dans la chaleur massique;
Variation dans les points de fusion et ébullition.
Propriétés physiques du dihydrogène H2
L’hydrogène H2 , dans les conditions normales est un gaz incolore, inodore, insipide et peu soluble dans l’eau ;
Le H2 cristallise dans le système hexagonal compact (HC) ;
Le liquide et le solide de l’hydrogène comme le gaz sont incolores ;
Dans les 3 états, l’hydrogène n’est pas conducteur du courant électrique parce qu’il n’existe ni électrons ni ions libres, la liaison H-H reste purement covalente ;
L’état de gaz presque parfait de H2(g) entraîne des températures de fusion et d’ébullition basses en accord avec le fait que les forces de Van Der Walls entre les molécules de H2 sont faibles :
T°f = 14,01 K, soit – 259,14 °C
T°eb = 20,28 K, soit – 252,87 °C
De tous les corps l’hydrogène H2 est celui dont la masse molaire moléculaire M= 2g/mole est la plus petite , Il en découle un certain nombre de conséquences
Grande légèreté : la densité de l’hydrogène relative à l’air d = M/29 = 1/14,5 => donc l’hydrogène est 14,5 plus léger que l’air => il est le plus léger de tous les gaz.
Grande effusion : c’est le passage d’un gaz à travers une très petite ouverture pratiquée dans une paroi mince, l’hydrogène est le gaz qui traverse le plus facilement les parois poreuses.
Conduction de la chaleur : meilleur conducteur de la chaleur que les autres gaz.
Absorption par certains métaux : Vu sa petitesse l’hydrogène peut être absorbé par un certain nombre de métaux comme le fer, le nickel, le titane, le platine, le palladium en provoquant la dilatation de leurs réseaux.
Propriétés chimiques :
L’hydrogène est le seul élément dont la couche K n’est pas saturée.
L’hydrogène peut acquérir une configuration ionique stable de 2 façons, soit :
En fixant un électron pour donner l’ion hydrure H – : H + e– H–
Dont la structure électronique est celle de l’hélium ; cette affinité électronique se manifeste dans ses combinaisons avec les métaux les plus électropositifs (alcalin et alcalino-terreux) : elle traduit le caractère électronégatif et l’action oxydante de l’hydrogène, son degré d’oxydation passant de 0 à -1.
En perdant un électron pour donner le proton H + : H H+ + e–
Il joue le rôle d’élément électropositif, ce qui l’apparente aux métaux ; l’échelle des potentiels normaux met en évidence que l’hydrogène est moins électropositif que la plupart des métaux.
Son électropositivité se manifeste particulièrement dans son action sur les éléments les plus électronégatifs.
Il fonctionne alors comme réducteur, son degré d’oxydation passant de 0 à +1.
Formation de composés hydrogénés :
Il est plus avantageux de répartir les très nombreuses combinaisons de l’’hydrogène en trois principales rubriques en fonction des composés formés (Voir figure 4) :
| 1 | 18 | |||||||||||||||||
| H | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | He | |
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sr | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
Figure 4 : Composés hydrogénés du tableau periodique.
Salin
Métallique
Intermédiaire
Moléculaire
Inconnu
Hydrures salins
Se forment lorsqu’ on chauffe les métaux alcalins et alcalino-terreux (sauf Be et Mg) avec l’hydrogène,
La réaction rapide avec les métaux alcalino-terreux est plus lente qu’avec les métaux alcalins ,
Sont des composés cristallisés blancs dont la structure est celle du chlorure de sodium NaCl,
Les liaisons métal- hydrogène sont très nettement ioniques ,
Tous sont décomposables par la chaleur (NaH et KH entre 400 et 500°C),
Certains hydrures (de Lithium et des métaux alcalino-terreux) sont électrolysables à l’état fondu, le métal se dépose à l’anode, l’hydrogène se dégage à la cathode, leur structure ionique est donc Li+ H– et Ca2+ 2H– ,
Les hydrures salins sont des réducteurs très énergiques,
Certains hydrures salins sont décomposables par l’eau avec libération d’hydrogène : Exemple de décomposition de l’hydrure de calcium :
CaH2 + 2 H2O Ca(OH)2 + 2 H2
Hydrures métalliques
De nombreux métaux de transition ainsi que le Be et le Mg absorbent à chaud l’hydrogène en quantité variable suivant les conditions de température et de pression.
La solution solide ainsi obtenue conduit, en général, à un hydrure susceptible éventuellement de se mettre en équilibre avec un excès d’hydrogène.
Ce processus est souvent réversible.
Les hydrures obtenus sont des composés à caractère métallique, opaques, conducteurs.
Leur réseau est souvent différent de celui du métal de départ.
Ces composés sont facilement oxydables.
Ces composés peuvent être :
Stœchiométriques par exemple VH,
Non stœchiométriques, par exemple PdH0,8 , TiH1,7 .
V.2.1.3 Composés moléculaires hydrogénés
Ils sont formés par l’hydrogène et les éléments d’électronégativité élevée dont la similitude avec celle de l’H favorise la mise en commun d’électron d’où formation d’une liaison covalente.
Ce sont des dérivés hydrogénés formés avec les éléments normaux non métalliques du bloc P :
Action de l’hydrogène sur les halogènes (groupe 17) : on obtient des halogénures d’hydrogène : HF, HCl, HBr et HI par réaction très exothermique
L’affinité pour l’hydrogène décroit du fluor à l’iode en même temps que l’électronégativité.
Avec le fluor la réaction est très explosive et exothermique :
H2 + F2 2HF + 2∆H
Avec le chlore la réaction est explosive en présence d’une lumière très atomique .
La synthèse du bromure d’hydrogène HBr s’effectue à température modérée à 150°C en présence d’un catalyseur.
L’action de l’iode sur l’hydrogène ne commence qu’à partir de 200°C; cette réaction est limitée par la dissociation de HI :
H2 + I2 2 HI
Action de l’hydrogène sur les éléments du groupe 16 : L’affinité pour l’hydrogène décroit de OSSeTe.
Action de l’hydrogène sur l’oxygène : il n’y a pas de réaction à froid, mais une élévation de température, une étincelle, un catalyseur (platine) provoque une explosion du mélange avec dégagement de chaleur et formation de l’eau :
2 H2 + O2 2 H2O + ∆H
Ce grand dégagement de chaleur (2500 – 2600°C) est utilisé dans les chalumeaux industriels pour la soudure.
Avec le soufre le sélénium et le tellure les réactions sont réversibles et commencent à des températures de plus en plus élevées vers 250°C ;
La synthèse du sulfure d’hydrogène H2S est faiblement exothermique, on chauffe : H2 +S ↔H2S
Action de l’hydrogène sur le Se à 400°C, on obtient de l’hydrogène sélénié : H2 +Se ↔H2Se.
Action de l’hydrogène sur les non métaux du groupe 15
Les composés hydrogénés du phosphore et de l’arsenic PH3, AsH3 ne sont pas obtenus directement.
Par contre la synthèse de l’ammoniac est réalisée par combinaison directe :
N2 + 3H2 2 NH3 + ∆H ∆H<0
Action de l’hydrogène sur le carbone
L’union directe du carbone avec l’hydrogène s’effectue par une réaction réversible en donnant du méthane en présence de nickel catalyseur.
C + 2 H2 ↔ CH4 + ∆H ∆H<0
A très haute température on obtient de l’acétylène.
2C + H2 C2H2 + ∆H ∆H>0
Propriétés réductrices
L’hydrogène, en particulier dans son union à des non métaux joue le rôle de réducteur, son degré d’oxydation passant de 0 à +1.
La plupart de ces réductions sont exothermiques.
Elles sont obtenues par élévation de la température, par catalyse, en faisant agir l’hydrogène à l’état naissant.
Réduction par élévation de température
Hydrogénation de l’éthylène en éthane au rouge :
C2H4 + H2 C2H6
Réduction des oxydes des non métaux
Le dioxyde de soufre SO2, les oxydes d’azote N2O sont réduits au rouge avec libération du non métal :
SO2 + 2H2 S + 2 H2O N2O + H2 N2 + H2O
La réduction du dioxyde de carbone donne le monoxyde par une réaction réversible :
CO2 + H2 CO + H2O + ∆H
Par contre l’anhydre borique B2O3 et la silice SiO2 ne sont pas réductibles par l’hydrogène car B et Si sont plus électropositifs que l’hydrogène.
Réduction des oxydes métalliques
Les oxydes des métaux les moins électropositifs sont réduits facilement :
| – L’oxyde d’argent | Ag2O + H2 | à froid→−−−−→ | 2 Ag + H2O |
| – L’oxyde de cuivre | CuO+ H2 | 125 °C→−−−→ | Cu + H2O |
| – L’oxyde de plomb | PbO + H2 | 300 °C→−−−−→ | Pb + H2O |
| – L’oxyde de nickel | NiO + H2 | 300 °C→−−−−→ | Ni + H2O |
L’oxyde ferrique est réduit à l’état d’oxyde salin par une réaction irréversible à partir de 450°C
3 Fe2O3 + H2 2 Fe3O4 + H2O
L’oxyde salin est à son tour réduit par des réactions d’équilibre.
L’oxyde de zinc n’est réduit que vers 1000°C par une réaction réversible :
ZnO + H2 ↔ Zn + H2O
Les oxydes alcalins, alcalinoterreux, l’oxyde d’aluminium (Al2O3) c’est à dire les métaux les plus électropositifs sont irréductibles par l’hydrogène.
Réduction des halogénures et des sulfures métalliques :
Les halogénures ( chlorures, fluorures, bromures et iodures) des métaux peu électropositifs comme ceux de cuivre , d’argent et d’antimoine sont réduits à chaud.
2 AgCl + H2 2HCl + 2Ag
Réactions d’hydrogénation effectuées par catalyse :
Les hydrogénations sont principalement catalysées par le nickel et le cuivre réduits.
On peut citer les hydrogénations :
Des alcènes en alcanes sur nickel réduit : C2H4 + H2 C2H6 (éthane)
Des carbures benzéniques en cyclanes sur nickel réduit : C6H6+3H2 C6H12
(cyclohexane)
Des aldéhydes en alcools primaires à 140°C sur nickel réduit :
CH3-CHO + H2 CH3-CH2OH (éthanol)
L’hydrogénation des produits organiques lourds tels que la houille, le pétrole conduit à l’obtention d’essences.
L’hydrogénation de certains acides gras des matières grasses permet de préparer des huiles hydrogénées dont certaines sont utilisées dans l’alimentation (margarine) et l’industrie pharmaceutique.
V.2.3.Propriétés acido-basiques :
L’hydrogène peut jouer le rôle d’un acide fort de Lewis avec le proton H+ ou d’une base forte de Lewis avec l’hydrure H– (Voir figure 5).
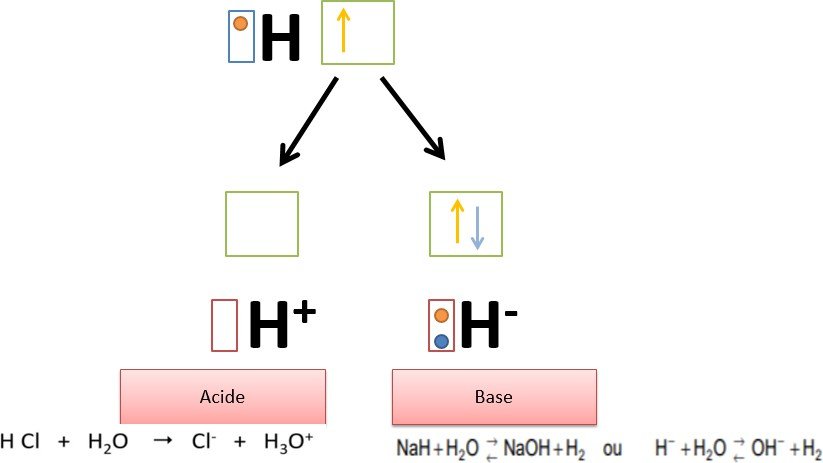
Figure 5 : Propriétés acido-basique de l’hydrogène.
V.2.4.
Formation des Liaisons hydrogène
La liaison hydrogène se forme entre un atome H lié par covalence à un atome X très électronégatif (ex : F, O, N) et un atome très électronégatif Y ayant un doublet électronique libre non liant.
Une interaction X – H ……Y est appelée liaison hydrogène si elle constitue une liaison localisée et si X – H se comporte comme donneur de proton vis-à-vis de Y .
La liaison d’hydrogène forte F – H ……O N – H ……O O – H ……O La liaison d’hydrogène faible C – H …… O
Exemple de liaisons hydrogène entre les molécules d’eau, entre les deux brins d’ADN ou dans la molécule d’acide salicylique (Voir figures 6,7et 8).
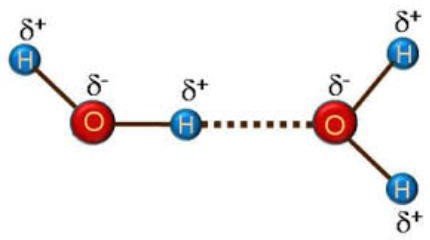
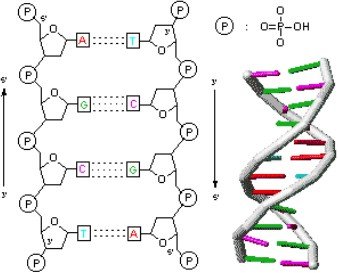
Figure6 : Liaison hydrogène entre deux molécules d’eau .
Figure 7 : Liaison hydrogène entre les deux brins d’ADN.
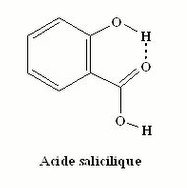
Figure 8 : Structure chimique de l’acide salicylique.
Usages
L’hydrogène est l’un des tout premiers gaz industriels ; il est commercialisé à l’état gazeux ou liquide, la production mondiale est d’environ 240 million tonnes / an.
Les principaux débouchés sont actuellement :
La synthèse de l’ammoniac (60%), l’hydrogène étant mélangé au diazote.
Il est utilisé en pétrochimie, l’hydrotraitement vise à purifier les coupes pétrolifères de leurs impuretés notamment le soufre.
L’hydro sulfuration correspond au schéma suivant :
Produit organique sulfuré + H2 Produit organique désulfuré + H2S
L’hydrogène est utilisé comme gaz de couverture dans le traitement thermique des tôles pour automobiles.
En chimie l’hydrogène est utilisé dans La synthèse des alcools (méthanol).
La synthèse des aldéhydes.
La fabrication du peroxyde d’hydrogène H2O2 .
Au Laboratoire :
L’hydrogène est utilisé comme gaz porteur en chromatographie en phase gazeuse et dans de nombreuses techniques analytiques; les plus communes sont l’utilisation dans les flammes des détecteurs à ionisation de flamme (FID) ou des détecteurs à photométrie de flamme (FPD).
Le D (12H) est utilisé dans le marquage des molécules en analyse (meilleure sensibilité de détection).
Le T (13H) radioactif est utilisé comme traceur dans les essais in vivo réalisés lors du développement d’un médicament.
L’hydrogénation des composés non saturés notamment les huiles transformées en margarines.
L’hydrogène est également utilisé pour la réduction d’oxyde métallique en métal (molybdène, tungstène).
Dans les chalumeaux hydrogène oxygène (soudure, découpage, fabrication de pierres semi précieuses artificielles).
Il est utilisé dans les piles à combustible, dans les propergols pour fusée avec l’oxygène (tous les deux liquides).
L’utilisation de l’hydrogène comme combustible semble pouvoir devenir un débouché important.
C’est en effet un combustible à pouvoir énergétique élevé et non polluant.
Electronique : l’hydrogène est généralement utilisé comme gaz de balayage lors des étapes de dépôt de silicium ou de croissance cristalline.
L’emploi de l’hydrogène avec des gaz inertes protecteurs (H2 dilué dans de l’azote) permet théoriquement d’éliminer la totalité de l’oxygène ainsi que ses inconvénients dans un milieu essentiel pour les procédés à haute ou moyenne températures.
Les deux difficultés qui limitent actuellement son utilisation sont : le cout et le stockage.

