Cours de PHARMACOLOGIE GENERALE : Essais cliniques
Introduction :
Définition et Intérêts :
Un essai clinique est toute recherche biomédicale interventionnelle ou expérimentale chez l’homme, qu’il s’agisse de volontaires malades ou sains en vue de :
découvrir ou de vérifier les effets cliniques et pharmacologiques d’un produit de recherche ou d’autres effets pharmacodynamiques liés à ce produit,
identifier toute réaction indésirable à un produit de recherche et évaluer sa sécurité d’emploi,
étudier la façon dont un produit de recherche est absorbé, distribué, métabolisé et excrété afin d’en évaluer l’innocuité ou l’efficacité.
Elles comportent des études de pharmacocinétique (absorption, distribution, métabolisation, excrétion), pharmacodynamie (effets pharmacologiques, relation dose-effet), et des études de toxicité aigüe, subaigüe puis chronique, de tératogénèse, de mutagénèse, et de cancérogénèse.
Selon l’article 2, Arrêté n°387 du 31 juillet 2006 relatif aux essais cliniques de la réglementation algérienne, L’essai clinique porte notamment sur :
les essais thérapeutiques, diagnostics et préventifs ;
les études observationnelles (cohorte / cas-témoins) ;
les études de bioéquivalence.
Note :
Études observationnelles → Recueillir des données pour approfondir la connaissance d’une maladie et de la manière à traiter.
Etudes cohortes : • Etude d’observation prospective (Exposition mesurée avant la survenue de l’évènement ou l’issue) • Sélection des sujets selon l’exposition • Sujets exposés /sujets non exposés (facteurs de risque) et suivis au cours du temps jusqu’à obtention de l’issue.
Ex : facteur de risque : tabac / issue : cancer du poumon
Etudes cas témoins : • Etude d’observation rétrospective (Exposition mesurée après la survenue de l’évènement) • Sélection selon l’issue (ex : cancer) • on compare par exp les antécédents des Patients ayant un cancer/patients n’ayant pas de cancer à la recherche de causes probable.

Objectif :

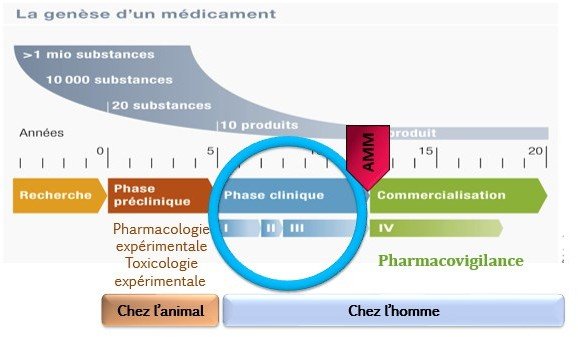
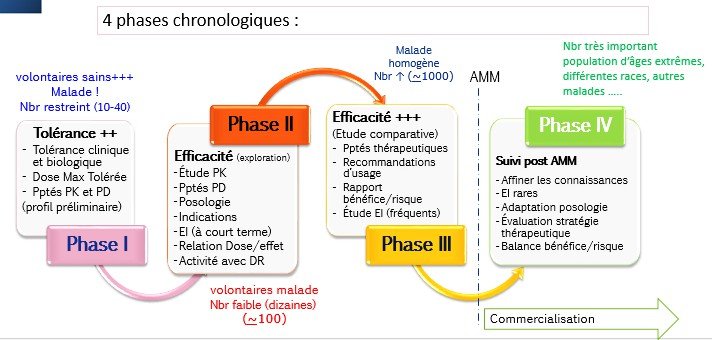
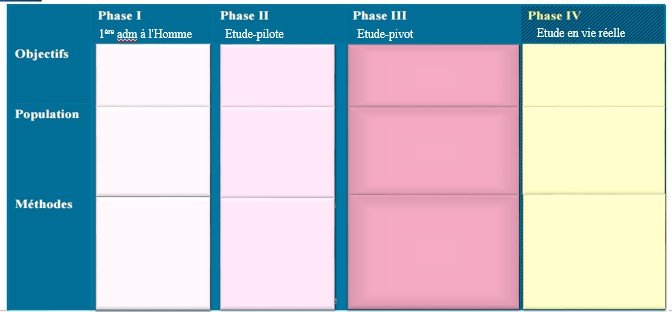
Différentes phases :
Phase I
Phase II
Phase III
Phase IV
avant commercialisation après commercialisation
Ces essais se déroulent en plusieurs phases et chacune permet de répondre à des questions bien précises.
Les résultats obtenus au terme de chaque phase sont analysés.
Si c résultats sont concluants, l’étude pourra passer à la phase suivante.
L’ensemble de ce processus peut prendre plusieurs années, voire des décennies.
A chaque étape : stop or go ?
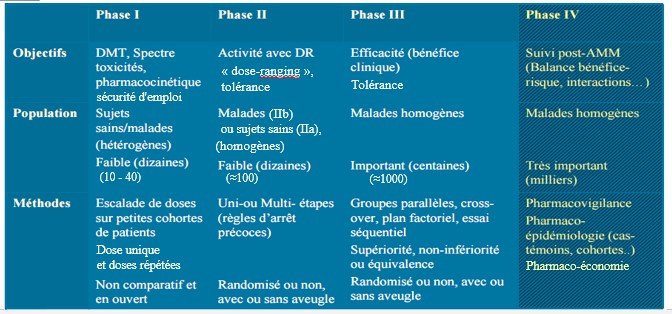
| Méthode | Escalade de dose sur petites cohortesDose uniqueEt doses répétées Essai noncomparatif et en ouvert | Uni ou multi-étapes(Règles d’arrêt précoce)Randomisé ou non, avec ou sans aveugle | Groupe parallèle, en cross-over, planfactoriel, essai séquentiel.Essai de supériorité, de non infériorité ou équivalence.Randomisé ou non, avec ou sans aveugle | Pharmacovigilance Pharmaco- épidémiologie(cas-témoin, cohorte)Pharmaco-économie |
| Phase I | Phase II | Phase III | Phase IV |
AMM : autorisation de mise sur le marché Nbr : nombre
PK : pharmacocinétique PD : pharmacodynamique
Pptés : propriétés EI : effets indésirables
DMT : Dose maximale tolérée DR : dose ranging
Note :
La première dose administrée chez homme est choisie sur la base des données animales correspond à la dose sans effet secondaire ou toxique observé, appelée la NOAEL (No Observed Adverse Effect Level) identifiée chez l’espèce animale pertinente la plus sensible, S’il y a une toxicité directe du médicament ou à la dose sans aucun effet, c’est-à-dire à la NOEL (No Observed Effect Level) s’il y a une intolérance liée à l’effet pharmacodynamique du médicament.
Première dose = Dose estimée / Facteur de sécurité
ÉTUDE PILOTE :
Il s’agit de l’application initiale, à petite échelle, d’un protocole d’étude, afin de vérifier si la conception est adéquate, d’établir sa viabilité ou de demander une information qui permet de déterminer la taille de l’échantillon de l’étude définitive.
Le groupe pilote est formé d’un petit nombre de patients, à qui l’on prescrit le médicament avant de le prescrire à un large effectif
Justification : Pourquoi faire des essais cliniques ?
Pour obtenir des preuves fiables de l’efficacité qu’un traitement permet d’atteindre l’objectif thérapeutique pour lequel il est prescrit
Pour prouver qu’un traitement possède un rapport « risques / bénéfices » favorable
Pour tester les limites du raisonnement physiopathologique
Méthodologie :
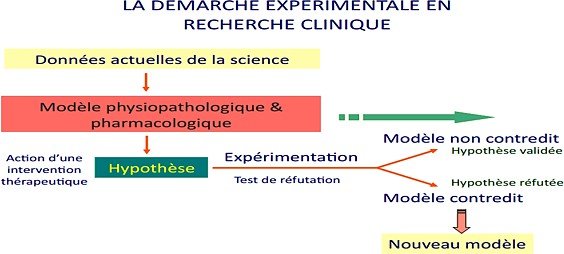

Le critère de jugement principal est le critère qui va servir à la mise en évidence de l’efficacité du traitement étudié.
Il doit être unique, pertinent au regard de l’objectif principal et Validé dans la pathologie étudiée et que sa mesure soit facile, précise, reproductible.
Ex : normalisation de la pression artérielle (mesure) si étude de l’efficacité d’un médicament antihypertenseur.
La formulation de l’hypothèse de l’essai Méthode PICO
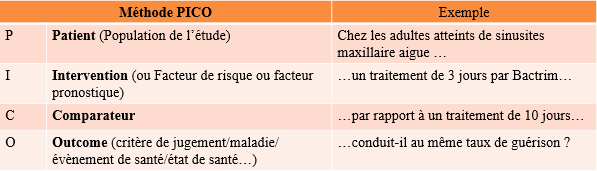
Ex : Chez les adultes atteints de sinusites maxillaires aigue, un traitement de 3 jours par Bactrim par rapport à un traitement de 10 jours conduit-il au même taux de guérison ?

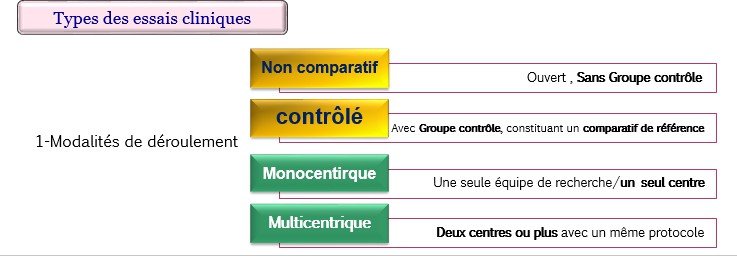
Il existe différents types d’essais comparatifs (contrôlés) :
Les essais comparatifs de supériorité qui démontrent que le médicament expérimental est meilleur que le contrôle ;
Les essais comparatifs d’équivalence qui démontrent que la mesure du critère d’évaluation est similaire (ni pire, ni meilleure) que le contrôle ;
Les essais comparatifs de non-infériorité qui démontrent que le médicament expérimental n’est pas pire que le contrôle ;
Les essais sur la relation dose-réponse qui définissent les divers paramètres de calcul de la dose, dont la dose de départ et la dose maximale.


Essais croisé ou cross over : Chaque patient reçoit alternativement toutes les substances de l’étude dans un ordre différent.
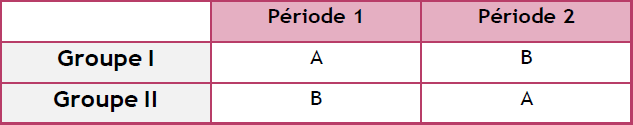

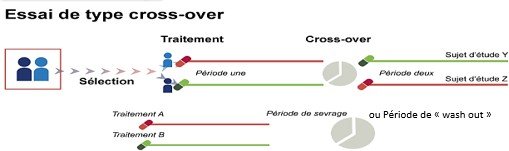
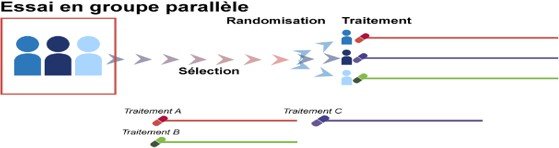
Essais en parallèle : Chaque groupe de patients reçoit un traitement différent (produit test
/placebo / produit de référence), et les résultats seront comparés.


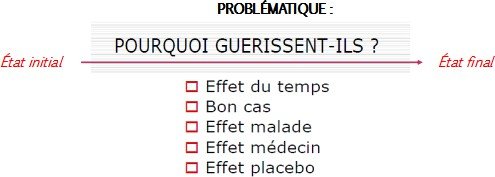
Le trépied des essais cliniques : (Un essai de qualité repose sur 3 principes)
Comparaison : groupe témoin / groupe contrôle
Causalité : tirage au sort (randomisation), double aveugle
Signification : tests statistiques
=== Résultat fiable : résultat réel et non biaisé

(Un biais est une erreur qui engendre des résultats erronés)

(Ajustement)
+ Comparaison (groupe C)
Analyse ITT : analyse en intention de traiter T : témoin C : contrôle


Choix du comparateur : dépend
Des objectifs de l’étude
De l’existence ou non d’un traitement de référence
De la gravité de la maladie
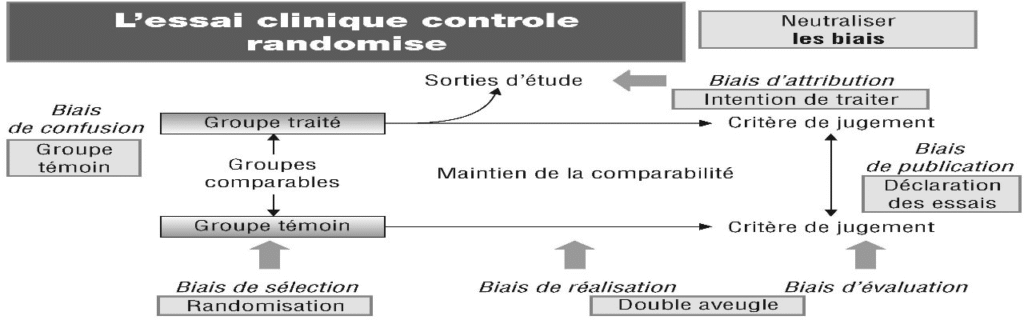
RANDOMISATION : Méthode d’allocation (distribution) aléatoire (au hasard) des traitements (placebo, médicament testé, médicament de référence …) → Assure, qu’en moyenne, les deux groupes seront strictement comparables.
Randomisation par tirage au sort, par bloc, par starification, en utilisant des
algorithmes ou logiciels, ou des tables de randomisation.

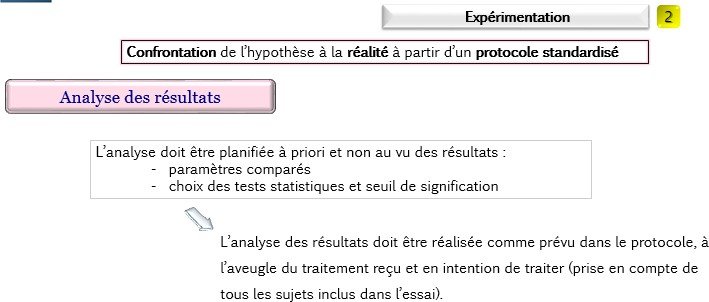
Le test statistique est un moyen qui autorise à conclure à l’existence d’une différence que si le risque de commettre une erreur est faible.



Concordance avec d’autres essais sur le même domaine :
un seul essai ne suffit pas
intérêt de la méta-analyse
Concordance avec les autres connaissances dans le domaine (physiopathologie, épidémiologie, pharmacologie, …)
Aspect éthique
Pour respecter l’éthique, les conditions suivantes doivent être remplies :
L’essai ne peut être entrepris que s’il existe au départ un équilibre entre les avantages et les inconvénients éventuels des traitements à comparer = Balance Bénéfices-Risque favorable.
L’essai doit être conduit selon une méthodologie scientifiquement rigoureuse dans un
milieu médical compétent et bien équipé.
Le consentement libre, éclairé du malade doit être obtenu.
Guidelines et Réglementation
Les essais cliniques doivent être réalisés en conformité avec :
les règles de bonnes pratiques cliniques (BPC)
les règles de bonnes pratiques de laboratoire (BPL)
la réglementation en vigueur
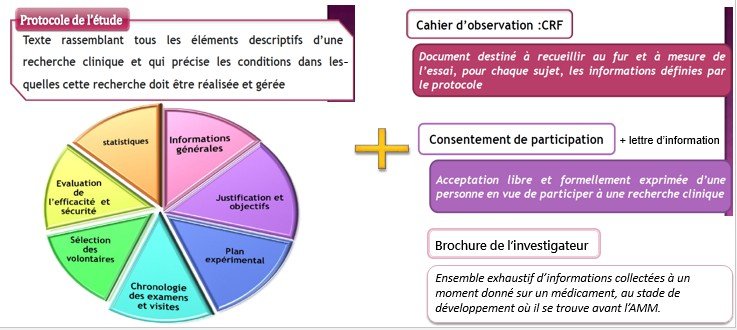
Documents nécessaires

Avis favorable ou défavorable
Testez vos connaissances !


Solution :
QCM juste : A D H I J
Vrai/faux : V – V – F – V – F – F – F – V – F
Tableau :