Chimie minérale pharmaceutique Eléments du groupe 13
INTRODUCTION :
| Elément | Symbole | Z | Abondance (%) |
| Bore | B | 5 | 8.6 x 10-4 |
| Aluminium | Al | 13 | 8.1 % |
| Gallium | Ga | 31 | 19 x 10-4 |
| Indium | In | 49 | 0.16 x 10-4 |
| Thallium | Tl | 81 | 0.53 x 10-4 |
| Nihonium | Nh | 113 | – |
La ligne diagonale séparant les métaux des non-métaux traverse le bloc p dont les éléments du groupe 13 en constituent le premier groupe.
Ainsi, les différences entre les propriétés des éléments d’un même groupe (métaux et non-métaux) sont évidentes si on leur oppose les éléments du bloc s qui forment un ensemble relativement homogène.
Le groupe 13 comprend le bore, l’aluminium, le gallium, l’indium, le thallium et le nihonium.
Le bore est considéré comme un non-métal, tandis que les autres éléments font partie de la famille des métaux pauvres.
Le bore est extrait du borax (Na2[B4O5(OH)5].8H20), l’aluminium, métal le plus abondant de la croûte terrestre, se trouve principalement dans les aluminosilicates (ex. argiles, micas, feldspaths, bauxite).
Ga, In et Tl se trouvent à l’état de traces sous forme de sulfures dans divers minéraux.
Le Nihonium est un élément très radioactif, instable (T½ = 20s), obtenu par synthèse en 2004.
Il reçoit son nom définitif en novembre 2016.
I.
PROPRIETES :
I.1.
PROPRIETES ELECTRONIQUES :
| Configuration électronique | Ei1 (kJ/mol) | Ei2 (kJ/mol) | Ei3 (kJ/mol) | Ei4 (kJ/mol) | Zeff* | |
| B | [He] 2s22p1 | 800.6 | 2427 | 3660 | 25030 | 2.42 |
| Al | [Ne] 3s23p1 | 577.5 | 1817 | 2745 | 11580 | 4.07 |
| Ga | [Ar] 3d104s24p1 | 578.8 | 1979 | 2963 | 6200 | 6.22 |
| In | [Kr] 4d105s25p1 | 558.3 | 1821 | 2704 | 5200 | 8.47 |
| Tl | [Xe] 4f145d106s26p1 | 589.4 | 1971 | 2878 | 4900 | 12.57 |
*Charge nucléaire effective selon la table de Clementi et Coll.
A.
Configuration électronique : les éléments du groupe 13 ont une couche de valence de type ns2np1.
B.
Charge nucléaire effective et effet du doublet inerte : les orbitales atomiques n’ont pas la même capacité d’écrantage de la charge du noyau.
Leur efficacité décroit comme suit : s > p > d > f.
Il en résulte une augmentation progressive de la charge nucléaire effective dans le groupe (l’augmentation de Z n’est pas parfaitement compensée par l’augmentation de δ).
Une limite du modèle de Slater est de considérer que toutes les orbitales internes ont la même capacité d’écrantage.
Effet du doublet inerte : les électrons de valence des éléments dotés d’orbitales d ou f (dont la capacité d’écrantage est relativement faible) subiront une charge nucléaire effective de plus en plus importante à mesure que nous descendons dans le groupe.
Les éléments du bloc p dont la configuration électronique est de type « ns2npx » verront leurs électrons ns2 de plus en plus retenus à mesure que nous descendons dans chaque groupe.
L’effet du doublet inerte décrit la faible tendance des éléments lourds du bloc p à impliquer leurs électrons ns2 dans des liaisons chimiques.
Cet effet explique par ailleurs, certaines anomalies dans l’évolution des propriétés comme l’énergie d’ionisation ou le rayon.
C.
Energie d’ionisation : là où l’énergie d’ionisation est censée diminuer dans le groupe, on remarque une évolution anormale (voir tableau ci-dessus).
Cette évolution s’explique par l’ajout progressif d’orbitales à faible capacité d’écrantage :
Orbitale d entre Al et Ga
Orbitale f entre In et Tl
D.
Etats d’oxydation : les éléments du groupe 13 présentent deux états d’oxydation :
Etat d’oxydation +3 : il correspond à la cession des deux électrons ns2 et de l’électron np1.
Cet état caractérise les composés de B et Al.
Il est également présent dans certains composés de Ga.
Les électrons ns2 sont peu retenus par le noyau en raison de la grande capacité d’écrantage des orbitales s et p (B et Al).
Etat d’oxydation +1 : il correspond à la cession de l’électron np1 uniquement.
Cet état se trouve dans certains composés du Ga et In et est caractéristique des composés du Tl.
Les électrons ns2 ne participent pas aux liaisons chimiques en raison de l’effet du doublet inerte (augmentation de la charge nucléaire effective).
Ainsi la stabilité des composés dont E.O. « +3 » diminue dans le groupe, tandis que celle des composés dont E.O. « +1 » augmente dans le groupe.
Ex.
Réaction des éléments du groupe 13 avec H2O : A température ambiante, ces éléments ne réagissent pas avec l’eau.
Ils réagissent avec la vapeur d’eau :
| Le bore donne l’acide orthoborique | B + 6H2O → | 2H3BO3 + 3H2 | E.O +3 |
| Les autres éléments donnent des oxydes : | Al + 3H2O → | Al2O3 + H2 | E.O +3 |
| Tl + H2O → | Tl2O + H2 | E.O +1 |
2.
PROPRIETES PHYSIQUES :
A.
Aspect : dans les CNTP, le bore impur (amorphe) se présente sous forme d’une poudre brune, tandis que l’élément pur forme des cristaux brillants gris-argenté.
C’est un non-métal très dur et réfractaire (résiste à la chaleur).
Al, Ga, In et Tl sont des métaux à l’éclat argenté, relativement mous.





| Elément | RayonAtomique(pm) | RayonIonique (M3+)(pm) | Densité | Pointde fusion (°C) | Point d’ébullition (°C) |
| B | 88 | – | 2.34 | 2180 | 3658 |
| Al | 130 | 54 | 2.7 | 660 | 2467 |
| Ga | 122 | 62 | 5.9 | 30 | 2403 |
| In | 150 | 80 | 7.3 | 157 | 2080 |
| Tl | 155 | 89 | 11.8 | 303 | 1457 |
B.
Rayon atomique et rayon ionique : les rayons augmentent à mesure qu’on descend dans le groupe.
Les rayons de Al, Ga, In et Tl sont toutefois relativement proches.
L’augmentation de Zeff dans le groupe diminue l’effet de l’augmentation de la taille par ajout progressif de couches électroniques ce qui explique la diminution du rayon entre Al et Ga et les tailles quasi identiques de In et Tl.
C.
Densité, point de fusion et point d’ébullition : B et Al sont particulièrement légers.
Le bore a des points de fusion et d’ébullition très élevé.
Al, Ga, In et Tl ont des domaines liquides très étendus (PF° faible, PE° élevé), en particulier Ga (30 – 2400°C).
Ce dernier possède la propriété de diffuser dans un bon nombre de métaux fragilisant leurs structures cristallines.
I.3.
PROPRIETES CHIMIQUES :
| Electronégativitéde Pauling | Potentiel standardde réduction (V)E°(M3+/M) | Potentiel standardde réduction (V)E°(M+/M) | |
| B | 2.04 | – | – |
| Al | 1.61 | – 1.66 | – |
| Ga | 1.81 | – 0.55 | – 0.2 |
| In | 1.78 | – 0.34 | – 0.14 |
| Tl | 2.04 | + 0.72 | – 0.34 |
A.
Electronégativité : l’évolution de l’électronégativité dans le groupe est également sous l’influence du faible écrantage des orbitales d et f.
B.
Pouvoir réducteur : les éléments métalliques du groupe sont des réducteurs,enparticulier l’aluminium dont la réaction avec Fe2O3 est très exothermique (2200°C).
Al + Fe2O3 → Al2O3 + 2Fe
C.
Nature des liaisons :
B : Le cation B3+ n’a pas été isolé chimiquement.
Tous les composés du bore sont covalents en raison notamment de son électronégativité et son énergie d’ionisation relativement élevées.
Al : forme des liaisons ioniques avec les éléments (F, O) ou les groupes d’atomes très électronégatifs (ex.
AlF3).
Avec les éléments moins électronégatifs et les anions polarisables, il forme des liaisons covalentes en raison de son potentiel ionique élevé (ex.
AlCl3, AlBr3).
Les autres éléments forment essentiellement des liaisons ioniques.
D.
Réactivité :
Les éléments du groupe 13 sont moins réactifs que les métaux du bloc s.
Le bore est chimiquement non-réactif sauf à très haute température.
Les autres métaux réagissent avec les éléments oxydants à des températures ambiantes.
Avec l’oxygène et les halogènes, ils forment des oxydes et des halogénures (voir tableau ci-dessous).
La réaction avec l’azote à haute température donne des nitrures.
| B | Al | Ga | In | Tl | |
| Réaction avec O2 | B2O3 | Al2O3 | Ga2O3 | In2O3 | Tl2O3 |
| Réaction avec X2 | BX3 | AlF3 | GaF3 | InF3 | TlF3 |
| Al2X6 | Ga2X6 | In2X6 | TlX | ||
| Réaction avec N2 | BN | AlN | GaN | InN | / |
N.B. le bore ne forme pas d’halogénures de formule B2X6, en raison de sa petite taille et de l’encombrement stérique que telles composés impliquent.
II.
ETUDE DES CORPS COMPOSES :
II.1.
LES OXYDES ET LES HYDROXYDES :
Le caractère basique des oxydes augmente en descendant dans le groupe :
L’oxyde du bore B2O3 est un anhydride acide.
En s’hydratant avec une ou plusieurs molécules d’eau, il peut former une série d’acides :
Ex. B2O3.H2O Ac.
Métaborique HBO2
B2O3.3H2O Ac.
Orthoborique B(OH)3 ou H3BO3
Les oxydes de l’aluminium et du gallium (Al2O3 et Ga2O3) et les hydroxydes correspondants sont amphotères.
Les oxydes In2O3 et Tl (Tl2O3 et Tl2O) sont exclusivement basiques.
L’hydroxyde d’aluminium [Al(OH)3] en solution :
L’aluminium est amphotère:
En milieu acide : 2Al(s) + 6H+(aq) → Al3+(aq) + 3H2(g)
En milieu basique : 2Al(s) + 2OH–(aq) + 6H2O(l) → 3[Al(OH)4]–(aq) + 3H2(g)
En solution aqueuse, le cation Al3+, grâce à un potentiel ionique très élevé, s’entoure de six molécules H2O (sous forme d’ion hexaaquaaluminum [Al(OH2)6]3+).
L’addition de l’anion OH– à une solution d’aluminium (Al3+ hydraté) produit un précipité gélatineux qui correspond à l’hydroxyde d’aluminium [Al(OH)3].
Ce dernier se redissout dans un excès de OH– sous forme d’anion tetrahydroxyaluminate [Al(OH)4]–.
| OH- | OH- | |||
| [Al(OH2)6]3+(aq) | ⇋ | Al(OH)3(s) | ⇋ | [Al(OH)4]–(aq) |
| H+ | H+ |
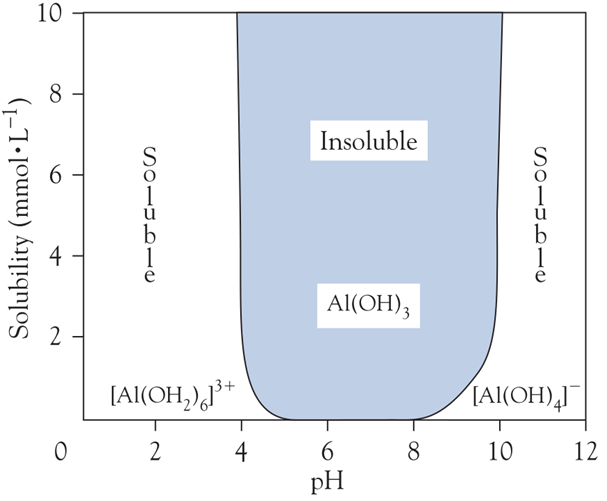
Solubilité de l’aluminium en fonction du pH : Al(OH)3 est insoluble dans un pH neutre et soluble dans un pH très acide ou très basique
Application : voir médicaments à base d’aluminium.
| II.2. LES HALOGENURES (AX3 ou A2X6) :Deux formules : AX3 (monomère) et A2X6 (dimère).Les halogénures AX3 des éléments du groupe 13 sont des composés déficitaires en électrons (l’atome central est entouré de 6e–) : ce sont des acides de Lewis. Ils forment des complexes avec un donneur de doublet électronique (base de Lewis, ex : F, Cl, O, N, etc.) pour atteindre l’octet (8 électrons).Ceci explique la tendance à la dimérisation (formation de dimères A2X6). | |
| L’orbitale « d » vacante (Al, Ga, In et Tl) permet d’accepter plusieurs doublets.Ex. AlF3 peut accepter jusqu’à 3 atomes de fluor supplémentaire pour former l’anion hexafluorure d’aluminium (AlF6)3-. |
Application : BF3 et AlCl3 sont utilisés en synthèse organique (Réaction de Friedel-Crafts) comme catalyseurs. Ex. R – Cl + AlCl3 → R+ + [AlCl4]–
Ar – H + R+ → Ar – R + H+
H+ + [AlCl4]– → HCl + AlCl3
III.
ASPECTS BIOLOGIQUES ET PHARMACEUTIQUES :
III.1.
BORE :
Le Bore est un élément trace essentiel pour les végétaux.
Pour l’homme, de plus en plus d’études suggèrent son importance pour la prévention de certaines pathologies (arthrose, ostéoporose, etc.) en raison du rôle qu’il jouerait dans la formation des os.
A.
Propriétés chimiques du bore et activité biologique :
Le bore forme 3 liaisons covalentes.
Son orbitale p vacante peut accepter un doublet électronique libre.
Le bore trivalent est un acide de Lewis : lorsqu’un atome de bore trigonal (sp2) accepte une paire d’électrons d’un composé nucléophile, il adopte une configuration tétraédrique (sp3).
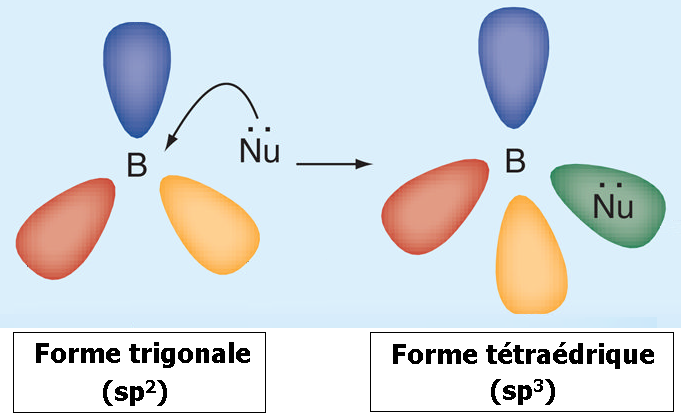
Plusieurs processus enzymatiques passent par la conversion d’un carbone « sp2 » (ex.
R2C=O) en carbone tétraédrique « sp3 » (voir schéma ci-dessous « A ») après la fixation d’un atome nucléophile (ex.
O).
La substitution d’un atome de carbone par un atome de bore permet à ce dernier une conversion de la forme trigonale (sp2) à la forme tétraédrique (sp3).
Seulement, avec le bore, le complexe « Bore-Atome nucléophile » étant très stable, le processus enzymatique se trouve bloqué. (voir schéma ci-dessous « B »).
Plusieurs molécules incorporant le bore comme élément actif, sont en cours de développement afin de les utiliser comme médicaments anticancéreux, antibiotiques, antidiabétiques, etc.
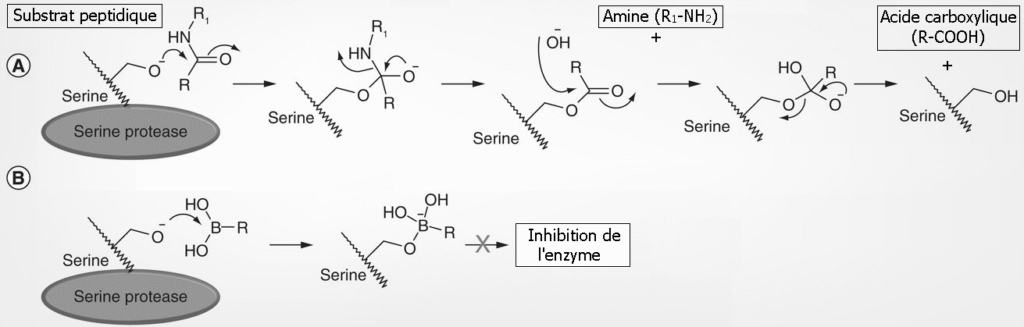
Figure : Mécanisme d’action des composés contenant un atome de bore dans l’inhibition d’une activité enzymatique
(A) Mécanisme d’action d’une sérine protéase (B) L’acide borique (RB(OH)2) forme un état de transition analogue à celui du carbone carbonyle, mais conduit à inhibition de l’enzyme.
B.
Aspects pharmaceutiques du bore :
a.
Acide borique B(OH)3 :
Principe actif : longtemps utilisé comme agent antifongique, antimicrobien, il est aujourd’hui abandonné en faveur d’autres agents plus efficaces et moins toxiques.
Toutefois, Il est toujours utilisé comme solution pour lavage oculaire (acide borique/borax).
Excipient : il est utilisé comme conservateur antimicrobien et tampon dans des préparations à usage externe (collyre, pommade, crème, produits cosmétiques)
b.
Bortezomib :
| Premier médicament à base de bore, le Bortezomib (Velcade®) est un anticancéreux de la nouvelle classe des inhibiteurs de protéasome indiqué dans le myélome multiple. L’atome de bore en est l’élément actif.L’atome de bore présente une grande affinité avec le site catalytique du protéasome sur lequel il se fixe et en inhibe l’action selon le schéma décrit ci-dessus. |
Myélome multiple : cancer hématologique touchant les cellules de la moelle osseuse.
Protéasome : complexe enzymatique responsable du recyclage des structures protéiques inutilisées par la cellule par l’action des protéases.
L’action du protéasome est vitale pour une cellule.
IV.2.
ALUMINUM :
A.
Propriétés physicochimiques de l’aluminium
| Propriétés | Charge | Rayon (A°) | Potentiel ionique |
| Al | +3 | 0.54 | 5.55 |
L’aluminium est un cation très polarisant.
Il interagit fortement avec H2O, OH–, PO43-, etc.
L’aluminium est très faiblement absorbé au niveau de l’estomac.
B.
Aspects pharmaceutiques :
a.
Principe actif :
Médicament antiacide (administration per os)
Al(OH)3 (Gaviscon, Maalox) : étant soluble en milieu acide, il libère les anions OH–qui vont neutraliser l’acidité stomacale :
Al(OH)3(s) + 3H+ → Al3+(aq) + 3H2O(l)
AlPO4 (Phosphalugel) : antiacide d’action locale.
Le phosphate d’aluminium est insoluble en milieu acide.
Il tapisse la paroi interne de l’estomac tout en la protégeant de l’acidité gastrique.
Traitement de l’hyperphosphatémie (augmentation du taux du phosphate dans le sang) : On administre Al(OH)3 qui libère le cation Al3+ au niveau de l’estomac.
Lorsqu’il passe au niveau des intestins (pH 6 – 8.5) le cation Al3+ reprécipite sous forme colloïdale amorphe « Al(OH)3 » qui fixe les anions phosphate présent dans la lumière du tube digestive (potentiel ionique élevé de Al).
Le phosphate d’aluminium formé étant insoluble sera éliminé.
Hyperphosphatémie : observé lors d’une insuffisance rénale sévère.
Les reins n’éliminent plus les anions phosphate.
Cette situation provoque la ostéodystrophie rénale : une déformation des os en raison d’un déséquilibre dans le métabolisme Ca2+/PO43-.
b.
Excipients :
Les sels d’aluminium (hydroxyde, phosphate, oxydes) sont utilisés comme agent adsorbant.
Adsorption : fixation d’une entité chimique (ion, atome, molécule à la surface d’un solide
Dans les vaccins, l’hydroxyde ou le phosphate d’aluminium sont utilisés comme adjuvants immunologiques.
Les antigènes (substances provoquant la réaction immunitaire) sont fixés sur l’adjuvant puis « présentés » auxcellulesimmunitaires.
C.
Toxicité de l’aluminium :
Le corps humain élimine efficacement l’aluminium ingéré.
Toutefois et notamment chez les sujets dialysés (insuffisants rénaux), un syndrome appelé « encéphalopathie aluminique », peut apparaitre après une exposition importante d’aluminium (liquide de dialyse contenant de l’aluminium, alimentation, produits de cosmétiques, traitement antiacide).
L’accumulation de l’aluminium dans l’organisme provoque des atteintes cérébrales, hépatiques et osseuses.
Les symptômes de l’encéphalopathie aluminique incluent : troubles de la parole et de la mémoire, ostéomalacie (minéralisation des os défectueuse), démence.
L’aluminium est également toxique pour l’embryon ou le fœtus.
