Les anti-inflammatoires non stéroïdiens (AINS)
Introduction :
L’inflammation est présente dans de nombreuses maladies, ce qui explique la large utilisation des anti- inflammatoires.
On distingue 2 grands groupes d’anti-inflammatoires, les anti-inflammatoires non stéroïdiens (AINS) et les anti-inflammatoires stéroïdiens (glucocorticoïdes, souvent appelés corticoïdes).
Les AINS sont utilisés principalement dans le traitement des douleurs articulaires ou osseuses, et comme antipyrétiques, comme antalgiques, ou comme antiagrégants.
L’inflammation :
La réaction inflammatoire :
Le processus inflammatoire implique une série d’événements immunologiques déclenchée par des stimuli tels que des agents infectieux, l’ischémie, la chaleur, des réactions antigéniques…
La réaction inflammatoire se caractérise par 4 phénomènes typiques : chaleur, rougeur, douleur et œdème, évoluant en trois phases principales :
Phase vasculaire caractérisée par des modifications de la microcirculation locale (vasodilatation)
Phase cellulaire caractérisée essentiellement par une infiltration de leucocytes et de cellules phagocytaires
Phase tardive de cicatrisation qui en quelques jours verra la restauration des tissus.
Suite au déclenchement de l’inflammation, on aura une série d’évènements durant la phase précoce :
Initiation de la réponse inflammatoire par les facteurs de la coagulation.
Cascade d’évènement conduisant à la libération de :
Médiateurs chimiotactiques (anaphylatoxine C3a, C5a et IL8)
Peptides vasoactifs :
Bradykinines,
Médiateurs préformés des mastocytes (histamine, sérotonine)
Médiateurs néoformés : cytokines et dérivés de la membrane cytoplasmique : prostaglandines, thromboxanes-A2 et leucotriènes.
Synthèse de molécules d’adhésion par l’épithélium.
Libération de radicaux libres oxygénés et d’enzymes (collagénases, activateurs de plasminogène)
L’ensemble de ces évènements conduit aux phénomènes précoces de l’inflammation : érythème (vasodilatation), œdème (extravasation des leucocytes et du plasma), chaleur (production de cytokines pyrogènes), douleur (bradykinines, PGE2…).
Production d’eicosanoides dans l’inflammation:
Les eicosanoides sont des produits de la peroxydation des acides gras polyinsaturés à 20 atomes de carbone (Acide arachidonique…), c’est des hormones locales qui agissent à très faibles concentrations.
Trois familles de composés existent : Leucotriènes, Prostaglandines et thromboxanes.
Ainsi, en réponse à divers perturbations (chimiques, physiques, hormonales), il se produit une activation de la phospholipase A2, qui hydrolyse les liaisons esters des phospholipides membranaires, et libère l’acide arachidonique.
L’acide arachidonique est ensuite métabolisé selon 2 voies :
La voie de la lipo-oxygènase, qui le transforme en leucotriènes.
La voie de la cyclo-oxygènase, qui le transforme en prostaglandines.
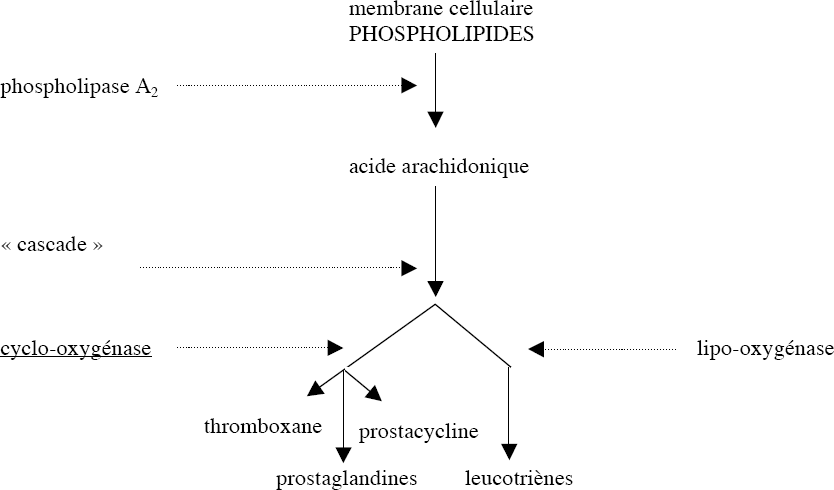
Il existe 2 iso-formes enzymatiques de cyclo-oxygénases; la COX1 et la COX2 :
COX-1 : est constitutive, permet la synthèse de prostaglandines exerçant des fonctions physiologiques, l’activité COX1 est nécessaire pour l’homéostasie.
COX-2 : induite par les cytokines de l’inflammation, permet la synthèse des prostaglandines de l’inflammation.
| COX-1 | COX-2 | |
| Localisation cellulaire | Réticulum endoplasmique | Réticulum endoplasmique etmembrane nucléaire |
| Expression tissulaire | Estomac, reins, plaquettes, cellules endothéliales | Monocytes, cellules synoviales, cellules tumorales, fibroblastes |
| Régulation | Constitutive | Inductible |
| Fonction | Physiologique (homéostasie) | inflammatoire |
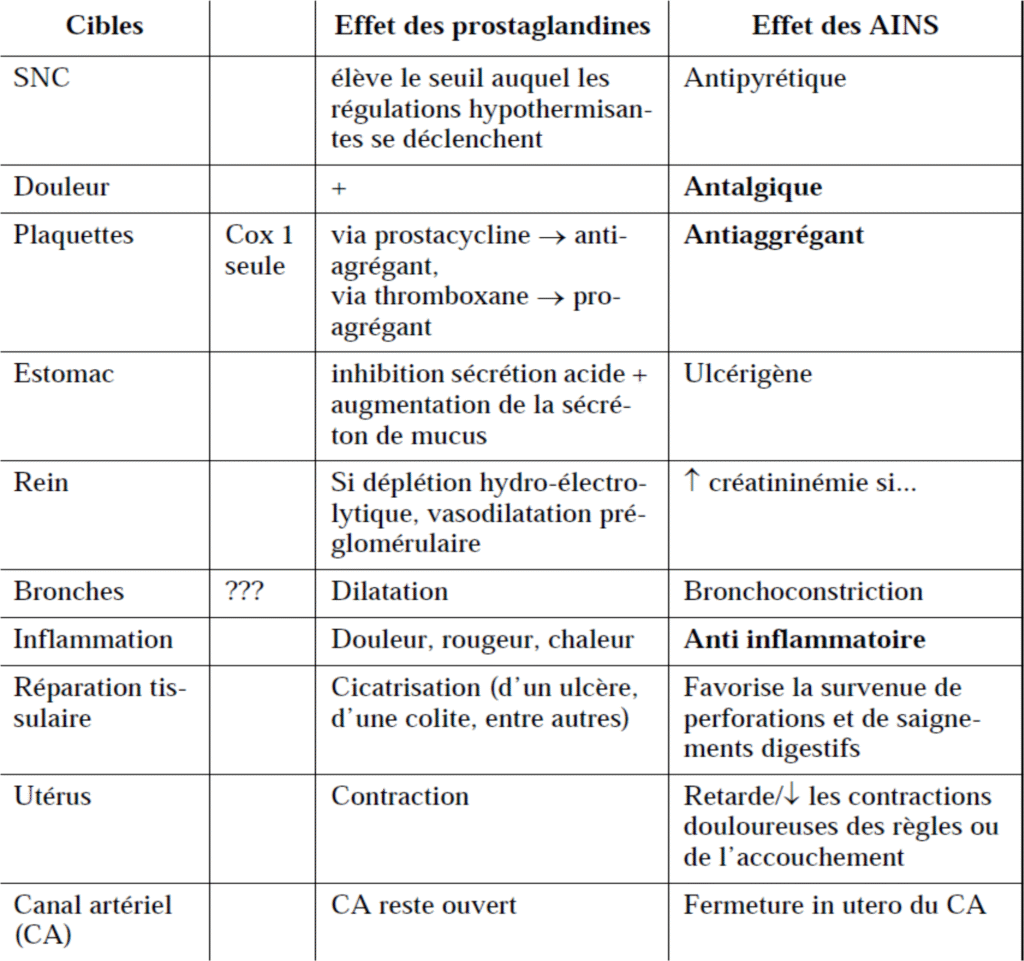
Les effets des prostaglandines, et par conséquent, des AINS :
Définition des AINS :
Les AINS sont des médicaments symptomatologiques capables de s’opposer au processus inflammatoire, quelle qu’en soit la cause : mécanique, chimique, infectieuse ou immunologique.
Classification des AINS :
Plusieurs classifications sont proposées, basées soit sur la structure chimique, soit sur la puissance, soit sur le mécanisme d’action et la sélectivité anti-COX.
Classification chimique des AINS:
Les AINS sont caractérisée par l’absence de la structure chimique stéroïdienne, à l’inverse des corticoïdes.
On distingue :
Dérivés salicylés (acide acétyl-salicylique : Aspirine®)
Acides arylcarboxiliques : Dérivés de l’acide phényl acétique (Diclofénac…) et dérivés de l’acide phénylpropionique : ibuprofène, kétoprofène, naproxène…
Dérivés indoliques (indométacine…)
Dérivés oxicams (piroxicam…)
Dérivés fénamates (acide méfanamique…)
Pyrazolés (phénylbutazone)
Classification selon leur sélectivité :
| Groupes | AINS |
| Anti-COX-1 préférentiel | Aspirine, indométacine, piroxicam |
| Anti-COX non sélectifs | Diclofénac, ibuprofène, naproxène |
| Anti-COX-2 préférentiel | Meloxicam |
| Anti-COX-2 sélectifs | Celecoxib, rofecoxib, valdecoxib |
Classification selon le risque lié à leur utilisation :
Liste I : Ceux dont les risques sont les plus importants, souvent avec une demi-vie longue, dont les indications sont donc les plus limitées.
Exp : La phenylbutazone, l’indometacine et les oxicams.
Liste II : Ceux dont les risques sont acceptables.
Exp : certains dérivés arylcarboxyliques (Diclofénac) et la plupart des fénamates.
Hors liste : Ceux qui semblent présenter un risque suffisamment limité et contrôlable pour pouvoir être utilisés sans prescription médicale (auto-médication).
Exp : Les salicylés, L’ibuprofène et le kétoprofène, à dose antalgique.
Mécanisme d’action des AINS :
Les AINS inhibent la cyclo-oxygénase et donc la production des prostaglandines (an niveau périphérique mais aussi au niveau central)
Sur le plan du mode d’action, il existe 3 familles de produits :
Les inhibiteurs compétitifs réversibles se fixent dans le site catalytique de l’enzyme en empêchant ainsi la liaison de son substrat naturel : l’acide arachidonique.
La majorité des AINS entrent dans cette catégorie.
Les inhibiteurs irréversibles tels que les salicylés (Aspirine) et l’indométacine qui produisent une inhibition enzymatique définitive.
Ainsi, la durée de l’effet de l’aspirine dépend du temps de renouvellement des cyclo-oxygénases dans les différents tissus cibles.
Les inhibiteurs compétitifs réversibles dont l’action est liée à la capture des radicaux libres.
Les AINS les plus couramment utilisés inhibent de façon non sélective les 2 formes COX-1 et COX-2.
Les effets anti-inflammatoires sont principalement liés à l’inhibition de COX-2, alors que les effets
indésirables sont fréquemment liés à l’inhibition de COX-1, ce qui explique les efforts déployés actuellement pour développer des AINS ayant une sélectivité plus grande pour COX-2 que pour COX-1.
IV.
Effets thérapeutiques des AINS:
Tous les AINS sont antipyrétiques, analgésiques, et anti-inflammatoires.
Action anti-inflammatoire :
Cette action porte principalement sur la composante vasculaire de la réaction inflammatoire, responsable de la classique tétrade : œdème, douleur, rougeur, chaleur.
Elle est mise à profit au cours des accès aigus microcristallins (goutte) et des rhumatismes inflammatoires chroniques (polyarthrite rhumatoïde et spondylarthropathies surtout).
NB : L’action anti-inflammatoire requiert généralement des posologies d’AINS plus élevées que celles nécessaires dans les autres variétés de douleurs ou dans la fièvre.
Les salicylés (Aspirine) est contre indiquée en cas de la goutte (l’aspirine diminue la clairance de l’acide urique)
Action antipyrétique :
Les AINS diminuent la fièvre quelle qu’en soit l’origine : infectieuse, inflammatoire ou néoplasique et ce en inhibant la synthèse de PGE2 au niveau de l’hypothalamus (centre de la thermorégulation).
Action antalgique :
Les AINS sont efficaces sur un large éventail de syndromes douloureux par excès de nociception:
Aigus : douleurs dentaires, postopératoires, post-traumatiques, céphalées, pathologie ORL, etc.
Chroniques : affections rhumatologiques, douleurs néoplasiques ; pour ces dernières, ils constituent avec le paracétamol le premier palier de la stratégie thérapeutique préconisée par l’OMS.
Action antiagrégante plaquettaire :
Tous les AINS anti-COX-1 (non les anti-COX-2 sélectifs) interférent avec les fonctions plaquettaires, ils inhibent la formation de thromboxanes TXA2 (puissant agent agrégeant)
C’est l’aspirine qui allonge le plus nettement le temps de saignement.
L’aspirine inhibe de façon irréversible la cyclo-oxygénase des plaquettes, ces dernières ont peu ou pas de capacité de régénérer la cyclo-oxygénase, cela signifie qu’une dose unique d’aspirine inhibe la cyclo-oxygénase plaquettaire pour la durée de vie de celle-ci (8 à 11 jours).
L’effet antiagrégant ne réclame que de faibles doses (100 à 250 mg/j) et persiste une semaine après l’arrêt du traitement.
Fermeture du canal artériel :
L’indométacine et ses dérivés ont été utilisés en néonatologie pour obtenir la fermeture du canal artériel persistant.
Soulagent les symptômes de dysménorrhée primaire :
Liés à la libération des prostaglandines par l’endomètre au cours de la menstruation qui sont à l’origine de contractions importantes.
Pharmacocinétique:
Après administration orale, les AINS ont une bonne biodisponibilité (de l’ordre de 70 à 80 %).
Ils vont diffuser dans la plupart des tissus et fluides de l’organisme.
De même, ils diffusent dans le lait maternel mais à des concentrations trop faibles pour qu’elles soient cliniquement significatives lors de traitements à court terme.
Par ailleurs, la diffusion de ces substances est facilitée dans les tissus inflammatoires.
Les AINS sont transportés essentiellement (de 60 à 100 %) sous forme liée aux protéines plasmatiques.
Ces médicaments subissent un métabolisme hépatique avant d’être éliminés pour 1/3 dans les selles et pour 2/3 dans les urines sous forme inactive.
Effets indésirables :
Effets indésirables digestifs:
Il faut distinguer :
les manifestations fonctionnelles (dyspepsie, gastralgies, nausées) : fréquentes et rapidement résolutives à l’arrêt du produit.
les ulcères gastroduodénaux découverts lors d’examens endoscopiques : plus fréquents avec les AINS classiques qu’avec les coxibs, mais asymptomatiques dans la moitié des cas.
Réactions cutanéomuqueuses:
Prurit, éruptions diverses, stomatite, rhinite, bronchospasme et, dans une bien moindre mesure, œdème de Quincke ou choc anaphylactique.
Complications rénales:
Les plus communes sont précoces, dose-dépendantes et consécutives à l’inhibition des Cox rénales:
rétention hydro-sodée se traduisant par des œdèmes des membres inférieurs, une augmentation de la pression artérielle.
insuffisance rénale aiguë (favorisée par: diurétiques, déshydratation, régime sans sel, sujets âgés).
Complications hématologiques:
Effet anti-aggrégant plaquettaire (Surtout avec l’Aspirine).
Anémie par hémorragie digestive (anémie ferriprive)
Effets indésirables hépatiques:
perturbations de type : cytolyse et/ou cholestase (mécanisme immunologique ou toxique).
Syndrome de Reye : survenant chez l’enfant de 6 mois à 15 ans lors d’infections virales traitées par l’Aspirine (Ce syndrome est mortel dans 20% des cas).
Complications gynéco-obstétricales:
En inhibant la Cox-2, les AINS exposent le fœtus à une fermeture prématurée du canal artériel et à une insuffisance rénale à partir du sixième mois de grossesse.
Contre indications :
Allergie aux AINS
Ulcère gastroduodénal
Insuffisance hépatique sévère
Insuffisance rénale sévère
Asthme
Goutte (uniquement les salicylés comme l’aspirine sont contre indiqués)
1er et 3ème trimestres de grossesse
Allaitement
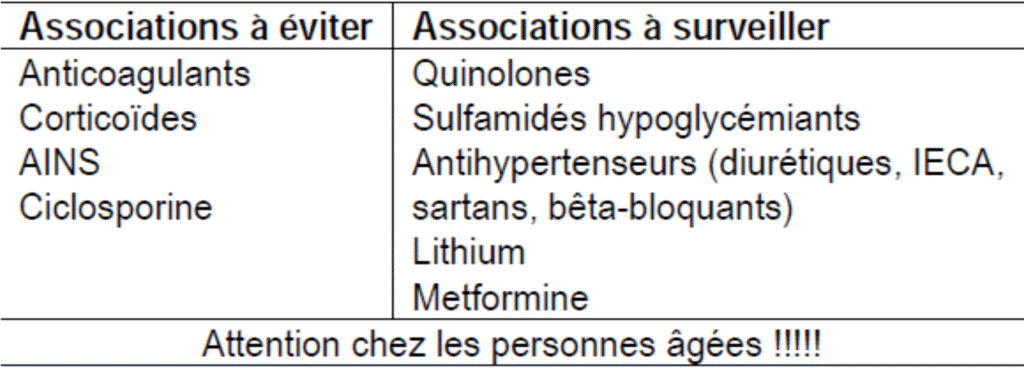
Interactions médicamenteuses :
Les AINS peuvent potentialiser l’action d’autres médicaments tel : anticoagulants oraux, sulfamides antidiabétiques (forte liaison aux protéines plasmatiques)
Certains AINS (pyrazolés +++) ont une action inductrice des enzymes hépatiques antagonisant ainsi l’action d’autres médicaments (digitoxine, phénobarbital).
Il faut éviter l’association de 2 AINS car les effets secondaires s’additionnent.
Les anti-inflammatoires stéroïdiens (AIS)
Introduction :
Les anti-inflammatoires stéroïdiens (glucocorticoïdes) sont des médicaments qui dérivent d’une hormone naturelle sécrétée par la corticosurrénale, le cortisol.
Dès leur introduction en thérapeutique, les glucocorticoïdes ont révolutionné la prise en charge de nombreuses maladies d’origine inflammatoire, allergique ou immunologique.
Les effets indésirables des corticoïdes, responsables de leur mauvaise réputation, sont souvent inévitables, donc le choix d’une corticothérapie impose l’étude de la balance risque/bénéfice.
Rappel sur la synthèse des stéroïdes endogènes :
Les corticostéroïdes naturels synthétisés par les surrénales ont soit une activité glucocorticoïde prédominante, comme le cortisol, soit une activité minéralocorticoïde prédominante, comme l’aldostérone.
Le cortex surrénalien contient deux compartiments distincts anatomiquement et fonctionnellement :
-La zone glomérulée : dont le régulateur physiologique est l’angiotensine-2 et (K+), ses récepteurs se trouvent au niveau de cette zone qui assure la production des mineralo corticoides (aldostérone).
-La zone fasciculée et la zone réticulée : dont le régulateur physiologique est l’ACTH de l’antéhypophyse et assurent successivement la synthèse des glucocorticoïdes et des corticoïdes androgènes.
Les fluctuations de la libération des glucocorticoïdes dépendent des fluctuations de libération de l’ACTH (Adrenocorticotropic hormone) par l’hypophyse, régulée par la CRH (hormone libérant la corticotropine) synthétisée au niveau de l’hypothalamus, on peut conclure que la libération des glucocorticoïdes est soumise au control de l’axe hypothalamo-hypophysaire-surrénalien (HHS).
Classification des glucorticoides :
1)- Glucocorticoïdes naturels et leurs esters
Ce sont des présentations du dérivé naturel le cortisol
CORTISOL ;(simple, acétate ou hemisuccinate.)=HYDROCORTISONE.
2)-Glucocorticoïdes synthétiques ni hallogénés ni compensés
-Dans ce groupe la Prednisone « CORTANCYL » est considérée comme le dérivé de référence pour l’activité anti inflammatoire de tous les autres dérivés synthétiques : Prednisone = délta hydrocortisone
3)-Corticoides non halogénés compensés
Methyl prédnisolone :ces glucocorticoides sont administrés par voie locale et génerale,leur puisance d’action anti inflammatoire est renforcée par les différentes substitutions ;mais les efffets indésirables sont equilibrés ce qui rend possible l’administration par voie générale.
4)- Corticoides halogénés non compensés
Ces glucocorticoides sont réservés pour une administration locale ,la puissance d’action anti inflammatoire a été multipliée par plus de 30,mais les effets indésirables également,ils ne peuvent donc pas etre administrés par voie systémique.
Exp: Fludrocortisone
5)- Corticoides halogénés compensés
Administrables aussi bien par voie orale que générale .
L’adjonction d’un substituant (CH3ou OH) réduit qulque peu la puissance d’action et la toxicité de ces dérivés fluorés ,permettant une prudente administration par voie générale ou dans les voies respiretoires.
Exp : Triamcinolone, Déxametasone, Betametasone
Mécanisme d’action :
Régulation transcriptionnelle :
Tous les médicaments glucocorticoïdes ont un mécanisme d’action commun.
Ils agissent en modulant l’expression génique d’un certain nombre de protéines impliquées dans la réaction inflammatoire.
Cette action passe par la fixation au récepteur des glucocorticoïdes nucléaires.
Cette fixation entraîne la translocation du récepteur du cytosol vers le noyau de la cellule où il se comporte comme un facteur de transcription.
Les glucocorticoïdes peuvent réguler l’expression de gènes cibles selon des mécanismes d’action distincts :
Le complexe hormone-récepteur interagit avec l’ADN au niveau de sites accepteurs appelés
« Glucocorticoïdes-Responsive-Eléments » ou GRE et exerce ainsi une activation de la transcription.
Il se produit alors une augmentation de production de protéines anti-inflammatoires comme la lipocortine-1, l’interleukine IL-10.
Une inhibition de transcription de certains gènes en protéines inflammatoires, par régulation négative directe de la transcription par l’intermédiaire d’un site de liaison négatif ou nGRE.
Action sur les facteurs de transcription AP-1, NF-kB et NF-IL6.
Les corticoïdes contrôlent l’expression de multiples gènes de l’inflammation comme ceux de nombreuses cytokines.
Cette action n’est pas liée à l’interaction directe avec un GRE mais passe par une interaction avec certaines protéines de régulation transcriptionnelle, appelées facteurs de transcription, dont font partie AP-1, NF-kB et NF-IL6.
Diminution de l’acide arachidonique :
Par la synthèse de lipocortine-1 qui possède une activité antiphospholipase A2 => diminution de la formation des prostaglandines, des leucotriènes et du facteur d’activation plaquettaire (PAF).
Effets pharmacologiques des glucocorticoïdes :
Effets métaboliques
1)-Glucidique : Hyperglycémie en dehors de l’état de jeune, après administration de doses fortes et prolongés par stimulation de la néoglucogenèse et de la glycogénolyse.
2)-lipidique : Augmentation de la lipolyse avec amaigrissement des extrémités.
Redistribution des graisses (faciès cushingoide lunaire + bosse de bison au niveau du tronc), peut être consécutifs à la stimulation de la sécrétion de l’insuline (qui provoque la lipogenèse) par l’hyperglycémie induite par les corticoides.
3)-Protéique : Catabolisme protéique avec une panoplie d’effets : fonte musculaire, atrophie des tissus lymphoïdes, réduction de la matrice protéique osseuse.
4)- Fuite calcique : par augmentation de l’excrétion rénale du Ca++ avec comme conséquence une diminution de la densité osseuse avec ostéoporose et fractures.
Action anti inflammatoire:
D’une manière générale, les corticoïdes diminuent les inflammations aiguës et chroniques.
Si elles limitent favorablement les conséquences néfastes des inflammations aiguës,
Elles freinent l’évolution des lésions résultant des inflammations chroniques et en soulagent les symptômes, mais elles ont un effet défavorable sur les aspects protecteurs de ces phénomènes et sur la cicatrisation.
Les glucocorticoïdes inhibent tous les stades du processus inflammatoire
Phase précoce: action anti granulomateuse.
Phase tardive =action anti-proliférante (prolifération capillaire, prolifération des fibroblastes et dépôt de collagène.
Il en résulte un effet spectaculaire sur tous les signes de l’inflammation locaux (rougeur, chaleur, douleur) et généraux (fièvres), quel que soit la cause (chimique, traumatique, infectieuse, immunologique).
Inhibition de la phospholipase A2 (par l’intermédiaire de la sécrétion d’une protéine, la lipocortine), d’où interruption :
de la cascade de l’acide arachidonique et de la synthèse des prostaglandines et des leucotriènes.
de la production de PAF (facteur d’activation plaquettaire)
diminution de la libération d’histamine par les mastocytes
diminution du chimiotactisme et de l’afflux cellulaire (leucocytes) au niveau du foyer Inflammatoire.
diminution de l’activité des mononucléaires et de la néogénèse vasculaire (inflammation chronique).
diminution de la prolifération des fibroblastes et de la production de collagène (cicatrisation).
Effets immunodépresseurs :
Les corticoïdes interviennent à des niveaux multiples des processus immunitaires, directement sur certains lymphocytes, indirectement par l’intermédiaire des cytokines ou du complément.
Globalement, leur action aboutit à une dépression de l’immunité humorale (inhibition de la Production d’anticorps) et cellulaire.
Leurs principaux points d’action sont :
diminution de la production de cytokines (notamment IL1, IL6, TNFα)
diminution de la production clonale de lymphocytes T (la présentation de l’antigène par les macrophages n’aboutit pas à la prolifération du clone de lymphocytes T correspondant)
diminution de l’activité des lymphocytes T-helper ;
diminution de la production de complément ;
diminution de la production des immunoglobulines IgG.
Effet sur l’équilibre hydroélectrique
Rétention du NA+ et fuite du K+ et des ions H+ , cette action des glucocorticoïdes est suffisante pour couvrir les besoins d’un sujet présentant une insuffisance surrénalienne sans avoir recours à l’aldostérone à condition de ne pas avoir recours à des glucocorticoïdes type compensés.
Pour l’aldostérone il agit via l’activation des récepteurs de la zone glomérulée de la corticosurrénal par l’angiotensine 2 sur le tube contourné distal et le canal collecteur avec pour effet une rétention du NA+ contre fuite du K+ et des ions H+.
Effets cardiovasculaires
Par rétention de NA+ et augmentation de la masse sanguine circulante, augmentation de la viscosité sanguine.
Actions sanguine
-Stimulation de l’érythropoïèse.
Actions psychique
Euphorie, insomnies parfois agitations et anxiété, augmentation de l’excitabilité cérébrale, mais en cas d’arrêt brutal du traitement, les manifestations de sevrage comporte toujours une dépression psychique.
Pharmacocinétique :
Résorption : Le cortisol et les anti-inflammatoires stéroïdiens sont bien résorbés par voie digestive.
Leur vitesse de résorption varie selon la structure chimique.
Sous forme d’esters hydrosolubles, ils peuvent être administrés par voie parentérale.
En application locale (muqueuse, cutanée, articulaire), ils diffusent facilement dans le reste de l’organisme, ce qui peut entraîner des effets secondaires d’origine systémique.
Transport : Le cortisol est transporté dans le sang, dans les conditions basales, à 75/90 % par la transcortine (Corticoid Binding Globuline, CBG) à laquelle il se lie de façon forte et spécifique, et par l’albumine avec une liaison peu spécifique et de faible affinité.
Les autres médicaments corticoïdes, de même que d’autres dérivés hormonaux de structure stéroïde, entrent en compétition sur ces sites de liaison.
Biotransformation : Le cortisol est presque complètement biotransformé, essentiellement dans le foie, avec disparition de la double liaison 4-5 du cycle A, et de nombreuses autres réactions de fonctionnalisation qui rendent le produit inactif; une glycuro ou sulfoconjugaison intervient ensuite en position 3.
Sur les dérivés synthétiques, un halogène en 9, une double liaison en 1-2 sur le cycle A, un groupement méthyle en 2 ou en 16 retarde la transformation et prolonge la demi-vie de 50 % environ.
Elimination : Les corticoïdes sont éliminés sous forme de dérivés inactifs dans les urines.
Indications :
Grand œdème anaphylactique, œdème de Quincke, urticaire.
Choc anaphylactique : administration classique mais peu ou pas efficace (le traitement essentiel est d’abord l’adrénaline).
Etats de mal asthmatique : généralement en association avec les beta 2 stimulants.
Indications diverses :
Maladies inflammatoires systémiques
Vascularites sévères
Dermatoses inflammatoires
Affections intestinales inflammatoires, réctocolique hémorragiques et maladie de crohn.
Anémie hémolytique auto immune.
Transplantation d’organe : pour éviter le rejet de greffe : de fortes doses de prédnisolone à côté d’un autre traitement immunosuppresseur.
VIII- Effets indésirables :
Effets indésirables en rapport avec les effets anti-inflammatoires :
les corticoïdes s’opposent au rôle bénéfique de l’inflammation physiologique : ils favorisent la survenue d’infections et ralentissent la cicatrisation
ils entravent le travail physiologique des fibroblastes, d’où l’amincissement de la peau et l’apparition de vergetures.
-Risque d’ulcère peptique.
Effets indésirables en rapport avec les effets immunodépresseurs :
Les corticoïdes favorisent:
La survenue d’infections localisées ou généralisées :(Tuberculose : aggravation si traitement antibiotiques absent).
Effets indésirables en rapport avec les effets hormonaux :
L’administration prolongée de corticoïdes entraîne l’apparition :
D’un syndrome cushingoïde (effets glucocorticoïdes)
De troubles du métabolisme des glucides (diabète) aggravation ou déclanchement.
Hyperlipidémie
Hypercatabolisme protéique : Des troubles osseux (ostéoporose, fractures, tassement vertébraux, nécrose aseptique de la tête fémorale.)
Lithiase urinaire par hypercalciurie, Hypokaliémie, avec crampes, accidents cardiaques (torsade de pointe).
Hypertension et accidents thromboemboliques
Effets cutanés : acné, folliculites bactériennes et autres pathologies infectieuses cutanéo-muqueuses.
Effets oculaires : cataracte postérieure sous capsulaire, glaucome à angle ouvert, kératite herpétique, endophtalmie purulente
Chez l’enfant arrêt de croissance.
IX-Contre indications et surveillance :
-Respecter les règles élémentaires de prescription.
-S’assurer de l’absence d’infection intercurrentes notamment d’une tuberculose, même ancienne ; si non s’assurer de l’efficacité de l’antibiotique associé.
-Eliminer les antécédents de :
-Ulcère gastroduodénale d’évolution récente et grave.
-Diabète (glycémie, glucosurie).
-HTA et accidents thromboembolique.
-Troubles psychique.
Eviter de prescrire chez la femme enceinte et chez l’enfant en croissance.
Dans les états infectieux toujours s’assurer de la maitrise du germe en cause et prendre garde aux surinfections.
-Conseiller un régime sans sel et riche en potassium, surveiller la TA, vérifier la tolérance la tolérance gastrique ; contrôler la prise de poids.
-Arrêter le traitement progressivement (le rôle de L’ACTH est controversé, son efficacité n’est pas établie et sa pratique n’est pas une obligation).
Interactions :
Ce sont des risques d’interactions que quelque connaissance pharmacologiques et beaucoup de bon sens permettent d’éviter :
Diminution des effets des glucostéroides :
Absorption par les topiques et autres pansement gastro- intestinaux
Inducteurs enzymatiques
Majoration des effets des glucocorticoïdes :
addition de médicaments hypokaliémiants ;
Majoration du risque de torsades en pointes, accentuation de la sensibilité digitaliques.
Addition de risques digestifs avec les AINS.

