Corticoïdes
Les anti-inflammatoires sont des médicaments qui peuvent réduire la douleur, l’inflammation et, dans certains cas, la fièvre.
Il existe deux principaux types d’anti-inflammatoires : les non stéroïdiens et les stéroïdiens.
Généralités sur les anti-inflammatoires stéroïdiens (corticoïdes endogènes)
Rappel physiopathologique de l’inflammation :
La réaction inflammatoire fait partie des mécanismes de défense de l’immunité naturelle.
Elle se caractérise par un trépied classique association douleur, chaleur et œdème.
Elle met en jeu :
une phase vasculaire, comportant la libération de différentes substances de défense et de substances vaso-actives qui augmentent la vasodilatation des capillaires ;
ensuite, une phase cellulaire qui se caractérise par le recrutement rapide de cellules phagocytaires qui vont pénétrer le site inflammatoire et assurer la phagocytose des agents pathogènes, ainsi que des cellules infectées ; en même temps il y aura une activation secondaire des cellules macrophagiques qui vont à leur tour également libérer des substances actives sur la phase vasculaire, participer à la phagocytose, initier la réponse immunitaire de type spécifique avec d’autres cellules présentatrices d’antigène.
Enfin la phase de réparation tissulaire met un terme au processus inflammatoire suite à la prolifération de fibroblastes.
Définition
Les corticoïdes sont des hormones stéroïdiennes, synthétisés par une glande appelée la glande surrénale.
Ces corticostéroïdes sont étudiés en distinguant 2 types d’activité :
Les minéralocorticoïdes
Comprennent la desoxycorticostérone (cortexone) et l’aldostérone.
Leur principale fonction est la régulation des concentrations d’électrolytes (sels minéraux) et particulièrement les ions sodium et potassium dans le sang et le milieu interstitiel.
Les glucocorticoïdes
Dont l’action porte sur le métabolisme du glucose et sur les phénomènes inflammatoires, d’où leur appellation anti-inflammatoire stéroïdien.
Les glucocorticoïdes endogènes comprennent : la cortisone, l’hydrocortisone, et la corticostérone.
Les glucocorticoïdes endogènes
Les glucocorticoïdes naturels sont synthétisés dans les glandes corticosurrénales.
Chez l’être humain, le cortisol représente le principal glucocorticoïde naturel.
Biosynthèse :
Dans les glandes surrénales, le cortisol est synthétisé à partir du cholestérol et par l’intermédiaire de la 17 hydroxy- progestérone il y aura transformation de l’hydroxypregnenolone, et la progestérone à un degré moindre, en cortisol.
Sécrétion du cortisol
La sécrétion du cortisol s’effectue par brèves décharges en rapport avec le mode de sécrétion pulsatile de l’ACTH, elle suit un rythme circadien nycthéméral qui est fonction du cycle veille sommeil, la sécrétion est maximal le matin (vers 8h du matin), minimal en fin de journée (vers 17 h du soir).
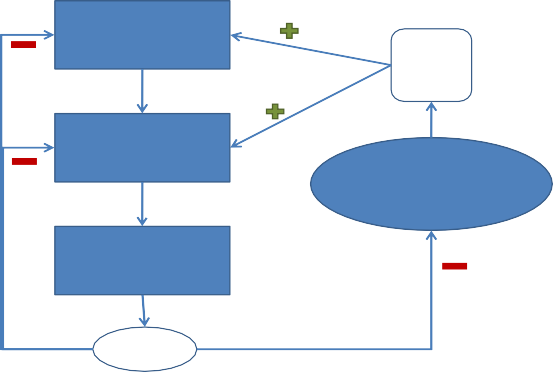
Hypothalamus
Neurones à CRH
CRH
IL-1 IL-2 IL-6 TNF-α
Antéhypophyse
Cellules corticotropes
ACTH
Système immunitaire Lymphocytes Macrophages/Monocytes Neutrophiles
Cortex surrénalien
Cellules fasciculées
Cortisol
Catabolisme :
Le catabolisme est principalement hépatique.
Cependant, environ 20% du cortisol est converti en cortisone par 11-hydroxystéroïde déshydrogénase dans les reins et autres tissus pourvus des récepteurs des minéralocorticoïdes avant d’atteindre le foie.
Le catabolisme hépatique se fait par une série de réaction d’hydrogénation :
réduction de la double liaison en 4-5 → dérivés dihydrogénés : cette étape donne naissance à des métabolites inactifs et peut être également extra-hépatique.
réduction de fonction cétone en 3 → dérivés tétra hydrogénés (tétrahydrocortisol): cette étape n’a lieu qu’au niveau du foie.
réduction de fonction cétone en 20 → dérivés hexa hydrogénés.
La plupart des métabolites obtenus seront ensuite conjugués à l’acide glucuronique ou à l’acide sulfurique au niveau hépatique et accessoirement au niveau des reins.
Elimination
L’excrétion est urinaire sous différentes formes :
Seulement 1% sous forme inchangée.
Environ un tiers de la production journalière de cortisol sous forme de métabolites dihydroxy cétone.
Majoritairement sous forme de glucurono et de sulfo conjugués.
Les récepteurs aux glucocorticoïdes
Deux types de récepteurs aux glucocorticoïdes existent dans l’organisme :
| Récepteur de type I | Récepteur de type II | |
| Ligand | Glucocorticoïde et minéralocorticoides | glucocorticoïdes |
| Fonction | Contrôle du rythme circadien de la sécrétion du cortisol | Réponse aux agressions (inflammation, stress) |
Ce récepteur, appartient à la superfamille des récepteurs aux stéroïdes, intracellulaires, ubiquitaire.
On distingue 3 domaines fonctionnels :
Domaine d’activation du gène (ou de régulation transcriptionnelle), ou domaine immunogénique
Domaine de liaison à l’ADN (appelé également domaine B).
Domaine de liaison au ligand (domaine C).
Dans le cytoplasme, ce récepteur est présent sous forme de complexe inactif, associé à d’autres protéines : les protéines de choc thermique (HSP90, HSP70) et l’immunophiline (IP).

Effets biologiques:
Effet hyperglycémiant.
Accroît la lipolyse au niveau du tissu adipeux.
Provoque la protéolyse.
Action anti-inflammatoire.
Simule l’erythropoièse et la thrombopoièse.
Effet sur le tissu conjonctif : inhibe la synthèse des protéines, de collagène, l’acide hyaluronique par les fibroblastes.
Favorise la déminéralisation osseuse.
Augmentation de la HTA et du débit cardiaque.
Effet natriurétique et augmente la kaliurèse.
Dépression, irritabilité.
Stimule l’absorption du Na+ au niveau du colon et augmente la sécrétion acide gastrique.
Effet sur la croissance et le développement :
Chez l’enfant : une interruption de croissance.
Fœtus : action sur la maturation pulmonaire.
Pharmacologie des glucocorticoïdes :
Classification des glucocorticoïdes :
Les corticoïdes naturels
Sécrétés par notre organisme à faibles doses et à un rythme circadien (la cortisone et le cortisol ou hydrocortisone et la corticostérone).
Les glucocorticoïdes de synthèse
Ils ont une activité majorée pour permettre une meilleure action anti-inflammatoire (prednisone, prednisolone, methylprednisolone, triamcinolone, fludrocortisone, déxaméthasone, bétaméthasone, cortivazol).
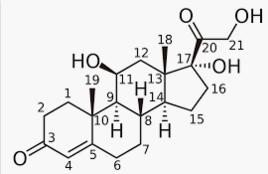
Relation structure activité
La structure générale des corticostéroïdes comporte un cycle stéroïdien C21.
Ces molécules sont caractérisées par des particularités structurales qui constituent la base de leur activité, toute modification au niveau de ces sites supprime l’activité biologique :
Une double liaison en C4-C5 ;
Une fonction cétone en C3 et en C20 ;
Un groupement hydroxyle (OH) en C11 ;
A partir de ce noyau de base, diverses modifications ont permis de moduler l’action de ces molécules, l’objectif de ces modifications est d’augmenter l’effet anti-inflammatoire en réduisant l’effet minéralocorticoides (rétention hydro sodée).
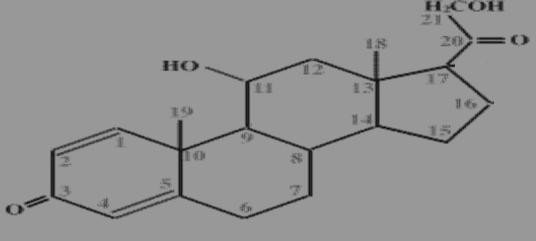
Cycle A
L’introduction d’une double liaison entre C1-C2 :
-Augmente l’activité anti-inflammatoire
-Diminue l’activité minéralocorticoides (rétention hydrosodée)
Ralentit le métabolisme hépatique Ex : prednisone, prednisolone.
Cycle B
La méthylation en C6, renforce légèrement l’activité anti-inflammatoire et diminue l’effet minéralocorticoides.
Ex : methylprednisolone
L’introduction d’un atome de fluor en C9 (fludrocortisone) et/ou en C6, augmente les activités glucocorticoïdes et minéralocorticoides
Cycle D
Une méthylation (déxaméthasone) ou une hydroxylation (triamcinolone) sur le carbone C16 réduit l’effet minéralocorticoide et ne modifie que peu l’activité anti-inflammatoire.
L’hydroxylation en C17 n’est pas indispensable mais augmente l’effet anti-inflammatoire.
Noyau stérone structure de base des GC
Mécanisme d’action des glucocorticoïdes
Interaction ligand – récepteur et translocation nucléaire
Seule la fraction libre du corticoïde est responsable de l’activité pharmacologique.
La molécule libre traverse la membrane cellulaire par diffusion passive puis elle se lie avec une forte affinité au récepteur.
La liaison du ligand sur le récepteur provoque :
La dissociation du complexe protéique ;
Activation et une dimérisation du complexe ligand-récepteur ;
L’ensemble ligand récepteur migre dans le noyau c’est la translocation nucléaire.
Action des glucocorticoïdes sur la transcription des gènes
Action transcriptionnelle directe
Le complexe ligand récepteur interagit avec des séquences spécifiques de l’ADN (ces séquences sont localisées sur la région promotrice du gène) et peut induire une régulation positive ou négative de la transcription :
Régulation positive : le complexe L-R entraîne une activation de la transcription génique.
Exemple : activation de la transcription des gènes codant pour les protéines anti-inflammatoire comme la lipocortine-1 (ou annexine-1), l’interleukine 10.
Régulation négative : le complexe L-R entraîne une inhibition de la transcription génique.
Exemple : inhibition de la transcription des gènes codant pour les protéines inflammatoire comme IL1, IL6, TNF&.
Action transcriptionnelle indirecte
Cette action passe par une interaction avec certaines protéines de régulation transcriptionnelle, appelées facteurs de transcription, dont font partie AP-1, NF-kB et NF-IL6.
Les propriétés pharmacologiques
Action anti-inflammatoire
Les GC limitent la vasodilatation et la perméabilité vasculaire ;
Ils inhibent la production de médiateurs de l’inflammation ;
Ils diminuent fortement le chimiotactisme et l’afflux leucocytaire vers le site inflammatoire (effet primordial) ;
Diminuent la capacité phagocytaire des polynucléaire et des macrophages.
Action immunosuppressive
Les GC interviennent à des niveaux multiples du processus immunitaire, directement par action sur la prolifération lymphocytaire ou indirectement par action sur le complément et les cytokines.
Action sur le métabolisme
Glucidique : ils entraînent une hyperglycémie,
Protéique : les GC inhibe la synthèse protéique, L’action catabolique protidique est à l’origine :
Au niveau des muscles : une diminution de la masse musculaire qui peut aller jusqu’à l’atrophie musculaire caractéristique de l’hypercorticisme (maladie de cushing).
Tissu osseux : atrophie du tissu conjonctif, ostéoporose chez l’adulte, arrêt de croissance chez l’enfant.
Lipidique :
Augmentation de la concentration d’acides gras libre suite à l’accroissement de la lipolyse,
Redistribution du tissu graisseux, en favorisant son accumulation au niveau du dos et du cou (nuque de bison), de la face (aspect en pleine lune) avec amaigrissement des extrémités.
Phosphocalcique :
Les GC entraînent une diminution de l’absorption intestinale du calcium, et une augmentation de son excrétion urinaire.
Diminution de la réabsorption tubulaire du phosphore.
Action sur l’équilibre hydroéléctrolytique
Bien que l’action soit moindre par rapport au minéralocorticoide, les GC entraînent :
Rétention hydro sodée par augmentation de la réabsorption tubulaire du sodium.
Action sur l’axe hypothalamo-hypophyse
Les GC synthétiques exercent un rétrocontrôle négatif sur l’axe HHS.
Les indications
Ils sont indiqués principalement pour :
Traitement substitutif en cas d’insuffisance surrénalienne ;
Traitement anti-inflammatoire et immunosuppresseur.
Indication substitutive
Insuffisance surrénalienne aigue, chronique et congénitale.
Indication non substitutive
-Maladie auto immune : Lupus érythémateux disséminé ;
Asthme bronchique, broncho-pneumopathie obstructive sévère ;
-En rhumatologie : polyarthrite rhumatoïde, rhumatisme articulaire aigu, arthrite, tendinites ;
-Affections intestinales inflammatoires, rectocolite hémorragique ;
-prévention des œdèmes cérébraux d’origine néoplasique ;
-Dermatose, érythrodermie, acné, eczéma de contact, psoriasis, urticaire ;
-En oncologie : Lymphome et leucémie myéloïde, prévention des vomissements au cours de la chimiothérapie ;
-En ophtalmologie : Inflammation de l’œil ;
-Transplantation d’organe : Pour éviter le rejet de greffe (prednisolone + autre traitement immunosuppresseur).
Les effets indésirables
Dépression du cortex surrénalien ;
Troubles métaboliques : rétention hydrosodée, hypokaliémie, hyperglycémie ;
Hypercatabolisme protidique à l’origine d’une faiblesse musculaire allant jusqu’à l’atrophie musculaire et l’ostéoporose avec apparition de fractures pathologiques ;
Obésité facio-tronculaire ;
Retard de la croissance chez l’enfant ;
Troubles rénaux : calculs rénaux par précipitation des ions calcium ou phosphate ;
Potentialisation du risque infectieux.
Contre-indications
Hypersensibilité à l’un des constituants ;
Infections bactériennes ou mycosiques non contrôlées par un traitement spécifique ;
Certaines viroses en évolution (herpès, hépatites, varicelle, zona) ;
Ulcère gastroduodénal évolutif ;
Vaccination par un vaccin vivant ;
La femme allaitante en raison d’un passage dans le lait.
les interactions médicamenteuses
| Médicament associé | Effet clinique de l’association |
| Anti-arythmiques susceptibles d’induire une torsade de pointe : bépridil, quinidine, sotalol, amiodarone. | Torsade de pointe favorisée par l’hypokaliémie |
| Hypokaliémiants : Diurétiques Hypokaliémiants | Risque accru d’hypokaliémie |
| Anti-hypertenseur | Baisse de l’efficacité de l’anti-hypertenseurpar rétention hydro sodée |
| AINS | Risque d’ulcère accru |
| Ciclosporine, tacrolimus, sirolimus | Potentialisation de l’effet immunosupresseur |
| Anti-diabétique oraux, insulines | Déséquilibre de la glycémie |

