Les Eléments du Groupe 16 (Les Chalcogènes).
Le groupe 16 est le quatrième (4ème) groupe du bloc P.
Il est constitué des éléments représentés dans le tableau ci-dessous :
Tableau I : Eléments du groupe 16 du tableau périodique.
| ELEMENT | SYMBOLE | M.A(g/mole) | SRUCTURE ELECTRONIQUE | ETATSD’OXYDATION |
| Oxygène | 😯 | 15.999 | 2He 2S22P4 | -II |
| Soufre | 16S | 32.065 | 10Ne 3S23P4 | -II ,+IV,+VI |
| Sélénium | 34Se | 78.96 | 18Ar 4S23d104P4 | -II ,+IV,+VI |
| Tellure | 52Te | 127.60 | 36Kr 5S24d105P4 | -II ,+IV,+VI |
| Polonium | 84Po | 209 | 54Xe 6S24f145d106P4 | -II ,+IV |
| Livermorium | 116Lv | 293 | 86Rn 7S25f146d107P4 | -II ,+IV |
Ce groupe forme la famille des chalcogènes, du grec chalkos : cuivre et gène : gennein engendrer.
Cette appellation est du au fait que le sélénium et le tellure accompagnent en général le cuivre dans ses minerais soufrés.
L’oxygène premier élément du groupe diffère des autres éléments du groupe aussi bien par les propriétés du corps simple O2 que par celles de ses corps composés.
Dans les conditions habituelles de température et de pression, dans leurs corps simples l’oxygène et le soufre sont des non métaux, le sélénium et le tellure sont des semi conducteurs et le polonium est un métal.
La configuration électronique nS2 nP4 privilégie les nombres d’oxydations NO :(- II), (+IV) et (+VI).
La chimie de l’oxygène est essentiellement celle des oxydes qui illustrent l’évolution de la liaison, du caractère ionique avec les éléments à bas NO jusqu’au caractère covalent avec les éléments à NO élevé (> IV).
L’oxygène fait beaucoup parler de lui avec le trioxygène, l’ozone dans le cadre du réchauffement de la planète et de la pollution.
La chimie du soufre a un caractère beaucoup moins ionique que celle de l’oxygène. les poids lourds de sa chimie sont le dioxyde de soufre SO2, le trioxyde de soufre SO3 et l’acide sulfurique H2SO4 qui occupe la première place parmi les grands produits chimiques industriels.
Le développement industriel d’un pays est déterminé
par sa consommation en soufre.
Le rôle joué par l’acide sulfurique dans l’élaboration des grands produits industriels est en effet primordial.
Le sélénium et le tellure ont des utilisations marginales à coté de leurs ainés.
Le polonium, radioélément, utilisé dans les systèmes de chauffage ultralégers pour les capsules spatiales.
ETAT NATUREL
L’abondance (en % massique) des chalcogènes dans l’enveloppe terrestre est représentée dans le tableau ci-dessous :
Tableau II : Abondance des Chalcogènes.
| O | S | Se | Te | Po |
| 49.4% | 5.10-2 % | 8.10-5 % | 1.10-6 % | / |
Oxygène
L’oxygène est l’élément le plus abondant de la croute terrestre.
Le dioxygène est le deuxième constituant de l’atmosphère terrestre (20.95 % vol) après le di azote (78.09 % vol).
L’ozone ou le trioxygène y est présent en quantité variable et très faible.
Le dioxygène est généré dans le processus enzymatique complexe de la photosynthèse qui met en jeu, l’eau, le dioxyde de carbone, la chlorophylle des plantes vertes selon l’équation globale :
n H2O + n CO2 (g) → h√, chlorophylle, enzymes→ n O2 (g) + (CH2O) n (glucides).
En dehors de l’air et des deux oxydes H2O et CO2, l’oxygène par l’intermédiaire des oxydes des éléments et de leurs combinaisons chimiques, est un constituant essentiel de nombreux sels tel que les carbonates (Calcaire : CaCO3) et les sulfates métalliques ainsi que de nombreuses roches silicatées.
Soufre
C’est un élément très répandu, aussi bien à l’état natif que combiné (sulfures et sulfates
essentiellement).
À l’état natif
C’est un solide de coloration jaune citron appelé “fleur du soufre” ; on le trouve généralement dans les régions volcaniques (Etats Unis , Sicile , Japon ).
Les mines de soufre natif de Sicile étaient le principal centre d’extraction du soufre avant 1914.
Le soufre natif est essentiellement récupéré à partir de gisements souterrains (golf du Mexique, Irak) par le procédé FRASCH.
La Pologne possède à MACHOW le plus important gisement au monde à ciel ouvert.
À l’état combiné
Sulfure d’hydrogène H2S, présent dans certains gisements de gaz naturels (lacq (France), canada).
Dérivés sulfurés, citons ceux dont les minerais sont les plus importants : pyrite FeS2, blende ZnS, galène PbS.
Leur grillage en présence d’air conduit au dioxyde de soufre, précurseur de la fabrication de l’acide sulfurique H2SO4.
Minéraux sulfatés tel : le gypse CaSO4, 2H2O qui joue un rôle important comme matière première du plâtre.
Sélénium
Elément natif rare, le sélénium est souvent présent en faible quantité dans les sulfures métalliques : pour des raisons d’analogie de taille quelque ions sulfures S2- sont remplacés dans le composé sulfuré par des ions séléniure Se 2-.
Les minéraux de sélénium sont rares : Citons la berzélianite Cu2Se et la tiemmanite HgSe.
Tellure
L’ion tellurure Te 2- a un rayon ionique trop grand pour pouvoir se substituer à l’ion sulfure S2-.
On le trouve très rarement à l’état natif ou dans ses minéraux tels la hessite Ag2Te ou la sylvanite Ag AuTe.
L’un des minerais les plus importants de tellure est la nagyagite, mélange de sulfures et tellures iso structuraux de plomb, or, cuivre argent et antimoine.
Polonium
Tous ses isotopes sont radioactifs ,209Po étant le plus stable (T=102ans).
Le polonium 210 est le plus abondant des isotopes du polonium.
Sa demi-vie est de 138,376 jours.
Il a été découvert en 1898 par Marie Curie.
Ce radionucléide naturel et toxique n’est présent dans l’air et l’eau qu’à l’état de traces, mais il est omniprésent dans l’environnement terrestre ou il est généralement conjointement trouvé avec ses deux précurseurs directs (radon 222, plomb 210) notamment dans les minerais d’uranium et les gisements de phosphates.
OBTENTION
Dioxygène O2 : est obtenu soit :
Dans l’industrie :
– Par électrolyse de l’eau acidulée par l’acide sulfurique : c’est encore le procédé industriel utilisé dans les pays ou l’électricité est bon marché (Norvège) ; le procédé fournit O2 très pur qui se dégage à l’anode siège de l’oxydation.
Réduction à la cathode : 2H+(aq) +2é → H2(g)
Oxydation à l’anode : 2H2O(l) → O2(g) +4H+ (aq) +4é
2H2O(l) → 2H2(g)+O2(g)
Par distillation fractionnée de l’air liquéfiée (N2, O2 et gaz nobles).
Tous ces gaz sont obtenus très purs.
Au laboratoire :
Par décomposition thermique des oxydants comme : KClO4, KMnO4 ou les nitrates.
Ex : KClO4 (s) (150°c,MnO2) → 1/2 O2(g) + KClO3(s)
150°c
2KClO3 (S) → 2KCl(S) + 3 O2(g)
MnO2
L’oxygène obtenu est moins pur contenant souvent des traces de Cl2 et de ClO2.
Soufre : est obtenu industriellement par :
Deux (02) procédés sont utilisés principalement ; le procédé de Frasch traditionnellement et le procédé de Claus :
Procédé de Frasch: Il permet l’extraction du soufre à partir des dépôts naturels : le soufre est fondu par injection d’une vapeur d’eau surchauffée (440 K, sous pression).
Poussé par la vapeur et de l’air comprimé, le soufre liquide est remonté en surface par des tubes, il est ensuite déversé dans de vastes bassines en terre ou il se solidifie.
Ce procédé est actuellement en déclin.
Procédé de Claus :
La récupération du soufre à partir du raffinage du pétrole et du gaz naturel, qui est devenu le procédé prédominant pour des raisons d’environnement.
Dans le gaz naturel la source de soufre est le H2S dont la concentration peut atteindre 30%, on récupère donc le soufre par la réaction suivante :
Catalyseur charbon actif 2H2S+O2 → 2S+2H2O
ou alumine
Il s’agit donc d’une oxydo-réduction entre H2S et le dioxyde de soufre :
Oxydation partielle au tiers de H2S , à 100°C selon :
H2S +3/2 O2 → H2O + SO2.
Cette réaction s’accompagne partiellement de la formation du S°.
Oxydation catalytique vers 300°C , en présence d’alumine Al2O3 ou de rutile TiO2du reste (2/3) de H2S par SO2 :
SO2 + 2H2S → 2H2O +3 S°.
La fabrication de l’acide sulfurique, le soufre étant un produit secondaire.
NB : le Canada et les USA (Texas, louisiane) sont les plus gros producteurs mondiaux du soufre.
Sélénium et tellure
Ils sont préparés à partir des minerais sulfurés qui sont oxydés a l’état d’acide sélénieux ( H2SeO2) et tellureux ( H2TeO2 ); qui sont ensuite réduits par l’anhydride sulfureux (SO2).
Le sélénium et le tellure précipitent.
PROPRIETES PHYSIQUES GENERALES
Tous les éléments du groupe 16 possèdent 2 électrons « S » et 4 électrons « P » dans leurs orbitales externes.
Si on ne tient pas compte des niveaux plus internes remplis, on peut écrire leur structure (nS2 nP4).
Ils tendent vers la structure des gaz inertes par gain ou mise en commun de deux électrons.
Ces éléments vont former des liaisons ioniques mais dans certains composés les liaisons peuvent être covalentes.
Nombre d’oxydation : Les états d’oxydations rencontrées principalement sont :
–II, +IV et +VI.
L’oxygène ne présente jamais de valence supérieure à (-II) car sa deuxième couche électronique est limitée à 8 électrons.
Les éléments S, Se, Te et Po ayant des orbitales d disponibles peuvent former 4 ou 6 liaisons par partage d’électrons.
Avec l’oxygène on obtient des éléments tétravalents (état +IV), avec le fluor on a l’état (+VI).
Etat fondamental : deux électrons non appariés peuvent former deux liaisons (hybridation sp3), structure tétraédrique avec deux sommets occupés par des doublets libres.
S p d
↑↓
| ↑↓ | ↑ | ↑ |
Etat excité : quatre électrons non appariés peuvent former quatre liaisons (hybridation sp3d) bipyramide trigonale avec un sommet occupé par un doublet non partagé.
S p d
↑↓
| ↑ | ↑ | ↑ |
| ↑ |
Etat encore plus excité : six électrons non appariés peuvent former six liaisons (hybridation sp3d2) structure octaédrique.
S p d
↑
| ↑ | ↑ | ↑ |
| ↑ | ↑ |
Ces états d’oxydation les plus élevés deviennent moins stables quand on descend dans le groupe.
L’état (+IV) possède des propriétés oxydantes et réductrices mais à l’état (+VI) les composés sont uniquement oxydants.
Corps simples
Les propriétés des corps simples constitués des éléments du groupe 16 sont très différentes entre le chef de file du groupe, l’oxygène et les autres éléments.
Comme au groupe 15, le premier corps simple du groupe (O2) est gazeux, par contraste avec tous les autres qui sont des solides à l’ambiante.
Le trio « S, Se, Te » fait le pendant aux trois éléments « P , As, Sb » du groupe 15.
Le polonium est plus métallique que le bismuth.
Tableau III : Quelques propriétés physiques des éléments du groupe 16.
| Propriétés | O | S | Se | Te | Po |
| Numéro atomique Z | 8 | 16 | 34 | 52 | 84 |
| Configurationélectronique à l’état fondamental | 2He 2S2 2P4 | 10Ne 3S2 3P4 | 18Ar4S23d104P4 | 36Kr5S2 4d105P4 | 54Xe6S24f145d106P4 |
| Point de fusion /K | 54 | 388 | 494 | 725 | 527 |
| Point d’ébullition/K | 90 | 718 | 958 | 1263 | 1235 |
| Energie depremière ionisation KJ/mol | 1314 | 999.6 | 941.0 | 869.3 | 812.1 |
| Rayon covalent /pm | 73 | 103 | 117 | 135 | 145 |
| Rayon ionique/pm | 140 | 184 | 198 | 211 | – |
| Electronégativité depauling X | 3.4 | 2.6 | 2.6 | 2.1 | 2.0 |
| Potentiel standardE°(V) | O2(g)/H2O1.23 | S(s)/S2-(aq)-0.48 | Se(s)/Se2-(aq)-0.92 | Te(s)/Te2-(aq)-1.14 |
Conductibilité électrique
Le caractère non métallique des chalcogènes décroit au fur et à mesure qu’on descend dans le groupe.
L’oxygène et le soufre sont des non métaux (isolants), le sélénium et le tellure sont des semi métaux (semi conducteurs) et le polonium lui seul dans le groupe qui présente un caractère métallique (conducteur).
Point de fusion et d’ébullition
Augmentent en allant de l’oxygène vers le tellure.
Une baisse de température au niveau du polonium.
Le polonium fond plus bas que le tellure de la même façon que le bismuth fond plus bas que le Sb, c’est l’effet du changement dans la nature de la liaison : la liaison à caractère métallique n’est pas très forte en raison du caractère très diffus des OA pour ces éléments très lourds.
Le polonium bout à une température inférieure à celle de Te infini car l’espèce gazeuse est monoatomique.
Rayons atomiques et ioniques
Les dimensions des atomes et des ions sont croissantes en descendant dans le groupe 16 et sont inférieures à celles des éléments des groupes précédents notamment le groupe 15.
Potentiel standard
Les valeurs des potentiels standards mettent clairement en évidence le caractère très oxydant du dioxygène en milieu acide et le caractère réducteur des autres corps simples.
Energie d’ionisation
Les énergies d’ionisation diminuent régulièrement dans le groupe par n croissant au fur et à mesure que l’électron périphérique s’éloigne du noyau.
Electronégativité
Les valeurs des électronégativités diminuent en descendant dans le groupe en allant de l’oxygène le plus électronégatif vers le polonium le plus électropositif.
Polymorphisme
C’est la propriété que possèdent certaines substances de présenter plusieurs formes cristallines, différentes selon les conditions de température et de pression.
Lorsque la substance est un corps simple on parle d’allotropie.
Dans ce groupe tous les éléments présentent des formes allotropiques.
L’Oxygène : O2 et O3.
Le soufre : L’allotropie du soufre est très compliquée.
Le soufre a une forte tendance à la caténation qui conduit à la formation de cycles de tailles diverses et de chaines.
Les allotropes de structures connues comprennent les cycles S6, S7, S8….S12,S18 et S20, (tous ayant des structures plissées) et le soufre fibreux caténa S infini .
L’allotrope le plus stable est le soufre orthorhombique (forme alpha et état standard du corps simple) et il se trouve à l’état naturel sous la forme de grands cristaux jaunes dans les régions volcaniques. À 367.2 k la forme alpha se transforme réversiblement en soufre monoclinique (forme béta).
Les formes alpha et béta contiennent toutes les deux des cycles S8.
Le soufre rhomboédrique (la forme p) comprend des cycles S6.
Le sélénium et le tellure
Le sélénium présente dans l’état solide plusieurs allotropes :
Le sélénium rouge cristallin monoclinique : Existe sous trois formes qui contiennent toutes des cycles Se8 avec la conformation en couronne de S8 (des anneaux cyclo octasélénium).
Le sélénium noir est constitué de grands cycles polymériques.
Le sélénium gris c’est l’allotrope thermodynamiquement stable qui contient des chaines hélicoïdales infinies Se-Se (des chaines caténa polysélénium formant des hélices) dont les axes sont parallèles.
C’est une forme métallique à température élevée.
Le tellure solide blanc n’a qu’une forme cristalline qui est isostructural du sélénium gris.
Polonium : Les chaines n’existent plus dans le métal polonium. le polonium dans sa variété allotropique alpha cubique est le seul exemple connu d’un métal cristallisant dans le système cubique.
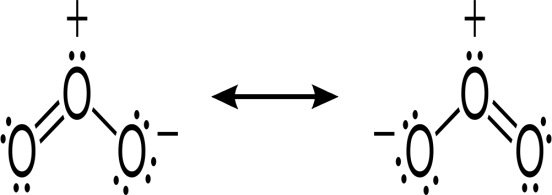
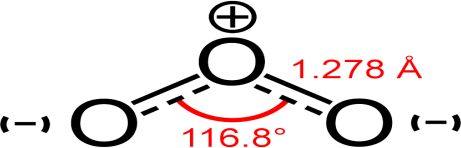
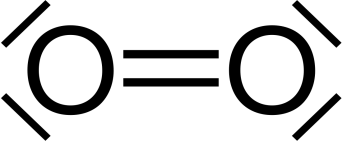
Fig1.a : Structure de la molécule d’ozone.
Fig1.b : Structure de la molécule d’oxygène.
Figure1 : Représentation des structures des allotropes de l’oxygène : O2 et O3.

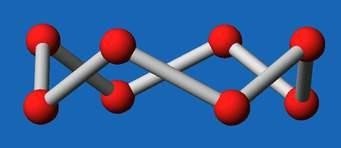
Fig2.a : Structure de S6
en chaise.
Fig.2.b : Structure de S8 en couronne.
Figure2 : Représentation des structures de certains allotropes du soufre : S6 , S8.
PROPRIETES CHIMIQUES
Action de l’hydrogène
Tous les éléments forment des hydrures divalents volatiles de type H2O, H2S, H2Se H2Te et H2Po.
Les hydrures de S, Se et Te s’obtiennent par action des acides sur les sels métalliques correspondants, ex :
FeS + H2SO4→H2S + FeSO4
Le poloniure n’a été décelé qu’à l’état de trace en traitant un mélange de magnésium et polonium par un acide dilué.
Les hydrures se dissocient à des degrés divers en donnant l’ion H+.
Ce sont tous des acides très faibles.
H2S → H+ + HS– HS- → H+ + S2-
L’oxygène et surtout le soufre diffèrent du reste du groupe par leur aptitude à former des chaines de poly oxydes et de polysulfures moins stables que les sels normaux.
H2O2 → H-O-O-H H2S2 → H-S-S-H H2S3→H-S-S-S-H H2S4→H-S-S-S-S-H
H2O2 et H2S2 ont des structures analogues et s’obtiennent par addition d’un acide à un peroxyde ou à un persulfure :
BaO2+ 2HCl→H2O2+BaCl2 Na2S2+2HCl→H2S2+2NaCl
Action des halogènes
Tous les halogènes réagissent avec les éléments du groupe 16.
Tableau IV : Action des halogènes sur le groupe 16.
| Fluor | Chlore | Brome | Iode | ||||
| Oxygène | O2F2 ; OF2 | Cl2O ; ClO2 ; Cl2O6 ; Cl2O7 | Br2O ; BrO2 ; BrO3 | I2O2 ; I4O9 ; I2O5 | |||
| Soufre | S2F2 SF6 | SF4 S2F10 | S2Cl2 SCl4 SCl2— | – | S2Br2——— | ——- | ———– |
| Sélénium | Se2F2 SeF4 SeF6 | —– | Se2Cl2 SeCl4——- | —- | Se2Br2 SeBr4—– | – | ———— |
| Tellure | ——- TeF4TeF6g Te2F6 | ——TeCl4TeCl2 —- | —-TeBr4 TeBr2 | TeI4 |
| Polonium | ——- | —–PoCl4PoCl2 —– | —-PoBr4PoBr2 — | PoI4 |
Le fluor
Fait apparaitre la valence maximale +VI pour S, Se, Te, on obtient donc : SF6 SeF6 TeF6 par combinaison directe.
Il s’agit de Gaz incolores, leur structure est octaédrique par hybridation Sp3d2.
Structure électronique du soufre à l’état excité, six électrons non appariés peuvent former six liaisons avec six atomes de fluor (hybridation sp3d2), structure octaédrique.
S p d
↑
| ↑ | ↑ | ↑ |
| ↑ | ↑ |
SF6 est inerte chimiquement.
SeF6 est légèrement plus réactif.
Tef6 est réactif il est hydrolysé par l’eau, ce fait s’explique peut être par la plus grande dimension du tellure qui favorise le nombre de coordination plus élevé nécessaire dans la première étape d’hydrolyse.
TeF6 +6H2O→6HF+H6TeO6
NB : Le fluor, l’élément le plus électronégatif du tableau périodique fait apparaitre la valence +II avec l’oxygène (OF2) étant l’élément le plus électronégatif du groupe 16 et son électronégativité n’étant pas éloignée de celle du fluor.
Le chlore
SCl2 le di halogénure le mieux connu, les di halogénures forment des molécules angulaires à cause de l’hybridation sp3 mais l’angle du tétraèdre régulier est déformé par la présence de deux doublets électroniques non partagés.
Deux électrons non appariés peuvent former deux liaisons (hybridation sp3), structure tétraédrique avec deux sommets occupés par des doublets libres.
S p d
↑↓
| ↑↓ | ↑ | ↑ |
Les tétrachlorures de S, Se, Te et Po se forment par réaction directe avec le chlore qui fait apparaitre la valence +IV de ces éléments.
Hybridation Sp3d1
Quatre électrons non appariés peuvent former quatre liaisons avec 4 chlores (hybridation sp3d1) bipyramide trigonale avec un sommet occupé par un doublet non partagé.
S p d
↑↓
| ↑ | ↑ | ↑ |
| ↑ |
En présence d’acide chlorhydrique, TeCl4 donne l’ion complexe [TeCl6]2-
TeCl4+2HCl → H2 [TeCl6]
Le brome
On connait des tétrabromures de Se Te et Po.
Le SeBr4 est instable et s’hydrolyse rapidement :
2SeBr4→ Se2Br2+3Br2 SeBr4+ 4H2O→ [Se(OH) 4] + 4HBr
Instable H2SeO3+H2O
L’iode
Seul le Te et Po forment des tétraiodures.
NB : Certains mono halogénures peuvent se former et se dimé riser juste par la suite comme S2F2, Se2Cl2 et Se2Br2.
Ils s’hydrolysent lentement et tendent à se dis muter.
2S2F2+2H2O→4HF+SO2+3S
2Se2Cl2→SeCl4+3Se
Action de l’oxygène :
Les éléments du groupe 16 donnent de nombreux oxydes :
On connait les monoxydes de soufre SO (instable qui a tendance à se dimé riser S2O2), de tellure TeO et du polonium PoO.
Le chauffage des éléments à l’air donnent des dioxydes SO2, SeO2, TeO2, PoO2 :
La structure de SeO2 gazeux est analogue à celle de SO2.
SeO2 est solide à température ordinaire, et forme des chaines indéfinies tridimensionnelles.
TeO2 et PoO2 cristallisent sous deux formes ioniques ;
-Les trioxydes de soufre, de sélénium et de tellure sont des anhydrides d’acides :
SO3+H2O→H2SO4 acide sulfurique SeO3+H2O→H2SeO4 acide sélénique
TeO3+H2O→H2TeO4acide tellurique
Les oxyacides de soufre sont les plus nombreux et les plus importants que ceux du Se et Te.
A température ambiante SO3 est un solide et existe sous trois formes distinctes.
L’une ressemble à la glace et est un trimère cyclique (SO3)3.
Les deux autres semblables à l’amiante contiennent l’une des chaines hélicoïdales indéfinies et l’autre des chaines cycliques.
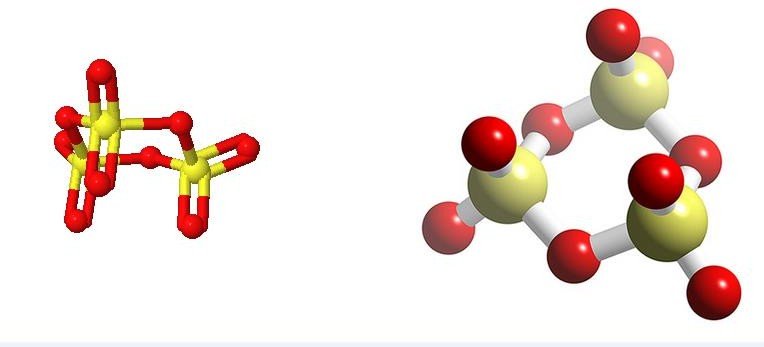
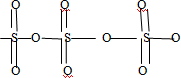
Figure 3 : SO3 en chaines
Figure4 : SO3 trimérisé
Les oxydes les moins oxygénés et leurs sels sont des réducteurs.
Les plus oxygénés et leurs sels sont des oxydants.
Partie II
ETUDE DES COMPOSES
Oxygène et ses Dérivés
Dioxygène
Le plus important des corps purs simples formés avec l’oxygène est le dioxygène O2.
Le dioxygène est comme l’élément oxygène très abondant.
L’atmosphère qui correspond sensiblement à un mélange O2+4N2, est en effet, une source naturelle quasi inépuisable de dioxygène.
Le dioxygène est par ailleurs très réactif.
Il peut se combiner avec tous les éléments, sauf l’hélium le néon et l’argon.
Cette abondance et cette réactivité justifient la création ancienne du concept d’oxydation.
Cette réactivité est liée à la fois à la forte électronégativité de l’élément oxygène et à la relative faiblesse de l’énergie de liaison dans la molécule O2.
Préparations
Par électrolyse de l’eau acidulée par l’acide sulfurique.
Par distillation fractionnée de l’air liquide.
La température d’ébullition de O2 est > à celle de N2, le di azote plus volatil passera en tête lors de la distillation, puis l’argon (gaz noble) et enfin l’O2.
Tous ces gaz sont obtenus très purs.
A partir des oxydes métalliques qui sont décomposés par la chaleur :
T°↑
2HgO → 2Hg+O2
Par hydrolyse du peroxyde de sodium :
2Na2O2(s)+2H2O → O2(g) + 4 NaOH(aq)
Par décomposition thermique vers 150°C du chlorate de potassium KClO3 en présence de MnO2 catalyseur :
2KClO3(s) →3O2(g) + 2KCl(s)
Le dioxygène contient souvent des traces de dichlore Cl2 et de dioxyde de chlore ClO2.
Il s’agit d’une manipulation dangereuse (Les chlorates sont des explosifs potentiels).
La décomposition catalytique (en présence de CO2+) des hypochlorites est également utilisée :
2 HClO(aq)→ 2(H+,CL–) (aq) +O2(g)
Propriétés physiques
Le dioxygène est dans les conditions usuelles de température et de pression, un gaz incolore, inodore et insipide, sa densité par rapport à l’air est 1,1.
Sa solubilité dans l’eau est d’environ 30cm3/l à 20°C et sous une (1) atmosphère, permet la vie aquatique.
Le dioxygène solide bleu pale fond à -219°C et le liquide, également bleu pale bout sous une atmosphère à -183°C.
Ces valeurs correspondent à des forces intermoléculaires faibles donc à un comportement de gaz voisin de l’état parfait.
Propriétés chimiques
L’oxygène possède une grande activité chimique avec formation d’oxydes, il s’unit facilement aux éléments électropositifs : Hydrogène, métaux alcalins et métaux alcalinoterreux.
Les combinaisons directes sont souvent vives accompagnées de phénomène lumineux Ex : inflammation du phosphore blanc
4P+5O2 → 2P2O5
Enflammé à l’air, le soufre brule dans l’oxygène
S+O2 → SO2
Il en est de même pour le carbone
C+O2→CO2
Il existe deux classifications possibles des oxydes ; l’une fondée sur la réactivité acido- basique des oxydes, l’autre sur leurs caractéristiques structurales :
Classification chimique : Réactivité acido-basique des oxydes
Les métaux peu électronégatifs notamment les alcalins et les alcalinoterreux donnent des oxydes basiques : Li2O, CaO .
Les non métaux fortement électronégatifs donnent des oxydes acides : SO3, CO2.
Quelque éléments essentiellement semi métalliques donnent des oxydes dits amphotères se comportant selon les circonstances comme des oxydes basiques ou comme des oxydes acides : ZnO, Al2O3, BeO.
Enfin quelque oxydes n’ayant pas de réactivité acido-basique sont catalogués comme des oxydes indifférents ou neutres : CO, N2O.
Classification structurale
Oxydes ionique
L’oxygène très électronégatif donne avec les métaux (de faible électronégativité) des oxydes à caractère ionique marqué, pouvant être considérés à la limite comme des composés ioniques : MgO ou Mg2+ O2-.
Oxydes moléculaires ou macromoléculaires
Avec les non métaux les liaisons sont à caractère éssentiellement covalent conduisant selon les éléments concernés à des oxydes moléculaires par ex : CO2, P4O6, P4O10 ou à des oxydes macromoléculaires polymérisés :
En chaines D Sb2O3, SeO2.
En feuillets 2D As2O3, SnO.
En édifices tridimentionnels 3D SiO2.
Etude du trioxygène O3 (L’ozone)
Même s’il apparaît instable et qu’il a tendance à se décomposer en dioxygène, l’ozone est naturellement présent dans l’atmosphère terrestre.
Dans la haute atmosphère, la stratosphère, il forme ce que l’on nomme la couche d’ozonequi protège la Terre de la majorité du rayonnement ultraviolet du soleil.
On parle alors de bon ozone.
Certains gaz, comme les CFC , les chlorofluorocarbones, ont la fâcheuse tendance à catalyser la transformation de l’ozone en dioxygène.
C’est l’origine du trou de la couche d’ozone.
On trouve aussi de l’ozone dans la basse atmosphère, la troposphère.
Son origine peut être plutôt naturelle lorsqu’il émane de feux de forêt par exemple.
Mais elle peut aussi être plus directement anthropique lorsqu’il émane de gaz d’échappement ou de solvants.
Et dans la basse atmosphère, l’ozone se transforme en un véritable polluant.
Il est en effet alors nuisible à notre système respiratoire notamment, mais il peut aussi provoquer, par exemple, des irritations oculaires. Pour des concentrations de 50 ppm, l’ozone devient même mortel en quelques minutes seulement.
Figure 5 : Structure chimique de la molécule d’ozone.
Préparation
L’Ozone est obtenu usuellement par une décharge électrique dans le dioxygène sec sous forme d’un mélange de 10% environs d’ozone.
Propriétés Physiques
À température ambiante, l’ozone, de formule O3 et parfois appelé trioxygène. c’est un gaz dont les molécules se composent de trois atomes d’oxygène.
Il est quasiment incolore même s’il peut être perçu par une couleur bleutée,
Il dégage une odeur caractéristique proche de celle de l’eau de Javel dès une concentration de 0,01 ppm.
D’où son nom dérivé du grec (ozein : sentir) signifiant
« exhaler une odeur ».
La liquéfaction fractionnée permet d’obtenir O3 pur.
Le liquide bleu foncé (T eb :- 112°C) et le solide bleu violet (T f=-193°C) sont instables et explosifs.
Propriétés Chimiques
En effet, O3 est thermodynamiquement instables par rapport à O2 :
O3 (g) → 3/2O2(g) ∆rH298= -142.7 Kj.mol-1 < 0 réaction exothermique, spontanée
Mais la décomposition spontanée de O3(g) en l’absence de catalyseur ou de rayons ultraviolets reste lente.
L’ozone est un oxydant très énergique aussi bien en milieu acide que basique : O3+ 2H+(aq) + 2é ↔ O2 + H2O couple O3/H2O : E°= 2.07V
O3 + H2O + 2é ↔ O2 + 2OH– couple O3/OH– : E°=1.24V
Par exemple O3 peut oxyder quantitativement l’ion iodure I–, d’où possibilité de dosage ;
I2 + 2é → 2I– : couple I2/I– : E°= 0.62V
Soit au total :
O3 + H2O + 2I– → I2 + O2 + 2OH–
Étude de l’eau oxygénée H2O2
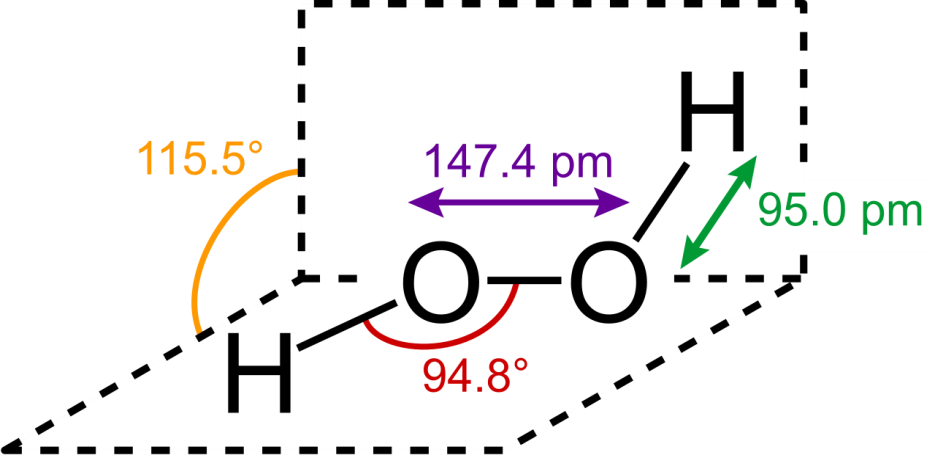
Figure 6 : Structure chimique du peroxyde d’hydrogène, paramètres géométriques à l’état gazeux.
Préparations
Oxydation par l’air de l’éthyl hydro anthraquinone.
Il se forme de l’éthyl anthraquinone et de l’eau oxygénée, on retourne à l’éthyle hydro-anthraquinone par réduction par H2/Pd.
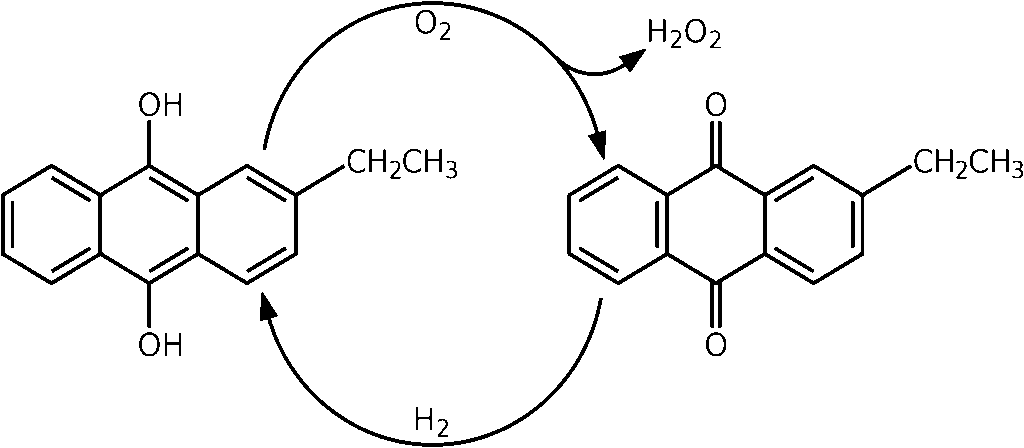
Figure 7: Production du peroxyde d’hydrogène par le procédé à l’anthraquinone.
Le peroxyde d’hydrogène est ensuite extrait avec de l’eau ; dans une seconde étape, il est séparé par distillation fractionnéede l’eau.
Le peroxyde d’hydrogène s’accumule sous forme de puisard de produit.
L’anthraquinone agit comme un catalyseur, la réaction générale de l’équation est donc :
H2 + O2 → H2O2
Un autre procédé (Schell) repose sur l’oxydation de l’iso-propanol en acétone et H2O2 en phase liquide ou gazeuse à 100°C sous pression (15à20 bars).
OH O2 CH3 C H3
CH3 C H
CH3 C OOH
CH3 C O + H2O2 CH3 100° OH
Isopropanol Acétone
Le mélange obtenu est fractionné par distillation.
Dans l’industrie on décompose par l’eau le peroxysulfate d’ammonium (NH4)2S2O6 par H2SO4.
On peut traiter l’oxylithe Na2O2 par H2SO4 diluée.
– Na2O2 + H2SO4 → BaSO4 + H2O2
On peut l’obtenir à partir du peroxyde de baryum (c’est la méthode la plus ancienne)
– BaO2 + H2SO4 → BaSO4 + H2O2.
–
Propriétés physiques
Le peroxyde d’hydrogène H2O2 est à l’état pur un liquide bleu pale légèrement visqueux en raison d’association par liaison hydrogène miscible à l’eau en toute proportions.
Ses principales constantes physiques sont les suivantes :
Température d’ébullition : 150.2°C
Température de fusion -0.43°C
Masse volumique : 1.44gcm-3 à 25°C.
H2O2 est un bon solvant ionisant mais son instabilité et son fort pouvoir oxydant limitent ses possibilités dans ce domaine.
Propriétés chimiques
1) Stabilité
H2O2 est un composé endothermique peu stable :
2 H2O2 → 2 H2O + O2
La décomposition devient importante en milieu alcalin et en présence de catalyseurs comme l’argent, platine.
2) Pouvoir oxydant
H2O2 peut capter deux électrons c’est ainsi qu’il oxyde en milieu acide :
Les sels ferreux en ferriques : Fe2+→Fe3+
Les sels stanneux en stanniques : Sn2+→Sn4+
Le chlore, brome et iode sont libérés de leurs halogénures en milieu acide.
H2O2+2H+ (aq) +3I– (aq) → I2 + I– + 2H2O
Pouvoir réducteur
Mais seulement en présence d’oxydants puissants :
2MnO4-+6H+ (aq) +5H2O2 → 2Mn2++8H2O+5O2 (réaction qui peut également servir au dosage de H2O2)
H2O2 réduit les sels d’or en or métallique, l’oxyde mercurique en mercure.
Formation de peroxyhydrates
H2O2 peut se fixer sur certaines molécules comme de l’eau de cristallisation. on obtient des composés qui possèdent les propriétés de l’eau oxygénée.
Ex : Le métasilicate peroxyhydrate : Na2SiO3 2H2O2 H2O.
Dérivés de H2O2
Par substitution de 1 ou 2 atomes d’hydrogène, on obtient des dérivés importants.
Les peroxydes sont caractérisés par O O
Ces peroxydes vrais libèrent H2O2 en milieu acide, on les rencontre dans le groupe 1 et 2. Ex : Li2O2, Na2O2, CaO2 .
Les peroxyacides sont obtenus par remplacement de l’un des deux hydrogènes par un reste d’acide par ex : –SO3H.
Soufre et ses dérivés
Soufre natif
Préparations
Le soufre natif est depuis longtemps extrait par le procédé frasch par fusion après inflammation d’une partie de la masse :
Dans la louisiane le soufre est fondu par injection de vapeur d’eau surchauffée.
Poussée par la vapeur et de l’air comprimé le soufre liquide est remonté en surface par des tubes .Il est déversé dans de vastes bassins en terre ou il se solidifie.
On extrait du soufre des gaz à partir de H2S.
Le soufre brut impur peut être purifié par sublimation en fleur de soufre.
Propriétés physiques
Le soufre est solide à l’état ordinaire existant sous plusieurs variétés allotropiques : cyclooctasoufre S8 orthorhombique (Voir Polymorphisme du soufre).
Solubilité : Insoluble dans l’eau, le soufre se dissout dans un certain nombre de solvants organiques (sulfure de carbone CS2, benzène C6H6).
Conductibilité thermique : Le soufre est un mauvais conducteur de la chaleur.
Propriétés chimiques
Le soufre se combine à la plupart des éléments même à température peu élevée.
Le soufre vaporisé à chaud se combine à l’hydrogène : S + H2 → H2S
Le fluor, le chlore réagissent vivement en donnant SF6, S2Cl2,, SCl4.
Le soufre enflammé brule dans l’oxygène en donnant l’anhydride sulfureux SO2.
Le carbone chauffé au rouge avec de la vapeur de soufre donne le sulfure de carbone
CS2.
Tous les métaux sauf les métaux précieux or et platine sont attaqués par le soufre.
Le cuivre ou le fer en tournures brule dans la vapeur de soufre.
Propriétés réductrices
Étant avide d’oxygène le soufre est réducteur. À chaud :
H2SO4 est réduit en anhydride sulfureux.
2H2SO4 + S → 3SO2 + 2H2O
HNO3 est réduit et le soufre est oxydé en H2SO4.
6 HNO3 + S → H2SO4+6NO2+2H2O
Dérivés du soufre
Dérivé hydrogéné : Hydrogène sulfuré ou sulfure d’hydrogène H2S (Soufre au degré d’oxydation :-II)

Figure8 : Sulfure d’Hydrogène.
Il s’agit d’un produit naturel de la décomposition de la matière soufrée et il est présent dans les mines de charbon, les gisements de gaz et les sources sulfureuses.
Il est très toxique (Plus toxique que HCN).
Préparations
L’hydrogène sulfuré est préparé dans un laboratoire par décomposition des sulfures métalliques par un acide. (Dans un appareil de Kipp) :
FeS(s) + 2HCl (aq) → FeCl2 (aq) + H2S(g)
Un lavage à l’eau élimine les traces HCl entrainées.
Le sulfure d’antimoine Sb2S3 attaqué à chaud par HCL donne du H2S pur.
Sb2S3 + 6HCl → 2SbCl3 + 3H2S
L’hydrolyse des sulfures de calcium ou de baryum, donne un H2S plus pur :
CaS + 2H2O → H2S + Ca(OH)2
On peut aussi obtenir un produit pur par combinaison directe de l’hydrogène et du soufre vers 600°C.
Propriétés physiques
C’est un composé covalent, moléculaire non associé comme l’eau par des liaisons hydrogène donc c’est un gaz incolore à odeur d’œufs pourris, on détecte facilement sa présence.
Dans les conditions usuelles, T fusion= -85°C, T ébullition= -60°C.
Légèrement soluble dans l’eau.
Ses solutions aqueuses sont utilisées en analyse comme réactif sulfurant.
H2S (g) ↔ H2S (aq), K=1
Propriétés chimiques
Propriétés réductrices
En milieux aqueux il y’a libération de soufre :
H2S réagit ainsi avec le chlore, le brome, moins vivement avec l’iode avec dépôt de soufre.
H2S aq + Cl2 → 2HCl + S
Les oxydants habituels en milieux aqueux (KMNO4-, FeCl3) sont réduits.
En présence d’oxydants énergiques le soufre peut être oxydé en soufre tétravalent (+IV).
A l’état gazeux H2S est combustible, enflammé il brule à l’air avec une flamme bleue.
2H2S g + 6O2 g → 2H2O + 2SO2 g
Propriétés sulfurantes
Les métaux sauf l’or et le platine sont attaqués à froid par H2S gazeux. (Ex : l’argent et le cuivre).
H2S en milieux aqueux est très employé en chimie analytique pour la séparation des cations.
Propriétés acides :
– H2S est en solution un diacide très faible très peu dissocié :
H2S + H2O ↔ HS– + H3O+ , pK=7 HS– + H2O ↔ S2- + H3O+, pK=17
L’ion sulfure S2- est une base forte nivelée en solution aqueuse :
S2- + H2O → HS–+OH–
Dérivés oxygénés du soufre : Acide sulfurique H2SO4
Connu depuis longtemps, c’est un composé important de la chimie.
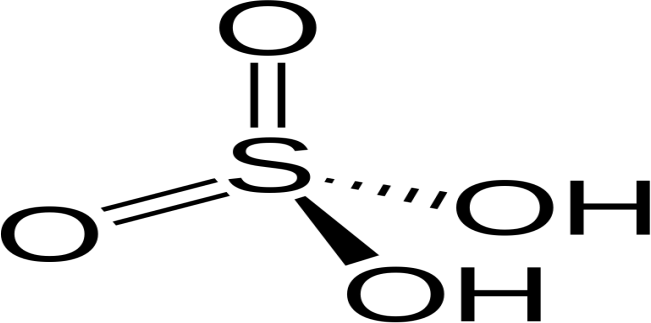
Figure11 : Structure Chimique de l’Acide Sulfurique
Préparations
H2SO4 est uniquement fabriqué dans l’industrie par méthode de contact : Le dioxyde de soufre SO2 est produit par combustion du soufre fondu.
Ensuite il est traité par air déshydraté en présence d’oxyde de vanadium on obtient SO3 qui est dilué dans H2SO4 ; oléums qui subissent une dilution on obtient l’acide sulfurique plus ou moins diluée.
T°
– S + O2 → SO2(g)
VO
– 2 SO2 + O2 → 2 SO3(g)
H2SO4(l) + SO3(g) → H2S2O7(l). (fumant, oléum)
– H2S2O7(l)+ H2O → 2H2SO4 (l)
Propriétés physiques
C’est un liquide, incolore, dense (1.827g/cm3), visqueux les molécules étant associées par liaison hydrogène, fumant à l’air, fondant à 10.37°C et bouillant avec décomposition vers 280°C.
L’acide sulfurique est miscible à l’eau en toute proportion (très avide d’eau) la dissolution est très exothermique et il est conseillé de toujours mélanger lentement et en agitant l’acide dans l’eau mais pas l’inverse.
Le liquide pur est auto ionisé en première approximation selon :
2H2SO4 → H3SO4+ + HSO4- k=2.7*10-4.
Il est peut être utilisé comme solvant non aqueux.
Propriétés chimiques
L’acide sulfurique possède essentiellement quatre propriétés chimiques : Diacide fort, oxydant, agent sulfonant, agent déshydratant.
Propriété acide
En solution aqueuse H2SO4 est un acide fort.
C’est un diacide.
H2SO4 → H+ + HSO4- HSO4- → H+ + SO42-
Il se combine aux bases, aux métaux en donnant des sulfates acides.
Il déplace de leurs sels la plupart des acides.
En solution dilué H2SO4 attaque les métaux (Le plomb est peu attaqué).
Propriété oxydante
L’acide concentré peut jouer un rôle oxydant.
Il cède alors de l’oxygène et se réduit à l’état d’anhydride sulfureux SO2.
L’acide fumant est un oxydant encore plus énergique.
En chauffant H2SO4 avec des réducteurs comme le soufre, le carbone, le cuivre.
Il se réduit en anhydride sulfureux.
Concentré et chaud l’acide sulfurique est un oxydant.
Pour le couple SO42-/SO2 (aq), E=0.17V.
Cette valeur positive permet à l’acide sulfurique de réagir sur des métaux
nobles tels que Cu, Pb, Hg avec dégagement de SO2, par exemple :
2H2SO4 + Cu → SO2 + CuSO4 + 2H2O.
Dilué et froid H2SO4 réagit sur les métaux réducteurs (E°<0) avec dégagement d’hydrogène.
Propriété sulfonante (sulfonation)
L’acide fumant est utilisé en chimie organique pour fixer le groupement sulfoné SO3H à la place d’un hydrogène.
C6H6 + H2SO4 → C6H5SO3H + H2O.
L’acide sulfurique a la propriété de sulfonation des composés aromatiques :
ArH + 2H2SO4 → ArSO3H + H3O+ + HSO4-
L’agent de sulfonation électrophile semble être SO3, acide de Lewis, présent dans les oléums et dans l’acide concentré :
2H2SO4 → SO3 + H3O+ + HSO4-
Propriétés déshydratantes
H2SO4 concentré très avide d’eau sert souvent à dessécher les gaz.
L’acide sulfurique peut jouer un rôle d’agent déshydratant.
Il peut de ce fait carboniser les glucides.
D’où le danger de projections d’acide sulfurique notamment sur la peau (laver abondamment).
L’utilisation de mélanges sulfonitriques pour la nitration de composés aromatiques par NO2+ peut être rattachée à cette action déshydratante :
2H2SO4 + HNO3 → 2HSO4- + H3O+ + NO2 +
Partie III
Usages
Usages industriels
L’oxygène et ses dérivés
Le dioxygène O2
Sidérurgie : C’est le principal secteur d’utilisation de l’O2.
L’O2 est utilisé pour la déphosphoration et la désulfuration des aciers par, insufflation de dioxygène dans la fonte.
La chaleur de combinaison de l’oxygène avec l’hydrogène ou avec l’acétylène est utilisée dans l’industrie de la soudure et du découpage des métaux.
Oxydation directe de l’éthylène et du propylène en leurs oxydes respectifs.
Blanchiment de la pate à papier.
Traitement des eaux, oxygénation des eaux afin de créer des zones de refuge (appelées ilots de survie) pour les poissons en cas de pollution brutale.
O2 liquide : explosifs, comburant de propulsion spatiale.
L’ozone O3
Par ses propriétés oxydantes c’est un décolorant (blanchiment du textile et de la pate à papier),
Désinfectant et stérilisant ayant des propriétés antiseptiques exceptionnelles: il détruit les bactéries, les virus et les champignons et est, de ce fait, utilisé pour la désinfection, par exemple dans la préparation d’eau potable ou le traitement des eaux des piscines ou encore dans la stérilisation du matériel médical.
Peroxyde d’hydrogène H2O2
Employé pour décolorer les fibres textiles et les cheveux (20V ou 30V).
Soufre et ses dérivés
Soufre
Utilisé comme fongicide pour traiter les vignes contre les champignons (contre l’oïdium de la vigne) sous forme de CuSO4,
Il entre dans la fabrication d’explosifs et d’allumettes et d’insecticides.
Il intervient dans l’industrie de H2SO4, dans la batterie automobile et dans la vulcanisation du caoutchouc.
L’anhydride sulfureux SO2
Utilisé dans le blanchiment des textiles : soie, laine.
Il sert à préparer l’acide sulfurique.
Largement utilisé en vinification : SO2 est un antiseptique.
L’acide sulfurique H2SO4
Le soufre principalement sous forme d’acide sulfurique, est un produit chimique d’une importance considérable.
La quantité d’acide sulfurique consommée par une nation donnée est un indicateur du développement industriel du pays.
H2SO4 a de nombreuses débouchées actuellement dans l’industrie :
Industrie des engrais superphosphates et fabrication de l’acide phosphorique.
Fabrication des sulfures et des sulfates d’ammonium, de potassium et de cuivre….
Sulfonation des colorants, explosifs et détergents.
Utilisé dans le désherbage.
Fabrication du dioxyde de titane TiO2, principal pigment blanc utilisé dans les peintures.
Fabrication de l’acide fluorhydrique HF aq utilisé notamment pour l’élaboration du AlF3 et de la cryolithe Na3AlF6 qui entrent dans la composition du bain d’électrolyse de l’alumine pour produire l’aluminium.
Utilisé dans la synthèse de H2O2, HCl et HNO3.
Textiles artificiels : fabrication du caprolactame, intermédiaire de la synthèse du nylon 6.
Décapage des métaux, traitement des minerais et détartrage.
Séchage et purification des gaz.
Raffinage des huiles.
Détartrage des aéro-réfrigérants à tirage naturel des centrales électriques thermiques classiques ou nucléaires.
Industrie des sucreries.
Sélénium:
Le sélénium est très utilisé dans l’industrie :
Utilisé dans les cellules photoélectriques (transforme la lumière en électricité).
Utilisé dans l’industrie du verre :
Neutralise la teinte verte du aux impuretés ferreuses du verre sodo- calcique.
Réduit la transmission de la chaleur solaire du verre plat architectural.
CdSXSe1-X pigment rouge dans les verres et les céramiques.
Tellure
Le tellure est également très utilisé dans l’industrie :
Additif <0.1% dans les aciers à faible teneur en carbone pour améliorer les qualités d’usinages du métal. (cela représente environs la moitié de la consommation mondiale du tellure).
Applications catalytiques.
Polonium
Utilisé dans les systèmes de chauffage ultralégers pour les capsules spatiales.
Usages médicaux
Oxygène et ses dérivés 1- Dioxygène O2
Mécanisme d’action
La fraction en oxygène de l’air ambiant est de l’ordre de 21 %.
L’oxygène est un élément indispensable à l’organisme, il intervient dans le métabolisme et le catabolisme cellulaire, et permet la production d’énergie sous forme d’adénosine triphosphate (ATP).
La variation de la pression partielle en oxygène du sang retentit sur le système cardiovasculaire, le système respiratoire, le métabolisme cellulaire et le système nerveux central.
La respiration d’oxygène sous une pression partielle supérieure à 1 atmosphère (oxygénothérapie hyperbare) a pour but d’augmenter de façon importante la quantité d’oxygène dissout dans le sang artériel approvisionnant directement les cellules.
Cas d’usage
L’oxygène est utilisé dans la prise en charge des :
Algies vasculaires de la face,
Alimentation des respirateurs en anesthésie-réanimation,
Hypoxies d’étiologies diverses nécessitant une oxygénothérapie normobare ou hyperbare,
C’est un vecteur des médicaments pour inhalation administrés par nébuliseur.
En association avec le protoxyde d’azote, l’oxygène est utilisé dans la prise en charge d’analgésies.
2- Ozone
L’ozonothérapie ou cure d’ozone est une technique de médecine nonconventionnellequi prétend traiter de différentes affections et symptômes par l’insufflation dans l’organisme d’un mélange d’ozone et d’oxygène.
Cette « thérapie » autoproclamée est utilisée en dentisterie, chirurgie, rhumatologie, cardiologie, gynécologie, urologie, dermatologie, orthopédie, etc.
L’ozone est le plus puissant oxydant connu et possède de ce fait :
Des propriétés antiseptiques exceptionnelles: il détruit les bactéries, les virus et les champignons et est donc utilisé en dentisterie pour l’hémostase et pour le traitement des plaies et des infections gingivales.
En usage interne, l’ozone stimule l’irrigation sanguine en améliorant l’oxygénation et la circulation sanguine jusqu’aux plus petits capillaires.
De plus, en dosages faibles à moyens, l’ozone pourrait stimuler le système immunitaire.
NB : Aucune des variantes de l’ozonothérapie n’est agréée par les grandes agences gouvernementales de régulation des pratiques thérapeutiques (Food and Drug Administration :FDA ou Agence Européenne du Médicament : EMA).
3- Soluté de peroxyde d’hydrogène ou eau oxygénée (H2O2) à 10V
Mécanisme d’action
Le peroxyde d’hydrogène est un antiseptique local léger.
L’eau oxygénée à 10V grâce à l’oxygène qu’elle libère 2 H2O2 (aq) → 2 H2O (aq) + O2(g) ↑ possède donc les propriétés thérapeutiques suivantes :
Lavage des plaies : l’oxygène libéré lors de la réaction de décomposition, aide les souillures à remonter à la surface de la plaie, puis ces dernières sont éliminées par l’eau formée parallèlement,
Action bactéricide : sur les germes anaérobies.
Action hémostatique : grâce au pouvoir coagulant de l’oxygène
Cas d’usage
Le peroxyde d’hydrogène est utilisé dans la prise en charge des :
Antisepsies des plaies et des brulures superficielles peu étendues.
Conservation
Tous les antiseptiques peuvent être contaminés par des germes : une fois ouvert, le flacon doit être conservé peu de temps.
H2O2 se décompose spontanément au contact de l’air pour libérer son oxygène, perdant ainsi de son pouvoir oxydant et donc de son pouvoir thérapeutique.
Ce produit doit être mis à l’abri de la lumière et de la chaleur, flacon bien bouché pour conserver son efficacité.
Soufre
Mécanisme d’action
Le soufre est un élément minéral trace (oligoélément).
Le soufre ou sulfosilicoaluminate de sodium est à visée antiseptique et décongestionnante.
Par voie locale, le soufre a une action antiacnéique.
Cas d’usages
Le soufre est utilisé dans la prise en charge d’inflammations des voies aériennes supérieures.
Le soufre est utilisé, en oligothérapie, dans la prise en charge des :
affections cutanées,
affections rhumatismales,
affections otorhinolaryngologiques.
Par voie locale, en association au zincet au cuivre, le soufre est utilisé dans la prise en charge d’acnés mineures.
NB : Il est à noter que le soufre existe naturellement dans les eaux thermales des stations hydrominérales, destinées au traitement des maladies des voix respiratoires.
Sélénium
Mécanisme d’action
Le sélénium est un élément minéral trace (oligoélément).
Le sélénium est un élément du système enzymatique glutathion-peroxydase, qui protège les composants cellulaires de l’oxydation due aux peroxydes produits par le métabolisme cellulaire.
Il semble jouer un rôle essentiel dans les défenses immunitaires et dans le fonctionnement de la thyroïde
Par voie injectable, des patients sous nutrition parentérale totale ont montré des symptômes de déficit en sélénium incluant douleur et fatigabilité musculaire ou des cardiomyopathies semblables à celles rencontrées dans la maladie de Keshan (déficit en sélénium endémique).
Il a été observé qu’une supplémentation en sélénium faisait régresser ces symptômes.
Par voie locale, le sulfure de sélénium est actif sur pityrosporon orbiculaire, levure lipophile, agent responsable du pityriasis versicolor.
Cas d’usages
Par voie injectable, le sélénium est utilisé dans la prise en charge des :
Apports de sélénium en nutrition parentérale,
Carences en sélénium.
Par voie orale, le sélénium est utilisé, en oligothérapie, dans la prise en charge des :
Affections cutanées,
Affections musculaires.
Par voie locale, le sélénium est utilisé dans la prise en charge des :
Dermites séborrhéiques du cuir chevelu,
Pityriasis versicolor.
Précautions à prendre avec le sélénium
Ingéré en excès, le sélénium peut se révéler toxique.
Lorsque la dose quotidienne est supérieure à 1 000 µg par jour, les cheveux deviennent cassants, les ongles sont friables et présentent des stries horizontales, la peau s’infecte facilement, l’haleine devient aigre et la fatigue s’installe.
La dose maximale à ne jamais dépasser en administration continue est estimée à 400 µg par jour pour les adultes et à 280 µg par jour pour les adolescents.
Les femmes enceintes et celles qui allaitent doivent limiter leur consommation de sélénium à 70 µg par jour.
Les personnes qui souffrent de goitre doivent éviter les compléments de sélénium.
Les hommes en âge de développer un cancer de la prostate devraient éviter de prendre des compléments alimentaires contenant du sélénium.
Les aliments contenant du sélénium peuvent être consommées, avec modération dans le cadre d’une alimentation équilibrée.( Suite à une grande étude, appelée SELECT (2001-2008) qui a démarré pour évaluer les effets de compléments alimentaires contenant deux substances antioxydantes, le sélénium et la vitamine E, sur le risque de survenue de maladies chez l’homme.
Cette étude devait durer jusqu’en 2013, en 2008, l’étude fut arrêtée lorsque les chercheurs réalisèrent que les hommes recevant la vitamine E et le sélénium
couraient un risque plus élevé de développer un cancer de la prostate (risque augmenté de 17%)).
Le tellure
Toutefois les utilisations de Te sont limitées en partie parce que les composés de Te sont facilement absorbés par l’organisme et excrétés par l’expiration et la transpiration sous forme de dérivés organiques à odeur fétide.
Exercice d’application
L’eau oxygénée officinale est vendue en pharmacie.
Sur l’étiquette, on peut lire la mention :
« Eau oxygénée stabilisée à 10 volumes (3%) ».
Dans quel cas peut-on utiliser cette eau oxygénée ? Quel est son mécanisme d’action ?
Calculez la concentration molaire en H2O2 (aq) d’une eau oxygénée à 10 volumes.
Justifiez le titre 3% de cette eau oxygénée.
Données : M(H) = 1,00 g.mol-1 ; M(O) = 16,0 g.mol-1 ; VmO2= 22,4 L.mol-1.
Corrigé type :
Données : M(H) = 1,00 g.mol-1 ; M(O) = 16,0 g.mol-1 ; VmO2= 22,4 L.mol-1.
Cas d’usage de l’eau oxygénée à 10 V
Le peroxyde d’hydrogène est utilisé dans la prise en charge des :
Antisepsies des plaies et des brulures superficielles peu étendues.
Son mécanisme d’action
Le peroxyde d’hydrogène est un antiseptique local léger.
L’eau oxygénée à 10V grâce à l’oxygène qu’elle libère 2 H2O2 (aq) → 2 H2O (aq) + O2(g) ↑ possède donc les propriétés thérapeutiques suivantes :
Lavage des plaies : l’oxygène libéré lors de la réaction de décomposition, aide les souillures à remonter à la surface de la plaie, puis ces dernières sont éliminées par l’eau formée parallèlement,
Action bactéricide : sur les germes anaérobies.
Action hémostatique : grâce au pouvoir coagulant de l’oxygène.
Calcul de la concentration molaire en H2O2 (aq) d’une eau oxygénée à 10 volumes
Par définition,
Une eau oxygénée est dite à « n volume » si 1 litre de solution d’eau oxygénée libère n litres de dioxygène, volume mesuré dans les conditions normales de température et de pression (CNTP, 0°C et 1atm),
Donc pour une eau oxygénée à 10 volumes, 1L de solution de H2O2 va libérer 10L de O2, volume mesuré dans les CNTP.
Cette décomposition de H2O2 se fait lentement selon la réaction suivante :
2H2O2 (aq) → O2 (g) + 2H2O (aq).
2*34 g/mol 22.4 l/mol
m 10 l
On rappelle que le volume molaire de l’oxygène dans les CNTP vaut : VmO2= 22,4 L.mol-1. m= (10*2*34/22.4)=30.35g.
Pour un litre de solution H2O2 :
Cp= 30.35g/l Cm=30.35/34=0.89mol/l
Sinon :
L’eau oxygénée se décompose lentement suivant la réaction
| 2H2O2 | → | 2H2O | + O2 |
| 2 n(H2O2) | n(O2) |
2 moles de (H2O2) libèrent 1 mole de (O2)
Le tableau d’avancement :
| 2H2O2 | 2H2O | O2 |
| n0 (H2O2) | 0 | 0 |
| n0 – 2x | 2x | x |
n0 (H2O2) – 2*x (O2) = 0 n0 (H2O2) =2*x (O2)
l’O2 est un gaz donc :
x(O2) = V O2/Vm avec : Vm volume molaire.
xO2=10l /22.4 l/mol
xO2=0.44mol
n0H2O2 =2*0.44=0.89mol
Pour 1 litre de H2O2 : Cm H2O2=0.89mol/l
Justification du titre 3% de l’eau oxygénée à 10 volumes :
Une solution à 3% H2O2 correspond à :
Cp = 3g H2O2 = 3g
= 30g
= 30g/l
100gH2O
100ml
1000ml
Cm (H2O2) = (Cp)/Mm = 30 / 34 = 0, 89 mole/l.
Cm H2O2=0.89mol/l
Donc, nous avons justifié que le titre 3% en eau oxygénée correspond effectivement
à 10 Volumes d’eau oxygénée.

