LES ALCALINOTERREUX Be, Mg, Ca, Sr, Ba et Ra*
FACULTE DE MEDECINE D’ALGER DEPARTEMENT DE PHARMACIE
LABORATOIRE DE CHIMIE MINERALE PHARMACEUTIQUE

LES ALCALINOTERREUX
Be, Mg, Ca, Sr, Ba et Ra*
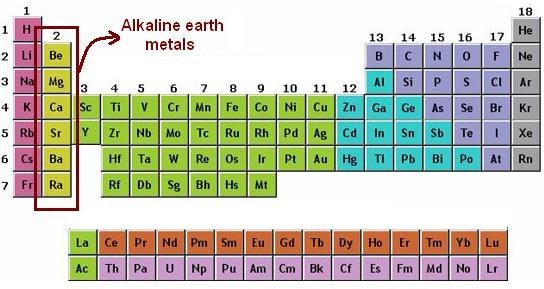
Alcalinoterreux
Figure 1– Classification des alcalinoterreux dans le tableau périodique.
| Nom | Symbole | Numéro atomique | Structure électronique | Etat d’oxydation(≠0) |
| Béryllium | Be | 4 | 2[He]2s | +II |
| Magnésium | Mg | 12 | 2[Ne]3s | +II |
| Calcium | Ca | 20 | 2[Ar]4s | +II |
| Strontium | Sr | 38 | 2[Kr]]5s | +II |
| Baryum | Ba | 56 | 2[Xe]6s | +II |
| Radium | Ra | 88 | 2[Rn]7s | +II |
Tableau I– Propriétés générales des alcalinoterreux.
Les alcalinoterreux ont une structure électronique externe de type ns2. (n représente la période et varie de 2 à 7).
Les alcalinoterreux possèdent deux électrons de valence situés sur une sous couche s, ils appartiennent donc au bloc s et à la deuxième colonne du tableau périodique , soit au groupe 2 (IUPAC) ou anciennement IIa.
NB : Bien que l‘hélium ait une structure électronique de type : 1 s2, il ne fait pas partie de la famille des alcalinoterreux mais à celle des gaz nobles (groupe 18) de par les propriétés qu’il possède. (C’est une des exceptions du tableau périodique).
Pour acquérir une plus grande stabilité et satisfaire ainsi à la règle de l’octet (obtenir la structure électronique du gaz inerte le plus proche dans la classification périodique ) les alcalinoterreux ont tendance à donner leurs deux électrons de valence et former ainsi des cations divalents de type M2+ (M :métal alcalinoterreux , ex : Mg2+) dont l’état d’oxydation est de
+II.
Etat naturel :
Les alcalino-terreux n’existent pas à l’état libre à cause de leur grande réactivité chimique, on les trouve sous forme de composés essentiellement des carbonates et des sulfates.
Le Be, par contre, n’existe que sous la forme de silicates (béryl, bertrandite).
Le Ca et le Mg sont relativement abondants dans la croute terrestre et occupent respectivement la 5ème et 8ème place sur l’échelle de répartition des éléments chimiques sur terre.
Ils sont suivis par le Ba et le Sr.
Le Be et le Ra (élément radioactif) sont rares et n’existent qu’à l’état de traces (ils sont extrêmement toxiques).
| Elément | Teneur en % massedans croute terrestre | Rang |
| Be | 0,0002 | / |
| Mg | 2.10 | 8 |
| Ca | 3.65 | 5 |
| Sr | 0.038 | / |
| Ba | 0.05 | / |
| Ra | 10-6 | / |
Tableau II– Abondance des alcalinoterreux dans la croute terrestre.
Les mers constituent, par ailleurs, une importante réserve en Mg car elles sont riches en
ème
sels de magnésium (3 élément en terme d’abondance dans l’eau de mer).
.
On retrouve aussi du Mg chez les végétaux car c’est le métal central de la chlorophylle.
Plusieurs minerais renferment des alcalinoterreux, les plus courants sont cités dans le tableau suivant :
| Be | Mg | Ca | Sr | Ba | |
| Minerai principal | Béryl :Be Al Si O3 2 6 18 | Dolomite : (MgCa)(CO )3 2 | Calcaire : CaCO3 | Célestine :SrSO4 | Barytine :BaSO4 |
| Autres minerais | Bertrandite:Be Si O (OH)4 2 7 2 | Magnésite : MgCO3Kiesérite : MgSO4,H2OEpsomite : MgSO , 7H O4 2Olivine : (Mg, Fe)SiO4Talc : Mg Si O (OH)3 4 10 2Amiante crysotile :Mg Si O (OH)3 2 5 4 | Dolomite (MgCa)(CO )3 2Gypse : CaSO •2H O4 2Anhydrite : CaSO4Fluorine : CaF2Apatite : Ca (PO ) F5 4 3 | Strontianite :SrCO3 | Withérite :BaCO3 |
Méthodes de préparation :
Les alcalinoterreux sont principalement produits par deux procédés:
la réduction thermique d’un composé alcalinoterreux par un réducteur.
l’électrolyse du chlorure du métal alcalinoterreux fondu.
Le procédé par réduction thermique est un procédé de production simple , ancien et non écologique (importantes émissions de CO2).
L’électrolyse est la méthode de production la plus commune dans les pays où l’énergie électrique est produite relativement bon marché , c’est un procédé très couteux mais plus respectueux de l’environnement.
Préparation du béryllium :
Réduction thermique du BeF2 par du magnésium à 1300°C :
BeF2 + Mg Be + MgF2
Electrolyse de BeCl2 fondu :
Le bain d’électrolyse est un mélange de NaCl : 50% et de BeCl2 : 50%.
Le chlorure alcalin est ajouté afin d’améliorer la conductibilité électrique du BeCl2.
0
L’électrolyse se fait vers 350-370 C, sous une tension de 6 V.
Les anodes sont en graphite
et les cathodes sont en acier.
Les ions Be2+ subissent une réduction à l’état de Be métallique à la cathode et le chlore gazeux se dégage à l’anode.
Les réactions engagées sont :
Anode (+) (Oxydation) : 2Cl– Cl2 + 2e–
Cathode (-) (Réduction) : Be2+ + 2e– Be
Préparation du magnésium :
Réduction thermique d’oxyde de magnésium : en deux étapes
Etape 1 : Calcination de la dolomite
Le minerai de dolomite est broyé et chauffé dans un four pour produire un mélange d’oxydes de magnésium et de calcium :
MgCO3.CaCO3 MgO.CaO + 2CO2
Etape 2 : Réduction de l’oxyde de magnésium
L’agent réducteur est le ferrosilicium (un alliage de fer et de silicium).
Les oxydes sont mélangés avec du ferrosilicium pilée et transformés en briquettes.
L’alumine peut également être ajoutée pour réduire le point de fusion.
La réaction est effectuée à 1600°C sous très faible pression et sous vide.
Dans ces conditions, le magnésium est produit sous forme de vapeur qui est condensée par refroidissement ,il est ensuite retiré et coulé en lingots.
Le procédé donne du magnésium avec un maximum de 99,99% de pureté.
2(CaO- MgO) + FeSi 2Mg + Ca2SiO4 + Fe
Electrolyse du chlorure de magnésium fondu par le procédé de DOW :
Le magnésium Mg2+ contenu dans des solutions de chlorure de magnésium provenant soit d’eau de mer, soit de saumures est précipité à l’aide de dolomie calcinée en Mg(OH)2 qui est récupéré par filtration.
Mg2+ + Ca(OH)2 Mg(OH)2 + Ca2+
L’hydroxyde est ensuite transformé en MgCl2,6H2O par attaque chlorhydrique, puis déshydraté pour alimenter les cuves d’électrolyse.
Mg(OH)2 + 2HCl MgCl2 + 2H2O
La composition du bain d’électrolyse est la suivante :
| NaCl : 50-60 % | CaCl2 : 15 % | MgCl2 : 20-30 % |
L’électrolyse se fait vers 720-780 °C dans des cuves alimentées par un courant de
40 000 à 80 000 ampères sous une tension de 6 à 7 volts.
Les anodes en graphite sont entourées par des cathodes en acier percées dont la forme permet de guider le magnésium formé vers le pourtour de la cellule, à l’abri de toute oxydation.
Le magnésium liquide, surnage à la cathode et le chlore gazeux dégagé à l’anode est recyclé.
Les réactions engagées sont :
Anode (+) (Oxydation) : 2Cl– Cl2 + 2e–
Cathode (-) (Réduction): Mg2+ + 2e– Mg
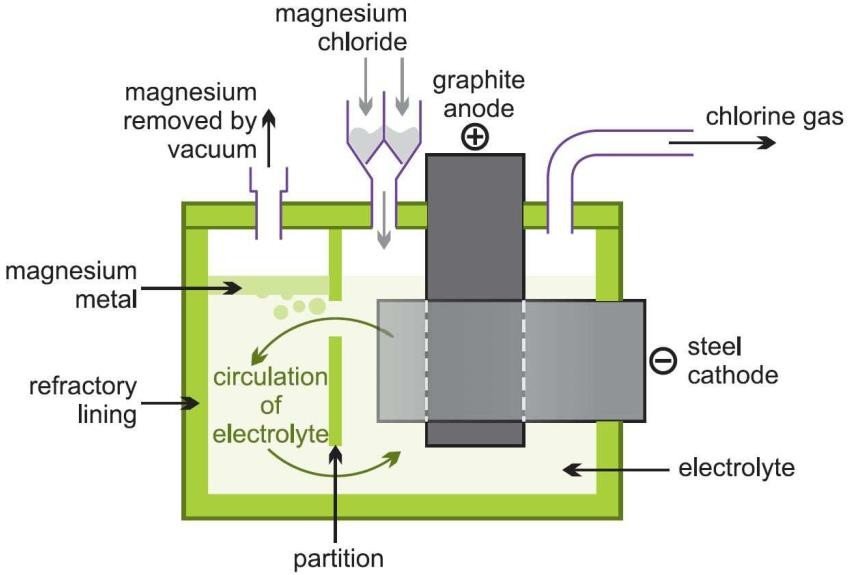
MgCl2
Récupération du
Mg
Cl2 gaz
Mg métal
Cuve d’électrolyse
Bain d’électrolyse
Figure 2– Electrolyse du chlorure de magnésium.
Cathode acier
Anode graphite
Préparation du Calcium, Strontium et Baryum :
Réduction thermique de leur oxydes par de l’aluminium (aluminothermie) :
3CaO + 2Al 3Ca + Al2O3
3SrO + 2Al 3Sr + Al2O3
3BaO + 2Al 3Ba + Al2O3
Electrolyse de leur chlorures fondu :
Électrolyse à l’état fondu du CaCl2 ou du SrCl2 ou du BaCl2 vers 770°C.
Les réactions engagées lors de l’électrolyse du CaCl2 sont :
Anode (+) (Oxydation) : 2Cl– Cl2 + 2e–
Cathode (-) (Réduction) : Ca2+ + 2e– Ca
Les réactions engagées lors de l’électrolyse du SrCl2 sont :
Anode (+) (Oxydation) : 2Cl– Cl2 + 2e–
Cathode (-) (Réduction) : Sr2+ + 2e– Sr
Les réactions engagées lors de l’électrolyse du BaCl2 sont :
Anode (+) (Oxydation) : 2Cl– Cl2 + 2e–
Cathode (-) (Réduction) : Ba2+ + 2e– Ba
Propriétés physiques générales du groupe 2 :
9
| Be | Mg | Ca | Sr | Ba | Ra | |
| Numéro atomique (Z) | 4 | 12 | 20 | 38 | 56 | 88 |
| Masse atomique (g/mole) | 9.01218 | 24.305 | 40.08 | 87.62 | 137.33 | 226.0254 |
| Etat ordinaire | Solide | Solide | Solide | Solide | Solide | Solide |
| Aspect | Métal | Métal | Métal | Métal | Métal | Métal |
| Couleur | Blanc gris | Blanc gris | Argenté | Argenté | Argenté | Argenté |
| Dureté (Mohs) | 5.5 | 2.5 | 1.75 | 1.5 | 1.25 | / |
| Rayon atomique (pm) | 112 | 160 | 194 | 219 | 222 | 223 |
| Rayon ionique M2+ (pm) | 35 | 72 | 100 | 118 | 135 | 148 |
| Point de fusion (°C) | 1287 | 649 | 842 | 777 | 727 | 700 |
| Point d’ébullition (°C) | 2471 | 1090 | 1484 | 1382 | 1897 | 1700 |
| E1i (KJ/mole) | 899 | 738 | 590 | 549 | 503 | 509 |
| Ӽ (Pauling) | 1.57 | 1.31 | 1.00 | 0.95 | 0.90 | 0.89 |
| Système cristallin | Hexagonal | Hexagonal | Cubiqueà face centré | Cubiqueà face centré | Cubique centré | Cubique centré |
Tableau IV– Propriétés physiques générales des alcalinoterreux.
Aspect :
Les alcalinoterreux sont des métaux plus durs et plus denses que les alcalins.
Le Be et le Mg sont blanc gris alors que les autres éléments du groupe sont mous et argentés.
Les métaux sont malléables, ductiles et assez cassants, à l’air la surface brillante de tous les métaux se ternit rapidement.
Rayon atomique :
| Be | Mg | Ca | Sr | Ba | Ra | |
| Rayon atomique (pm) | 112 | 160 | 194 | 219 | 222 | 223 |
-Les atomes des alcalinoterreux sont gros mais plus petits que ceux des alcalins.
– Le béryllium possède un rayon atomique particulièrement faible par rapport au reste du groupe.
-Le rayon atomique augmente lorsque Z augmente car le nombre de couches électroniques augmente et la distance entre les électrons externes et le noyau s’agrandit.
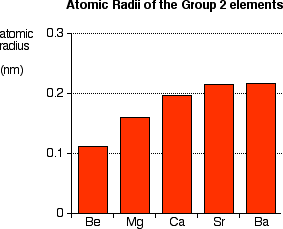
R at
Figure 3– Rayon atomique du groupe 2
10
Les points d’ébullition des alcalinoterreux sont plus élevés que ceux des alcalins .
Le Mg présente le point d’ébullition le plus bas du groupe.
Le point d’ébullition diminue quand Z augmente pour les métaux qui cristallisent dans le système hexagonal : Be et Mg.
-Pas de tendance évidente entre les points d’ébullition pour le reste des éléments du groupe 2.
Points de fusion :
| Be | Mg | Ca | Sr | Ba | Ra | |
| Point de fusion (°C) | 1287 | 649 | 842 | 777 | 727 | 700 |
Les points de fusion des alcalinoterreux sont plus élevés que ceux des alcalins.
Le Mg présente le point de fusion le plus bas du groupe.
Les métaux du groupe 2 ont des structures cristallines différentes, ce qui impose de les diviser en plusieurs groupes.
Les points de fusion constituent deux séries décroissantes, l’une pour les métaux qui cristallisent dans le système hexagonal (béryllium et magnésium) l’autre pour ceux dont le cristal est cubique.
Pour une même structure cristalline, le point de fusion diminue quand Z augmente, car les liaisons métalliques deviennent plus faibles à cause de
l’attraction entre les noyaux et les électrons qui diminuent du fait que la distance augmente.
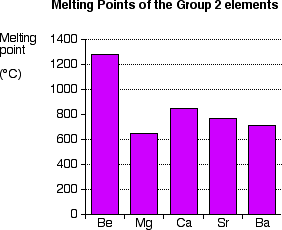
Pt F
Figure 4– Points de fusion du groupe 2
Points d’ébullition :
| Be | Mg | Ca | Sr | Ba | Ra | |
| Point d’ébullition (°C) | 2471 | 1090 | 1484 | 1382 | 1897 | 1700 |
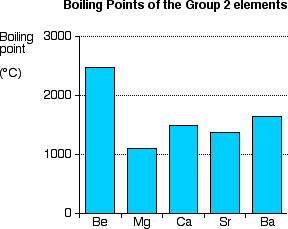
Pt Eb
Figure 5– Points d’ébullition du groupe 2
Energie d’ionisation :
| Be | Mg | Ca | Sr | Ba | Ra | |
| E1i (KJ/Mole) | 899 | 738 | 590 | 549 | 503 | 509 |
L’énergie d’ionisation des alcalinoterreux est supérieure à celle des alcalins.
-Le béryllium possède l’énergie d’ionisation la plus élevée du groupe.
L’énergie d’ionisation diminue lorsque Z augmente car la distance entre le noyau et les électrons externes augmente et ils deviennent plus faciles à enlever car ils sont moins attirés par le noyau.
NB: L’énergie de deuxième ionisation est presque le double de celle nécessaire pour arracher le 1er électron.
Electronégativité :
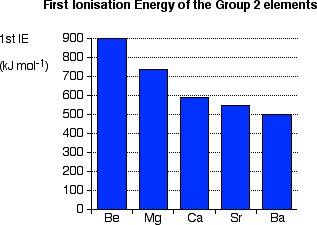
E1i
Figure 6– Energie de 1ère ionisation du groupe 2
| Be | Mg | Ca | Sr | Ba | Ra | |
| Ӽ (Pauling) | 1.57 | 1.31 | 1.00 | 0.95 | 0.90 | 0.89 |
– Les alcalinoterreux ont une faible électronégativité mais qui reste supérieure à celle des alcalins.
-Le béryllium possède l’électronégativité la plus élevée du groupe.
Ce qui explique le caractère partiellement covalent de ces composés.
-L’électronégativité diminue quand Z augmente.
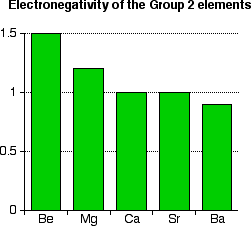
Figure 7– Electronégativité du groupe 2
Conductibilité thermique et électrique :
Les alcalinoterreux sont de bons conducteurs d’électricité et de chaleur.
Le caractère métallique dans le groupe augmente quand Z augmente.
Essai à la flamme :
Les sels de Ca , Sr et Ba colorent la flamme d’un bec bunsen en donnant une teinte caractéristique.
Ca : orange- rouge Sr : rouge brillant Ba : vert
Hydratation des composés :
Les composés des alcalinoterreux sont plus fortement hydratés que ceux du groupe 1.
Ex : MgCl2,6H2O et BaCl2,2H2O
Stabilité des sels :
La stabilité des sels décroit en général quand Z augmente.
Cependant les fluorures et les
hydroxydes manifestent la tendance inverse.
Solubilité des sels :
Les sels des alcalinoterreux sont moins solubles que ceux des alcalins.
BeF2 et les sulfates : CaSO4, SrSO4 et BaSO4 sont insolubles.
L’insolubilité est attribuable en partie au fait que les ions de charge +2 permettent une liaison ionique de plus grande énergie donc une cohésion plus forte entre les ions des sels qui sera plus difficile à rompre lors de la dissolution.
Propriétés chimiques générales du groupe 2 et composés :
Les alcalinoterreux sont des éléments très réactifs principalement à cause de leur faible énergie d’ionisation.
Réactions avec H2 et formation d’hydrures MH2 :
Béryllium :
Le béryllium ne réagit pas avec l’hydrogène même à des températures très élevées.
L’ hydrure de béryllium est préparé de façon indirecte selon la réaction :
BeCl2 + 2 LiH BeH2 + 2 LiCl
Le magnésium, le calcium, le strontium et le baryum :
Ces éléments réagissent à chaud , avec l’hydrogène avec formation d’hydrures métalliques par combinaison directe, selon la réaction générale :
M + H2 MH2 (M ≠ Be) Ex: Ba + H2
BaH2
| Be | Mg | Ca | Sr | Ba | |
| Hydrures | BeH2 | MgH2 | CaH2 | SrH2 | BaH2 |
| Caractère | Covalents | Ioniques | |||
| Solubilité | Augmente du Be au Ba | ||||
Tableau V– Propriétés des hydrures des alcalinoterreux.
Réactions avec H2O et formation d’hydroxydes M(OH)2 :
Les métaux du groupe 2 deviennent plus réactifs à l’égard de l’eau au fur et à mesure que vous descendez dans le groupe.
Béryllium :
Le béryllium ne réagit pas avec l’eau même à des températures très élevées.
L’ hydroxyde de béryllium est préparé de façon indirecte selon la réaction :
BeCl2 + 2 NaOH Be(OH)2 + 2 NaCl
Magnésium :
A température ordinaire, l’eau ne réagit que très lentement avec le Mg qui est passivé par la formation d’une couche protectrice d’hydroxyde de magnésium qui forme une barrière empêchant toute réaction ultérieure.
A haute température, la vapeur d’eau oxyde le magnésium en magnésie anhydre MgO avec dégagement d’hydrogène.
Mg + H2O MgO + H2
A basse température, la vapeur d’eau oxyde le magnésium en magnésie hydratée Mg(OH)2
avec dégagement d’hydrogène.
Mg + 2H2O Mg(OH)2 + H2
Le calcium, le strontium et le baryum :
Ces éléments réagissent avec l’eau à froid avec formation de l’hydroxyde métallique et dégagement d’hydrogène, selon la réaction générale :
M + 2H2O M(OH)2 + H2 Ex: Ca + 2H2O
Ca(OH)2 + H2
| Be | Mg | Ca | Sr | Ba | |
| Hydroxydes | Be(OH)2 | Mg(OH)2 | Ca(OH)2 | Sr(OH)2 | Ba(OH)2 |
| Caractère | Amphotère | Basicité augmente du Mg au Ba | |||
| Solubilité | Augmente du Be au Ba | ||||
Tableau VI– Propriétés des hydroxydes des alcalinoterreux.
Réactions avec O2 et formation d’oxydes et de peroxydes:
Formation d’oxydes simples MO :
Dans l’ensemble, les métaux alcalinoterreux brûlent dans l’oxygène pour former un oxyde métallique simple de type MO, selon la réaction générale :
M + ½ O2 MO
Ex : Ba + ½ O2 BaO
Béryllium :
Le béryllium ne brule dans l’oxygène que sous forme de poussière ou de poudre.
Le béryllium a une couche très mince d’oxyde de béryllium sur sa surface qui empêche toute nouvelle oxydation.
Magnésium :
Le Mg est extrêmement réducteur, sa combinaison avec O2 dégage une grande quantité de chaleur :
Mg + ½ O2 MgO
En masse, l’oxydation par l’air reste superficielle.
En fil, en ruban ou en poudre, on peut l’enflammer à l’air.
La lumière émise très blanche est utilisée en photographie.
Formation de peroxydes MO2 :
Le béryllium ne forme pas de peroxyde, mais le magnésium , le calcium, le strontium et le baryum forment des peroxydes par chauffage dans de l’oxygène sous des pressions élevées, selon les réactions suivantes :
M + O2 MO2 (M≠Be) Ex : Ba + O2
BaO2
| Be | Mg | Ca | Sr | Ba | |
| Oxydes simples | BeO | MgO | CaO | SrO | BaO |
| Caractère | Amphotère | Basicité augmente du Mg au Ba | |||
| Réaction des oxydes avec H2O et formationd’hydroxydes | 2MO + 2H2O → 2 M(OH)2Ex : 2SrO + 2H2O → 2 Sr(OH)2 | ||||
| Réaction des oxydes avec CO2 et formation decarbonates | MO + CO2 → MCO3Ex : CaO + CO2 → CaCO3 | ||||
| BeCO3 | MgCO3 | CaCO3 | SrCO3 | BaCO3 | |
| Peroxydes | / | MgO2 | CaO2 | SrO2 | BaO2 |
| Caractère | / | Oxydants forts | |||
| Stabilité | Augmente du Mg au Ba | ||||
Réactions avec les halogènes et formation d’halogénures MX2 :
Tous les métaux du groupe 2 , forment des halogénures de type MX2 soit :
-par combinaison directe à température convenable selon la réaction :
M + 2X MX2
Ex : Ca + 2Cl CaCl2
-par action des acides halogénés sur le métal ou le carbonate du métal selon les réactions :
M + 2HCl MCl2 + H2
Ex : Ba + 2HCl BaCl2 + H2
MCO3 + 2HCl MCl2 + CO2 + H2O Ex : CaCO3 + 2HCl
CaCl2 + CO2 + H2O
Réactions avec le carbone et formation de carbures MC2 :
Le chauffage des métaux : Ca, Mg ,Sr, Ba ou de leurs oxydes avec du carbone aboutit à la formation de carbures selon les réactions :
M + 2C MC2 (M≠Be) EX: Ca + 2C
CaC2
NB: 2Be + C Be2C
Be + C2H2 BeC2 + H2
2MO + 4C 2MC2 + O2
Ex : 2CaO + 4C 2CaC2 + O2
Ces carbures sont hydrolysables avec libération d’acétylène et formation de l’oxyde selon la réaction :
MC2 + H2O MO + C2H2
Ex : CaC2 + H2O CaO + C2H2
Réactions avec l’azote et formation de nitrures M3N2 :
Les alcalinoterreux brûlent dans l’azote de l’air avec production de nitrures de type M 3 N 2
3M + N2 M3N2
Ex : 3Mg + N2 Mg3N2
Ces nitrures se décomposent par chauffage et réagissent avec l’eau, ils libèrent l’ammoniac et l’oxyde ou l’hydroxyde du métal :
M3N2 + 6H2O 3M(OH)2 + 2NH3 Ex: Mg3N2 + 6H2O
3Mg(OH)2 + 2NH3
Réactions avec les acides et formation de sels :
Les acides HCl et H2SO4 réagissent avec les alcalinoterreux pour former des sels avec dégagement d’hydrogène.
La réaction est lente avec le Be.
Les réactions deviennent de plus en plus vigoureuses lorsque le numéro atomique Z augmente.
L’acide nitrique HNO3 réagit avec les alcalinoterreux pour former des sels et des oxydes d’azote plutôt que de l’hydrogène.
Si l’acide est relativement dilué, obtention de monoxyde d’azote NO , qui réagit immédiatement avec l’oxygène de l’air pour donner du dioxyde d’azote NO2.
Si l’acide nitrique est très concentré cela aboutira directement à la formation du dioxyde d’azote.
Avec l’acide chlorhydrique :
M + 2HCl MCl2 + H2
Ex : Ca + 2HCl CaCl2 + H2
Avec l’acide sulfurique :
M + H2SO4 MSO4 + H2 Ex: Mg + H2SO4
MgSO4 + H2
Avec l’acide nitrique :
Ex : Mg
HNO3 très dilué:
Mg + 2HNO3 Mg(NO3)2 + H2
HNO3 à des concentrations modérées:
3Mg + 8HNO3 3Mg(NO3)2 + 2NO + 4H2O
HNO3 concentré:
Mg + 4HNO3 Mg(NO3)2 + 2NO2 + 2H2O
Formation de complexes :
–Be et Mg forment facilement des complexes de par la petite taille de leurs ions.
Ex: CLOROPHYLLE (Complexe du Mg).
-Avec Ca la formation de complexes est plus difficile et ne se fait qu’en présence d’oxydants forts. (Ex : EDTA, ACETYLACETONE).
-Les ions Ba2+ et Sr2+ sont trop gros pour former des complexes.
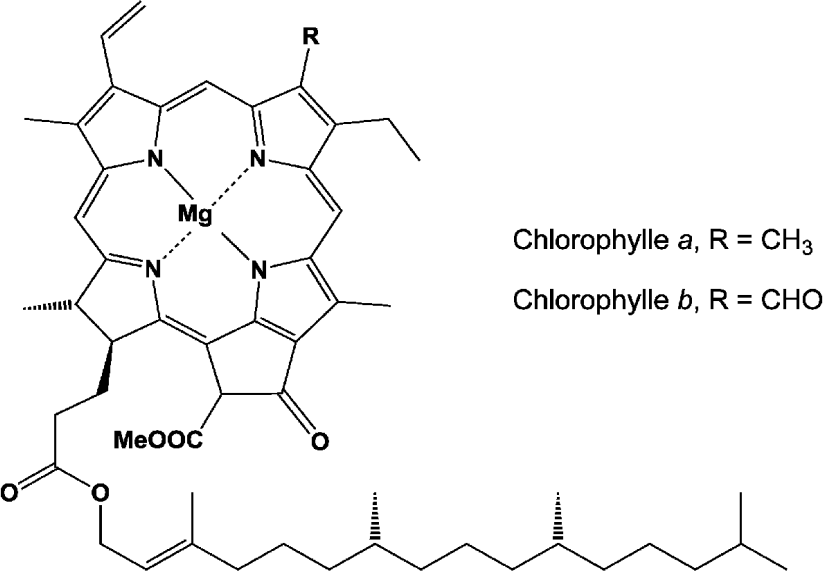
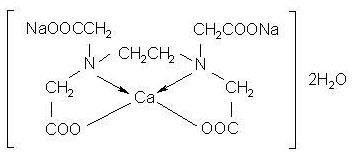
Figure 8- Chlorophylle
Figure 9– Calcium – Disodium- EDTA
Propriétés particulières du béryllium:
Le béryllium se comporte différemment du reste des éléments du groupe 2.
En fait, il existe plusieurs similitudes entre le béryllium et l’aluminium élément du groupe 13.
Ceci est connu comme une relation diagonale.
Ce comportement singulier s’explique par deux faits :
+ + 2+
Le potentiel ionique (Z /R ) de l’ion Be est très intense car le rayon est très petit.
Be possède une assez forte électronégativité par rapport au reste du groupe.
Halogénures de béryllium (≠BeF2) sont des molécules covalentes :
Les halogénures de Be , à l’exception du fluorure de béryllium, possèdent un caractère covalent marqué avec de faibles températures de fusion ,une mauvaise conductibilité électrique à l’état fondu et une solubilité dans les solvants organiques .Les halogénures des autres éléments du groupe 2 ont par contre un caractère ionique.
D’autre part , tout comme AlCl3 , les molécules solides de BeCl2 polymérisent en de longues chaînes en formant des liaisons de coordination (L’atome de Cl est donneur et l’atome de Be est accepteur de liaison dative).
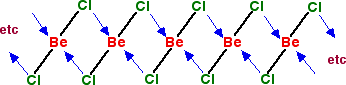
Figure 10– Polymère de BeCl2
Hydroxyde de béryllium est amphotère :
Amphotère signifie qu’il peut réagir avec les acides et les bases pour former des sels.
L’hydroxyde de béryllium réagit avec les acides pour former des sels de béryllium.
Par
exemple: Be(OH)
2
+ H SO
2 4
BeSO
4
+ 2H O
2
L’hydroxyde de béryllium réagit également avec des bases telles que la solution d’hydroxyde de sodium pour donner une solution incolore de tétrahydroxoberyllate de sodium.
Be(OH) + 2NaOH Na Be(OH)
2 2 4
Les hydroxydes des autres métaux du groupe 2 sont tous des bases.
Ils réagissent avec les acides pour former des sels.
Par exemple:
Ca(OH)
2
+ 2HCl CaCl
2
+ 2H O
2
Usages industriels et médicaux :
Usages industriels :
Béryllium :
Le Be est utilisé en aéronautique , dans la fabrication de missiles et satellites de communication.
Le Be absorbe peu le rayonnement X, il est utilisé comme fenêtre des tubes de production
de rayonnement X.
Magnésium :
Le magnésium possède de nombreuses applications industrielles de par ses qualités majeures :
-C’est le plus léger des matériaux de structure ; 33% plus léger que l’aluminium.
-Sa forte résistance aux chocs.
-Ses réserves abondantes (eaux de mers).
-Le fait qu’il soit entièrement recyclable.
Mg est employé comme additif pour la fabrication d’alliages légers utilisé en industrie (aéronautique, automobile, équipement photo, optique…)
Mg intervient dans la synthèse de produits organiques , tels que les organomagnésiens de
formule RMgX produit par la réaction de Grignard, ou R est un radical alcoyle ou aryl et X un halogène (iode, brome ou chlore).
Ex : CH3I + Mg CH3MgI
Mg est utilisé en métallurgie pour l’élimination du soufre contenu dans les aciers et fers.
Mg est utilisé en pyrotechnie (Feux d’artifices).
MgCO
3
entre dans la fabrication de briques réfractaires, d’encres et de caoutchouc.
MgCl
2
sert à la préparation du magnésium et à la fabrication de textiles et de papiers.
MgO intervient dans la synthèse de produits réfractaires, céramiques, ciments ainsi que dans la fabrication de textiles, d’engrais et de cosmétiques.
Calcium :
Ca est utilisé comme additif dans certains alliages d’aluminium.
Ca est employé comme réducteur dans la production d’autres métaux.
CaSO
3
CaSO
4
est un agent de blanchiment dans l’industrie du papier.
est utilisé dans la fabrication de plâtre qui sert à la décoration des plafonds de
maisons.
CaCO est ajouté au papier pour le rendre : luisant, opaque, lisse et accroître sa capacité à
3
absorber l’encre.
Strontium :
SrCO3 sert à la manufacture de verres spéciaux (verre des écrans de télévision).
Le nitrate ou chlorate de Sr sont employés dans les feux d’artifice et les fusées de détresse pour donner une teinte rouge.
Le Sr peut être ajouté à certains alliages d’aluminium pour l’amélioration de leurs propriétés mécaniques.
Usages médicaux :
Magnésium :
Du point de vue biologique, le magnésium fait partie des oligoéléments de l’organisme.
Il joue un rôle dans le transport des substrats, dans la transmission de l’influx nerveux .
Il lutte contre le stress et catalyse de nombreuses réactions métaboliques.
La carence en magnésium se signale par une hyperexcitabilité neuromusculaire, une tétanie, des crampes, des tremblements, des troubles digestifs, l’irritabilité et l’insomnie.
Le magnésium est utilisé sous différentes formes de sels solubles (chlorure, sulfate, pidolate…) ou administré sous des formes insolubles (carbonate ou oxyde) pour leurs propriétés antiacides, purgatives et comme sédatif nerveux.
Mg(OH)2 est utilisé comme antiacide pour lutter contre les aigreurs d’estomac (Maalox).
MgCl2 est utilisé dans les supplémentations vitaminiques.
MgSO4 est utilisé comme purgatif.
MgCO3 est utilisé comme excipient, c’est un agent de remplissage des gélules et un diluant pour la fabrication des comprimés.
Il est également employé comme agent adsorbant.
Il fait effervescence au contact des acides organiques tels que l’acide citrique.
Le magnésium peut être utilisé par voie parentérale sous forme de sulfate de magnésium ou de pidolate :
dans le traitement des crises convulsives de l’éclampsie.
pour la prévention de l’accouchement prématuré, car il inhibe les contractions utérines.
pour la prévention des troubles du rythme cardiaque, en particulier les torsades de pointes, notamment dans la phase aiguë de l’infarctus du myocarde où il réduirait la mortalité lorsqu’il est administré précocement.
dans le traitement des intoxications digitaliques pour son effet anticalcique.
Calcium :
Le calcium est un élément indispensable dans la constitution et la solidité des os et des dents.
Il participe au fonctionnement du système nerveux et du système cardiaque ; de plus il intervient dans le processus de la coagulation sanguine.
Le calcium est utilisé pour des problèmes liés au métabolisme osseux en association, le plus souvent, avec un traitement par de la vitamine D.
Mais l’excès en calcium nuit aussi, car il peut engendrer des calculs rénaux.
Une supplémentation en calcium peut être nécessaire lorsque l’alimentation n’en apporte pas une quantité suffisante, notamment lors de la croissance, de la grossesse et de l’allaitement.
Elle pourrait aussi ralentir la détérioration osseuse et prévenir les risques d’ostéoporose et les troubles qui en découlent.
Il existe diverses préparations pharmaceutiques contenant du calcium comme principe actif essentiel, destinées à être administrées par voie buccale ou injectable.
Les formes injectables sont utilisées pour traiter les hypocalcémies aiguës.
Les formes orales sont destinées à la prévention et au traitement du rachitisme et de l’ostéoporose.
Chaque unité de prise contient habituellement 500 mg de calcium sous diverses formes, carbonate, gluconate, phosphate.
A dose élevée, le carbonate de calcium est prescrit dans une indication particulière, le traitement de l’ostéodystrophie rénale (caractérisée par une hyperphosphatémie, une hypocalcémie et une hypersécrétion de parathormone).
L’apport de calcium élève la calcémie et réduit l’hypersécrétion de parathormone.
CaCO3 est employé en cosmétologie comme agent abrasif dans les dentifrices.
CaSO4 sert à la fabrication de plâtre utilisé en orthopédie pour les fractures des os.
CaSO4 dihydraté non-hygroscopique est employé comme diluant durcisseur pour comprimés.
Strontium :
Le ranélate de strontium est indiqué dans le traitement de l’ostéoporose post-ménopausique où il réduirait le risque de fractures vertébrales et de la hanche.
On utilise par ailleurs du strontium radioactif dans le traitement des métastases osseuses.
L’isotope radioactif administré est le Sr 89 dont la demi-vie est de 50 jours.
Il s’accumule dans les métastases osseuses qui sont ainsi préférentiellement irradiées.
Sa principale indication
est le traitement palliatif des douleurs dues aux métastases osseuses du cancer de la prostate.
Pour favoriser la captation et la fixation du strontium radioactif, il faut arrêter toute supplémentation calcique pendant au moins deux semaines avant son administration.
Baryum :
Le sulfate de baryum (lavement baryté) est utilisé comme produit de contraste en radiologie pour la radiographie de l’appareil digestif, car il reste insoluble même à l’épreuve des sucs acides de l’estomac.
Glossaire
Abrasif : Substance permettant par frottement de nettoyer et de polir.
Administration parentérale : Toute administration qui se fait autrement que par la bouche ou le rectum.
Exemple : administration par voie intraveineuse, administration intramusculaire et administration sous-cutanée.
Alliage métallique : Combinaison d’un métal avec un ou plusieurs autres éléments.
Le fait d’ajouter d’autres éléments permet de « durcir » (augmenter les caractéristiques mécaniques) et/ou de modifier les caractéristiques chimiques des métaux (en particulier leur comportement à la corrosion).
Alumine : Oxyde d’aluminium (Al2O3) obtenue par raffinage d’un minerai de bauxite.
Anode : Electrode d’arrivée de courant dans un milieu de conductivité différente.
Dans une cellule d’électrolyse, la polarité est inversée et l’anode constitue le pôle positif.
Antiacide : Médicament administré pour soulager l’indigestion et les aigreurs d’estomac.
Anhydre : Se dit d’une substance ne contenant pas d’eau.
Bec Bunsen : Appareil de laboratoire qui produit une flamme.
Calcination : Action de soumettre un produit à une haute température afin de provoquer une réaction chimique particulière.
Calcul rénal : Particule solide formée dans le rein par précipitation de substances normalement dissoutes dans l’urine.
Cancer : Maladie due au développement anarchique et incontrôlable de certaines cellules de l’organisme.
Ces cellules anormales, capables de se multiplier indéfiniment, peuvent envahir des organes ou des vaisseaux sanguins et lymphatiques, formant à distance de nouvelles tumeurs, appelées métastases.
On classe les cancers en tumeurs solides (qui se développent à partir d’un organe visible) et en tumeurs liquidiennes, qui proviennent des cellules de la moelle osseuse (leucémies notamment).
Cathode : Electrode de sortie de courant dans un milieu de conductivité différente.
Dans une cellule d’électrolyse, la polarité est inversée et la cathode constitue le pôle négatif.
Chlorophylle : Colorant vert de la feuille.
Lieu actif de la photosynthèse.
Composé : Substance renfermant des atomes ou des ions de plus d’un élément dans des proportions fixes définies.
Conducteur : Tout corps capable de transmettre la chaleur et/ou l’électricité.
Conductivité électrique : Aptitude d’un matériau à laisser les charges électriques se déplacer librement, autrement dit à permettre le passage du courant électrique.
Conductivité thermique : Aptitude d’un matériau à transmettre la chaleur.
Convulsions : Contractions involontaires limitées à quelques muscles ou généralisées à tout le corps.
Elles sont dues à une souffrance ou à une stimulation excessive du cerveau.
Crampes : Contractions musculaires involontaires occasionnant des douleurs pouvant être intenses.
Densité : Nombre décimal représentant le rapport entre la masse volumique du corps et la masse volumique du corps de référence dans des conditions bien déterminées.
Le corps de référence est l’eau pour les solides et les liquides et l’air pour les gaz.
Ductile : Se dit d’un matériau qui peut s’étirer sans se rompre.
Dureté : C’est la résistance d’un corps solide à la destruction de sa structure.
Eclampsie : Complication survenant en fin de grossesse, se traduisant par des œdèmes, la présence de protéines dans les urines et une hypertension artérielle.
Electrolyse : Décomposition chimique de certaines substances en fusion ou en solution , produite par un courant électrique ; c’est une réaction d’oxydoréduction forcée par un apport d’énergie sous forme de courant électrique.
Quand on établit une différence de potentiel au moyen d’un générateur entre l‘anode et la cathode , un champ électrique est créé dans l’électrolyte .
Les ions positifs ou anions, se dirigent vers la cathode et sont réduits (gagnent des électrons) sous forme de métal, tandis que les ions négatifs ou cations se dirigent vers l’anode et sont oxydés (perdent des électrons).
Electrolyte : Milieu liquide ou solide permettant la conduction du courant électrique via le déplacement des ions qu’il contient.
Electron : Particule élémentaire chargée négativement, qui gravite autour du noyau des atomes.
Electrons de valence : Electrons situés sur la couche électronique la plus externe.
Electrode : Elément conducteur captant ou libérant un courant électrique.
Certains appareils électriques comportent généralement deux électrodes, une anode et une cathode, chacune reliée aux deux bornes de branchement de l’appareil.
Electronégativité : Aptitude d’un atome à attirer des électrons vers lui lorsqu’il est dans un composé.
Elémentaire : Se dit d’une particule qui ne peut être décomposée en fragments de matière plus petits.
Energie d’ionisation : Energie nécessaire pour arracher un électron d’un atome à l’état gazeux.
Etat d’oxydation : Correspond au nombre d’électron(s) perdu(s) ou gagné(s), il est compris entre
0 et VII et s’écrit toujours en chiffres romains.
Filtration : Procédé de séparation permettant de séparer les constituants d’un mélange qui possède une phase liquide et une phase solide au travers d’un milieu poreux.
L’utilisation d’un filtre permet de retenir les particules du mélange hétérogène qui sont plus grosses que les trous du filtre (porosité).
Le liquide ayant subi la filtration se nomme filtrat, et ce que le filtre retient se nomme résidu.
Graphite : Une des formes cristalline naturelle du carbone.
Groupe : Ensemble d’éléments ayant des propriétés chimiques similaires; ensemble des éléments d’une colonne (verticale) dans le tableau périodique ; aussi appelé famille.
Halogénure : Minéral dont le groupe anionique est un halogène.
Hydrate : Se dit des corps contenant des molécules d’eau dans leur composition chimique.
Hydrolyse : Décomposition d’une substance par l’eau.
Hydroxyde : Minéral dont le groupe anionique est constitué d’ion hydroxyle (OH–).
Hygroscopique : Substance qui a tendance à absorber l’humidité de l’air, par absorption ou par adsorption.
Ion : Atome ou molécule portant une charge.
On parle de cation dans le cas d’une charge positive et d’anion dans le cas d’une charge négative.
Isotope : Variété d’un élément qui a le même nombre de protons mais un nombre différent de neutrons dans le noyau.
Les isotopes d’un même élément ont le même nombre atomique mais une masse atomique différente.
IUPAC : Union internationale de chimie pure et appliquée ; organisme fixant les conventions utilisées par les chimistes.
Métallurgie : Science des matériaux qui étudie les métaux, leurs élaborations, leurs propriétés et leurs traitements.
Métastase : Propagation d’une maladie maligne d’une partie du corps à une autre attribuable à la migration de cellules malignes à travers le système sanguin ou le système lymphatique.
Minerai: Roche ou minéral contenant des éléments chimiques en pourcentage suffisant pour justifier son exploitation.
Numéro atomique (Z) : Nombre de protons du noyau d’un atome.
Ostéoporose : Fragilisation des os, qui deviennent poreux et cassants.
Oligoélément : Substance présente en très faible quantité dans l’organisme humain mais néanmoins indispensable à celui-ci.
Organomagnésien : Composé associant un magnésium et un ligand organique renfermant au moins une liaison carbone métal.
Ostéodystrophie rénale : Maladie qui apparaît à un stade avancé de l’ insuffisance rénale chronique , elle est liée à une hyperparathyroïdie , secondaire au dysfonctionnement rénal.
Oxydant : Entité chimique capable de capter (ou de gagner) un ou plusieurs électrons.
Oxydation : Réaction au cours de laquelle un atome ou un ion perd des électrons.
Parathormone : Hormone sécrétée par les glandes parathyroïdes (situées dans le cou), dont le rôle consiste à réguler les taux de calcium et de phosphore dans le sang.
Passivation : Formation d’une couche superficielle servant de barrière aux espèces corrosives.
Polymère : Molécule constituée de la répétition de nombreuses sous-unités.
produit de contraste : Liquide – le plus souvent injecté dans une veine – qui permet en radiologie d’accroître le contraste visuel entre les tissus que l’on cherche à voir et les tissus environnants.
Produits réfractaires : Produits qui résistent par nature aux températures élevées. Prostate : Organe génital masculin dont la sécrétion contribue à la formation du sperme. Purgatif : Qui favorise l’évacuation des selles.
Rachitisme : Maladie de la croissance due à un déficit en vitamine D.
Elle se traduit par une déformation des os et des cartilages, et des troubles de l’état général.
Radioactivité : Propriété que possèdent certains éléments naturels ou artificiels d’émettre spontanément de rayonnements durant leur désintégration.
Rayons X : Rayonnement électromagnétique.
Réaction d’oxydo-réduction : Réaction chimique au cours de laquelle se produit un transfert d’électrons.
L’espèce chimique qui capte les électrons est appelée oxydant et celle qui les cède, réducteur.
Réducteur : Entité chimique capable de perdre des électrons.
Réduction : Réaction au cours de laquelle un atome ou un ion gagne des électrons cédés par un réducteur.
Saumure : Eau dont la concentration en sel est très élevée.
Sédatif : Médicament servant à réduire la souffrance physique ou mentale, à calmer les émotions ou à réduire le niveau d’éveil ou la réactivité du patient.
Sel fondu : Sel en phase liquide tandis qu’il est normalement en phase solide dans les conditions normales de température et de pression
Solvant : Substance dans laquelle un soluté se dissout pour former une solution.
Suc gastrique : Liquide biologique produit par les glandes de la paroi de l’estomac (glandes gastriques).
Système cristallin : Système de classement des cristaux sur la base de leurs caractéristiques de symétrie.
Température d’ébullition : Température de passage d’un corps de l’état liquide vers l’état vapeur.
Température de fusion : Température de passage d’un corps de l’état solide vers l’état liquide.
Tension : Différence de potentiel électrique entre deux points d’un circuit électrique (électrode positive et électrode négative).
La tension est exprimée en volts [V].
Tétanie : Crispation musculaire accompagnée de tremblements, survenant par crises.
Ces crises peuvent être dues à un stress ou plus rarement à un manque de calcium.
Torsades de pointes : Troubles du rythme cardiaque graves.
Traitement palliatif : Traitement qui tente d’atténuer les symptômes d’une maladie incurable.
..

