BIOENERGETIQUE
Introduction :
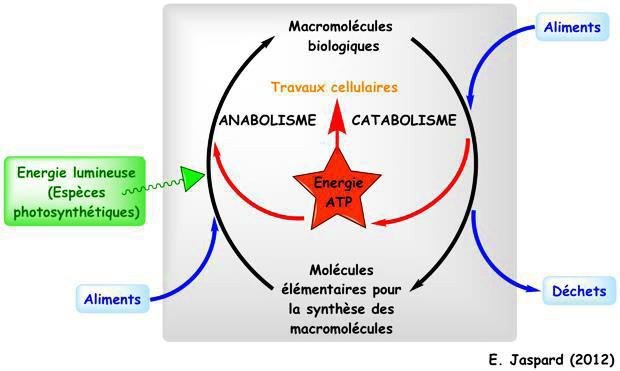
Tous les organismes vivants nécessitent de l’énergie pour accomplir les différentes fonctions indispensables à leur vie (chaleur, travail mécanique, osmotique, chimique…).
Ces organismes peuvent être divisés en deux classes :
les phototrophes = autotrophes : reçoivent l’énergie lumineuse du soleil et la convertissent en une énergie chimique sous forme de molécules organiques complexes.
les chimiotrophes = héterotrophes : qui vont oxyder, grâces aux réactions du métabolisme, ces molécules organiques pour en extraire de l’énergie.
La bioénergétique est la partie de la biochimie qui étudie et explique les mécanismes de transformation de l’énergie dans les tissus vivants.
“Rien ne se perd, rien ne se crée, tout se transforme”
(Antoine-Laurent de Lavoisier)
Définitions élémentaires :
environnement
système
univers
limite réelle ou fictive
Energie :
Viens du grec « en ergo » = qui agit en dedans → propriété d’agir contenue dans un corps.
C’est une propriété de la matière qui lui permet de se transformer en travail.
Thermodynamique :
Viens du grec « thermos + dynamo» = chaleur+ travailler → travail obtenu à l’aide de la chaleur.
Actuellement ce terme est utilisé pour décrire la science qui étudie les processus de transformation d’énergie d’une forme à une autre.
Bioénergétique :
C’est l’étude quantitative des échanges d’énergie se produisant dans les cellules vivantes.
Notions de bases de la thermodynamique :
Notion de système :
Définition :
Un système est toute portion de l’espace (univers) qui contient la matière que l’on veut étudier.
Tout ce qui entoure ce système est appelé environnement (milieu extérieur).
Types de systèmes :
Le système peut être soit :
Isolé (adiabatique): il n’y a aucun échange
de matière ni d’énergie entre le système et l’environnement.
Fermé : le système permet des échanges d’énergie, mais il n’ya pas d’échanges de matière entre le système et l’environnement.
Ouvert : il existe des échanges de matière et d’énergie entre le système et l’environnement.
Caractéristiques de l’état d’un système :
Variables d’état :
L’état d’équilibre d’un système est caractérisé par des grandeurs mesurables appelées variables d’état :
Variables extensives : proportionnelle à la quantité de matière (Volume, masse, nombre de molécules) ;
Variables intensives : non proportionnelle à la quantité de matière (pression, température).
Fonctions d’état :
Caractérise l’évolution des variables d’état lorsque le système passe d’un état initial à un état final :
Energie interne (U) ;
Enthalpie (H) ;
Entropie (S) ;
Enthalpie libre (G).
Principes de Bases de la thermodynamique :
On appelle principe une relation fondamentale qu’on a besoin de considérer comme exacte
pour pouvoir comprendre et expliquer une série de phénomènes.
Premier principe : Principe de la conservation d’énergie
Il postule que dans n’importe quelle transformation physique ou chimique, la quantité d’énergie de l’univers demeure constante. « L’énergie se conserve, elle ne peut être ni créée ni détruite, mais seulement transformée d’une forme à une autre. »
Energie interne du système (U) :
Cette fonction d’état caractérise l’état énergétique d’un système.
Si le système passe d’un état initial à un état final, il subit une variation de son energie interne.
∆U= Uf-Ui=Q+W
U : énergie interne J/MOL
Q : chaleur échangée avec le système
W : travail exercé par le système.
Enthalpie (H):
Quantité de chaleur échangée par le système au cours d’une transformation réalisée à
pression constante.
ΔH = Qp
ΔH : enthalpie fonction d’état J/MOL
ΔH < 0 la transformation libère de la chaleur le processus exothermique. Ex : Combustion.
ΔH > 0 la transformation libère de la chaleur le processus endothermique. Ex : Fondre de la glace.
Deuxième principe : principe de la dégradation
Il énonce que tous les phénomènes physiques et chimiques évoluent dans le sens qui produit l’état le plus désordonné d’énergie compatible avec les conditions du système.
Notion d’irréversibilité
Les transformations naturelles se font spontanément au cours du temps dans un sens donné mais le retour à l’état initial (sens inverse) est impossible sans apport d’énergie externe = processus irréversible
Ex :
Différence de concentrations ioniques entre deux compartiments
Milieu Milieu Milieux homogènes
Concentré peu concentré
Différence de température

T= 20°C
T= 60°C
T= 40°C
T= 40°C
Notion d’enthropie (S) :
Fonction d’état extensive, c’est une forme d’énergie incapable de fournir du travail.
Elle permet de mesurer le degré du désordre d’un système.
L’entropie augmente au cours de toute transformation spontanée. Ex :

Qdésordre
Notion d’enthalpie libre de Gibbs (G):
L’enthalpie (H) n’est pas entièrement utilisée pour fournir du travail.
La part non utilisable correspond à l’entropie (S) ; celle utilisée correspond à l’enthalpie libre de Gibbs (G)

ΔH : enthalpie fonction d’état J/MOL ΔG : énergie libre fonction d’état J/MOL T : Température° kelvin
ΔS : Variation d’entropie.
Elle exprime la quantité d’énergie maximale capable de fournir du travail lors d’une réaction à T et à P constantes.
C’est un paramètre très utile dans l’évaluation, des quantités d’énergie mise en évidence au cours des réactions métaboliques.
C’est une énergie difficilement mesurable cependant, au cours des réactions de transformation, il est possible de mesurer la variation de l’énergie libre d’une substance.
Sens des réactions et équilibre :
Tous les systèmes tendent spontanément vers un état d’équilibre, car cet état est plus stable.
En conséquence, la capacité d’un système à fournir un travail utile diminue à mesure que ce système se rapproche de son état d’équilibre.
ΔG =0. le système ne peut plus fournir de travail c’est l’état d’équilibre:
ΔG < 0 la réaction se déroule spontanément. processus exergonique.
ΔG > 0, il faut un apport d’énergie du milieu extérieur au système pour que le processus ait lieu. processus endergonique.
Soit la réaction :
Réaction d’ordre 1
La variation d’énergie libre est donnée par la formule suivante :
ΔG = ΔG0’ + RT ln [B] / [A]
ΔG = ΔG0’ + 2,3 RT log [B] / [A]
ΔG : Variation d’énergie libre de Gibbs d’une réaction (J/mol)
ΔG0’ : Variation d’énergie libre standard biologique de Gibbs (J/mol)
T : Température absolue ° kelvin (0°C +273)° KELVIN
R : Constante des gaz parfait (8.315 J/°K.mol)
(1.98 cal /°K. mol)
/[A] : Rapport des concentrations produits / réactifs
Conditions de l’état standard :
Caractéristiques de ΔG0’et ΔG0 :
ΔG0’ : variation d’énergie libre standard en biochimie
à pH = 7
– À t° = 25°C
Pour une concentration de A et de B = 1M
ΔG0 : variation d’énergie libre standard mesurée en chimie :
à un pH = 0
– À t° = 25°C
Pour une concentration de A et de B = 1M
ΔG0’ :
Est une constante caractéristique pour chaque réaction ;
A une valeur invariable ;
Indique dans quel sens et avec quelle amplitude la réaction va se produire dans les conditions standards.
ΔG dépend :
de la nature de la réaction ;
du pH ;
de la température ;
des concentrations initiales de A et B.
Relation entre ΔG0’ et constante d’équilibre :
Soit la réaction :
αA βB
On a :
ΔG = ΔG0’ + RT Ln [B]β ∕ [A]α
A l’équilibre:
ΔG=0 = ΔG0’ + RT Ln [B]β ∕ [A]α
k’eq = [B]β ∕ [A]α
ΔG0’ = − RT Ln [B]β ∕ [A]α
ΔG0’ = − 2,3 RT Log k’eq
Cette expression permet de déterminer la concentration des produits et réactifs à l’équilibre ainsi que ΔG0’.
Ex : La phosphoglucoisomérase catalyse la réaction :
Glucose-6-Phosphate Fructose-6-Phosphate
Avec Keq = 2
On en déduit que : ΔG°’= – 8,314 x 298 x ln2 = -1.7 kJ/mol.
Remarque :
Pour une réaction d’ordre 2
αA + βB δC + εD
ΔG = ΔG0’ + 2.3 RT Log ([C]ᵟ [D]ᵋ/ [A]α[ B]β)
Propriété additive de l’énergie libre de Gibbs :
La variation d’énergie libre ∆G d’une réaction ne dépend que de l’état initial et de l’état final, elle est indépendante de la voie de transformation.
La variation d’énergie libre d’une séquence de réactions et égale à la somme des ∆G de
chaque réaction individuelle.

∆G= GB – GA = ∆G1 + ∆G2 = ∆G3 + ∆G4.
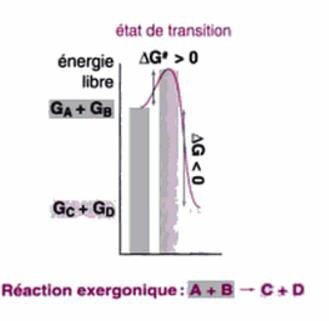
Notion d’énergie libre d’activation :
S
P
La plus part des réactions exergoniques ont lieu lentement car l’état initial S (Haute énergie libre) est séparé de l’état final P (à basse énergie libre) par un état de transition d’énergie libre supérieure à l’état initial.
La différence de l’énergie libre entre l’état initial et l’état de transition est l’énergie libre d’activation ΔG#
Pour que la réaction ait lieu, les molécules doivent surmonter cette barrière, et leur niveau de d’énergie doit donc s’élever.
Comment ? Diminution de ΔG# par agitation thermique ou par un catalyseur (enzyme au niveau cellulaire).
La vitesse d’une réaction est inversement proportionnelle au ΔG#.
Notion du couplage :
Le couplage énergétique associe une réaction endergonique (ΔG > 0) à une réaction exergonique (ΔG < 0).
Conditions du couplage :
– ΔG1+ΔG2 < 0
– Présence d’un intermédiaire commun aux deux réactions.
Ex :
Glu + Pi G6P + H20 ΔG0’1= +13,8 KJ/mole
ATP + H20 ADP + Pi ΔG0’2= -30.5 KJ/mole
Glu + ATP G6P + ADP +Pi ΔG0’ T= – 16 ,7 KJ / mole.
Le potentiel d’oxydoréduction
Plan :
Introduction
Quelques rappels ;
Potentiel d’oxydoréduction :
Définition ;
Mesure du potentiel d’oxydoréduction;
Potentiel d’oxydoréduction dans les conditions standards E0 ;
Potentiel d’oxydoréduction en dehors des conditions standards ;
Relation entre potentiel d’oxydoréduction et variation d’énergie libre ;
Potentiels standards d’oxydoréduction de quelques couples ;
Enzymes d’oxydoréduction.
Introduction :
La plupart des réactions biologiques sont des réactions d’oxydoréduction impliquant un échange d’électrons (catabolisme = oxydations, anabolisme = réductions), en faisant intervenir des enzymes qui catalysent des réactions d’oxydoréduction appelées des oxydoréductases.
Quelques rappels :
Réaction d’oxydoréduction :
Réaction dans laquelle deux composés chimiques s’échangent des électrons.
le donneur d’électrons (riche en électrons) est appelé : Réducteur.
l’accepteur d’électrons (pauvre en électrons) est appelé : Oxydant.
Donc le 1er subit une oxydation et le 2nd une réduction.
Oxydation : C’est la perte d’électrons ;
Un atome s’oxyde quand il perd un ou plusieurs électrons ; Le réducteur subit une oxydation.
Réduction : C’est le gain d’électrons ;
Un atome se réduit quand il gagne un ou plusieurs électrons ; L’oxydant subit une réduction.
Ces deux réactions ont lieu simultanément (couplées)
Red1 Ox1 + ne– Oxydation (½réaction 1)
Red1 + Ox2 Ox1 + Red2
Ox2 + ne– Red2 Réduction (½réaction 2)
Le réducteur et l’oxydant de chaque demi réaction forment un couple redox :
Couple redox 1 : Ox1/ Red1
Couple redox 2 : Ox2/ Red2
Exemple : Fe2+ + Cu2+ Fe3+ + Cu+
Demi-réactions : Fe2+ Fe3+ + 1 é Oxydation
Cu2+ – 1 é Cu+ Réduction
Couple redox 1 : (Fe3+ / Fe2+) (Fe3+ est oxydant / Fe2+ est réducteur)
Couple redox 2: (Cu2+/ Cu+) (Cu2+ est oxydant /Cu+ est réducteur)
Les différents types de transfert des électrons :
Les électrons sont transférés d’une molécule à une autre par quatre moyens :
Par transfert direct
Ex : Fe2+ + Cu2+ Fe3+ + Cu+
Sous forme d’atome d’hydrogène (proton + électron)
Ex : AH2 + B A + BH2
Sous forme d’ion d’hydrure (H– =2é, H+).
Ex : déshydrogénase liée au NAD
Liaison avec un atome plus électronégatif (très souvent l’oxygène).
Ex : oxydation d’un glucide en alcool R-CH3 + ½ O2 R-CH2-OH
Potentiel d’oxydoréduction :
Définition :
Le potentiel d’oxydoréduction (E) est définit pour chaque couple redox. il permet de mesurer l’affinité pour les électrons.
Il renseigne sur l’aptitude de l’oxydant à gagner des électrons, ou du réducteur à en perdre.
NB : Potentiel d’oxydoréduction = énergie de transfert des électrons = force électromotrice.
Exprimé en volt et notée E.
Plus un système est oxydant, plus il est apte à capter des électrons→ Plus le potentiel
redox est élevé.
Plus il est réducteur plus il a tendance à céder des électrons → plus son potentiel
redox est bas.
Mesure du potentiel d’oxydoréduction:
La mesure d’un potentiel d’électro-réduction se fait expérimentalement à l’aide de deux demi-piles.
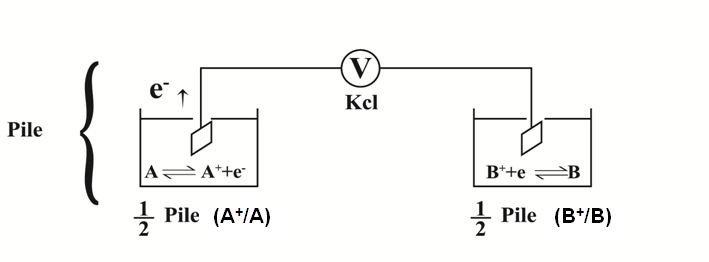
Ce dispositif est une pile : il permet de mesurer la différence de potentiel d’oxydoréduction (∆E) entre les 2 couples disposés dans les deux ½ piles :
A+/A et B+/B, dont les potentiels respectifs sont EA et EB
A+ + 1e– EA
B+ + 1e– EB
La solution de chaque couple est placée dans un récipient.
On introduit dans chaque solution une électrode.
On réalise ainsi pour chaque couple une demi-pile.
Les deux électrodes sont reliées par un voltmètre.
Le circuit est fermé par un pont de KCl.
Si A est plus réducteur que B les électrons vont circuler de A vers B.
Aux bornes du voltmètre on mesure une différence de potentiel (DDP) qui correspond à E =EB-EA.
Potentiel d’oxydoréduction dans les conditions standards E0 :

En pratique, pour mesurer le potentiel d’un couple redox on réalise une pile et l’une des demi-piles contient un couple redox de référence dont E = 0.
La référence standard au niveau de la ½ pile est celle de l’hydrogène gazeux :
H2 2H+ + 2é.
L’autre ½pile comporte le couple redox dont on veut mesurer le potentiel redox;
On travaille dans les conditions standards :
Température : 25°C (298°K)
Pression : 1 atmosphère
Concentration des formes oxydées et réduites = 1 mole.
En biochimie, dans les conditions cellulaires, le pH= 7 Le potentiel redox est noté
E°’
NB :
Pour l’hydrogène gazeux, dans les conditions standards : E° (2H+/H2) = 0 volt
pH= 0
A pH= 7 E°` (2H+/H2) = – 0.414 volts.
Les électrons vont se déplacer de la ½ pile ayant le potentiel de réduction standard le plus
faible vers la ½ pile ayant le potentiel de réduction le plus élevé.
Si les électrons se déplacent du couple redox étudié vers le couple 2H+/H2
E Couple étudié < 0 = E plus faible
Si les électrons se déplacent du couple 2H+ /H2 vers le couple étudié
E Couple étudié > 0
En résumé :
Dans une réaction d’oxydoréduction :
Le couple qui aura le plus petit potentiel redox va s’oxyder (donne les électrons)
Celui qui a le plus grand potentiel redox se réduit (capte les électrons).
Les composés les plus réducteurs ont le potentiel redox (E) le plus petit (faible affinité pour les électrons).
Exemple : (NAD+/NADH) = – 0.32volts.
Les composés les plus oxydants ont le potentiel redox (E) le plus grand (grande affinité pour les électrons).
Exemple: (O2/H2O) = 0.816 volts.
En dehors des conditions standards:
Le potentiel de réduction (E) en dehors des conditions standards est donné par la formule de NERNST.
E = E° + RT/nF ln [oxydant]/ [réducteur]
En biochimie :
E`= E°` + RT/nF ln [oxydant]/ [réducteur]
E` : potentiel d’oxydoréduction en volts (à pH=7).
E°` : potentiel d’oxydoréduction standard en volts.
R : constante des gaz parfaits (8,314 J/mol/°K).
T : température en °Kelvins.
n : nombre d’électrons transférés.
F : constante de Faraday = 96500 J/v/mol = 96.5 Kj/v/mol.
[oxydant] : concentration des formes oxydées (accepteur d’électrons).
[réducteur] : concentration des formes réduites (donneur d’électrons).
Relation entre potentiel d’oxydoréduction et variation d’énergie libre :
Dans une réaction d’oxydoréduction qui se déroule spontanément, l’échange d’électrons entre 2 couples redox A+/A et B+/B va entraîner une variation de potentiel positive (E>0) alors que sa variation d’énergie libre sera négative; (G<0),
Lorsqu’une réaction évolue dans un sens donnée G et E varient en sens opposés.
20
∆G = – nF ∆E ou ∆G°` = – nF ∆E°`
∆E°` : différence de potentiel redox standard entre le système donneur et le système accepteur d’électrons.
∆G°` : variation d’énergie libre standard.
n: nombre d’électrons transférés.
F : constante de Faraday
NB : Pour qu’une réaction redox se produise spontanément, il faut que
∆G°` < 0 ∆E°`> 0 (transfert d’électrons spontanément dans le sens des potentiels redox croissants).
IV.
Potentiels standards d’oxydoréduction de quelques couples :

Enzymes d’oxydoréduction :
Les réactions d’oxydoréduction sont catalysées par des enzymes : oxydoréductases.
Oxydases : – catalysent des réactions ou l’oxygène est l’accepteur final d’électrons.
AH2 + ½ O2 A + H2O
Ex : Glutathion oxydase.
Peroxydases : sont des oxydoréductases qui catalysent l’oxydation d’un substrat en présence du peroxyde d’hydrogène (H2O2).
La réaction globale est du type:
AH2 + H2O2 A + 2 H2O
Dans l’organisme, les peroxydases décomposent, en particulier, les composés peroxydes toxiques.
Déshydrogénases :
catalysent des réactions d’oxydoréduction où l’accepteur final n’est pas l’oxygène.
Utilisent des coenzymes qui sont des transporteurs d’électrons.
On trouve :
Les déshydrogénases à NAD ou NADP : transfert un ion hydrure H– (H+ ,2e-) NAD+ + 2é + 2H+ NADH, H+
NADP+ + 2é + 2H+ NADPH, H+
Exemple : (glycolyse
cytoplasme)
+
Glycéraldéhyde 3 P
Déshydrogénase
Glycéraldéhyde 3

P
+ NAD 3 P Glycérate + NADH, H+
Les déshydrogénases à FAD ou FMN :
FAD + 1H+ + 1é FADH + 1H+ + 1é
FADH2 FMN + 1H+ + 1é
FMNH + 1H+ + 1é
FMNH2
Exemple : β oxydation
Acyl CoA + FAD
Acyl CoA déshydrogénase
trans ∆2 Enoyl CoA + FADH2
Composés riches en énergie et ATP
Plan :
Introduction
Notions élémentaires :
Couplage énergétique ;
Notion de composés riches en énergie ;
Les différents types de liaisons riches en énergie ;
Principaux composes à haut potentiel d’hydrolyse ;
Etude de l’ATP :
Structure ;
Rôle de l’ATP ;
Hydrolyse de l’ATP ;
Synthèse de l’ATP ;
Conclusion
Introduction :
L’énergie emmagasinée dans les lipides, les glucides et les protéines doit être convertie en une forme d’énergie immédiatement utilisable.
Les réactions du catabolisme de ses molécules permettent d’en extraire de l’énergie permettant la production de coenzymes réduits utilisés pour la synthèse d’une forme d’énergie facilement mobilisable qui est l’ATP (Adénosine triphosphate).
C’est le donneur d’énergie libre utilisable lors de la plus part des processus nécessitant un apport énergétique.
ATP
Notions élementaires :
couplage énergétique :
A B exergonique ∆G°’1<0
C D endergonique ∆G°’2 >0
A + C B + D + chaleur
La réaction C D ne peut pas se produire spontanément, elle nécessite un apport extérieur d’énergie, cette énergie est apportée par la réaction A
B qui en produit.
Le transfert de l’énergie libre est assuré à partir de molécules riches en énergie.

Notion de composés riches en énergie :
Un composé riche en énergie est un composé comportant une liaison facilement hydrolysable et dont l’hydrolyse est accompagnée d’une libération d’énergie (diminution d’énergie libre).
Cette liaison facilement hydrolysable est appelée liaison riche en énergie. NB : La liaison riche en énergie est représentée par le symbole ~.
Les différents types de liaisons riches en énergie :
Liaison anhydride phosphorique
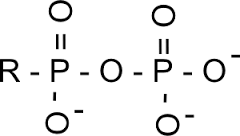
Exemple : ATP adénosine triphosphate
Liaison anhydride d’acide

Ex : 1 ,3.bisphosphoglycérate ΔG0’ = – 49 kJ/mol
Liaison énol phosphate
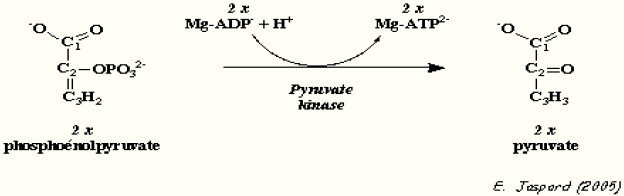
Ex : Phosphoénolpyruvate ΔG0’ = – 62 kJ/mol
Liaison thioester
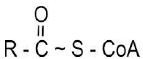
Ex : acétyle COA ΔG0’ = – 31 kJ/mol
Principaux composés à haut potentiel d’hydrolyse :

Etude de l’ATP :
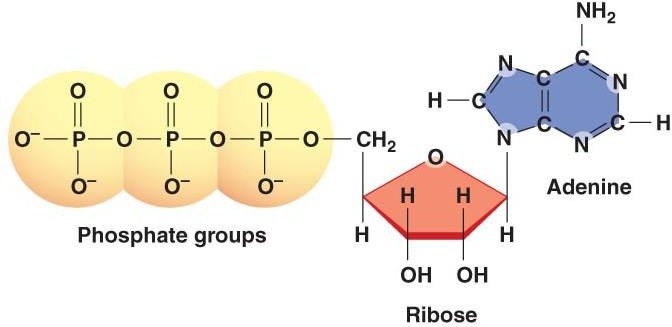
Structure :

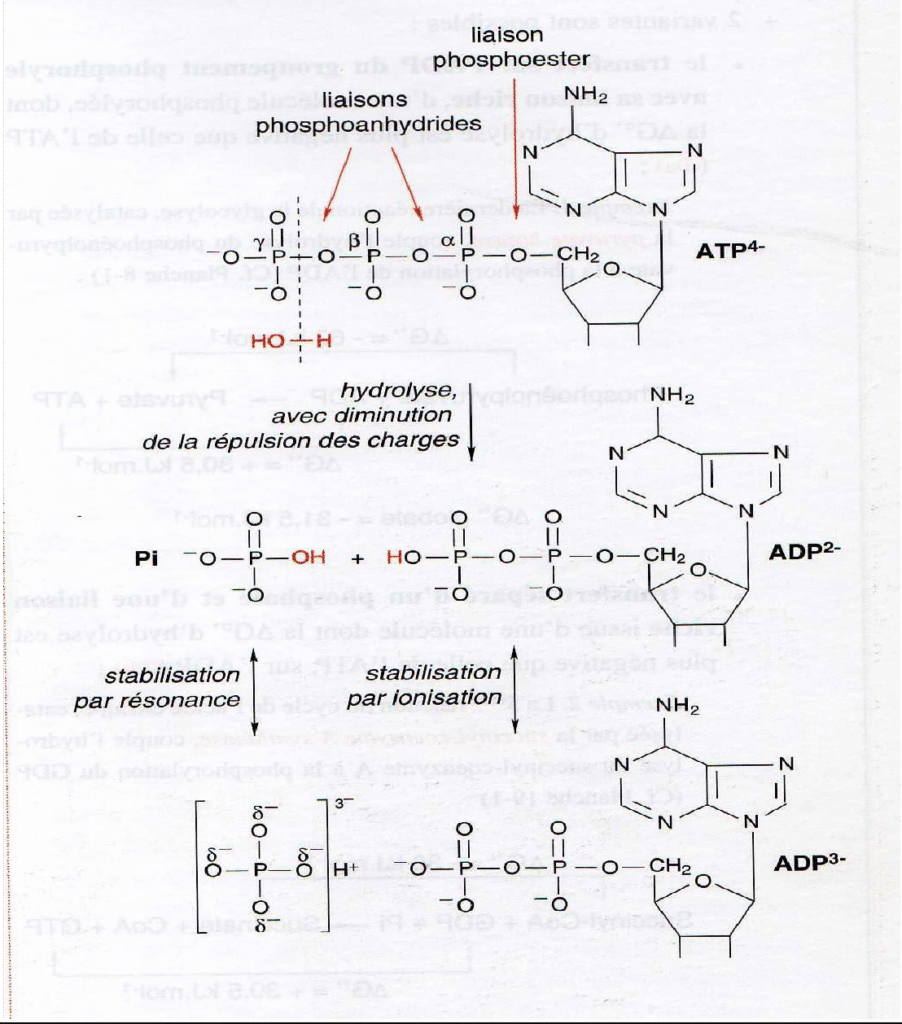
L’ATP est un nucléotide constitué de :
Base azotée purique : Adénine.
β.D ribose.
3 Groupements phosphates (α, β, γ)
2 Liaisons riches en énergie (liaisons anhydrides phosphoriques).
L’adénine est liée au ribose par une liaison N glycosidique pour donner l’adénosine.
Les 3 groupements phosphates sont liées à l’adénosine par une liaison ester.
Les fonctions (OH) des acides phosphoriques sont fortement ionisées au PH
physiologique.
NB : Il existe des formes mono phosphoriques et di phosphoriques de l’adénosine.

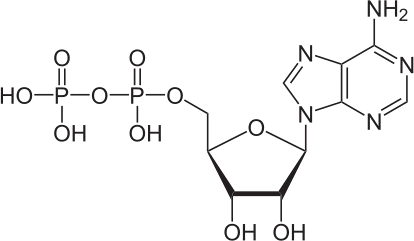
Adénosine monophosphate (AMP) Adénosine di phosphate (ADP)
Remarque : La forme active de l’ATP est un complexe ATP- Mg2+

Rôle de l’ATP:
Son rôle principal est de donner l’énergie nécessaire aux réactions métaboliques endergoniques par hydrolyse de ses liaisons riches en énergie.
Donneur de groupements phosphates.
Il représente l’un des matériaux de construction nécessaire pour la synthèse des acides nucléiques.
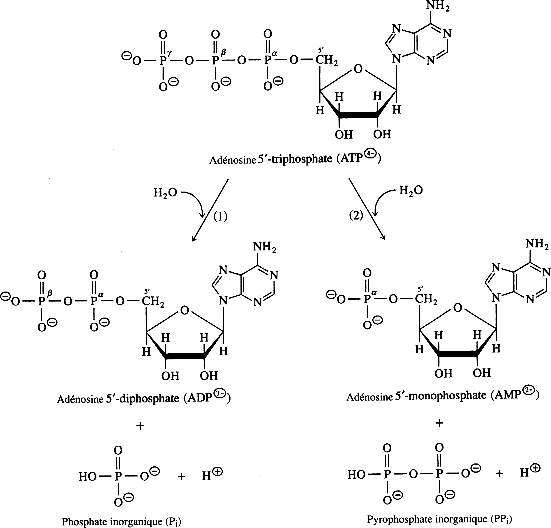
Hydrolyse de l’ATP :
L’ATP peut perdre un phosphore pour donner de l’ADP ou deux phosphores et donner de l’AMP.
ATP + H2O ADP + Pi + H+ ∆G°’ = – 30.5 KJ/mole (-7.3Kcal/mole).
ATP + H2O AMP + PPi + H+ ∆G°’ = – 32.2 KJ/mole (-7.7Kcal/mole).
Deux facteurs sont importants:
La déstabilisation due à la tension de la liaison provoquée par la répulsion électrostatique
La stabilisation des produits d’hydrolyse par résonnance et ionisation.
ATP ADP :
ATP + H2O ADP + Pi + H+
ΔG°’= – 30,5 KJ/mole
∆G = ∆G°’ + RT ln [ADP] [Pi] /[ATP]
Ex: Phosphorylation du glucose :
Glu + Pi Glu 6 P + H2O ∆G°’1 = 13.8 KJ/mole (Réaction endergonique).
ATP + H2O ADP + Pi ∆G°’2 = – 30,5 KJ/mole (Réaction exergonique).
Couplage entre les 2 réactions :
∆G°’= ∆G°’1 + ∆G°’2 = 13.8 – 30,5
Réaction exergonique irréversible.
∆G°’= -16.7 KJ/mole
ATP AMP :
ATP + 2H2O AMP + PPi + H3O ΔG°’= – 32 ,2 KJ/mole
Synthèse :
L’ATP est synthétisé par phosphorylation de l’ADP
ADP + Pi ATP ΔG°’= +30,5 kJ/mole
C’est une réaction endergonique qui nécessite un apport d’énergie.
Il existe deux modes de phosphorylation différents :
Les réactions de phosphorylation liées au substrat :
C’est un couplage entre la réaction de synthèse de l’ATP (endergonique) et une réaction d’hydrolyse d’une molécule riche en énergie (exergonique).
On note que ∆G°’ de ces molécules riches en énergie > ∆Gp (∆G de phosphorolyse) de l’ATP ;
Elles ont lieu en aérobiose et en anaérobiose ;
Ce mode produit moins de 10% de l’ATP cellulaire.

| Ex : | ||
| Phosphoénolpyruvate | Pyruvate + Pi | ΔG°’= -62 kJ/mole |
| ADP + Pi | ATP | ΔG°’= +30,5 kJ/mole |
| Phosphoénolpyruvate + ADP | Pyruvate + ATP | ΔG°’ globale = -31,5 kJ/mole |
Les oxydations phosphorylantes :
31
Elles réalisent un couplage entre oxydation et phosphorylation en utilisant l’énergie crée par un gradient de protons de part et d’autre de la membrane interne mitochondriale.
Elles ne peuvent avoir lieu qu’en aérobiose ;
Elles contribuent à la formation de plus de 90% de l’ATP cellulaire.


Conclusion:
L’ATP se comporte comme une monnaie énergétique permettant d’assurer l’énergie nécessaire aux différentes fonctions cellulaires.
L’ATP constitue ainsi le lien (intermédiaire) entre les réactions du catabolisme et de l’anabolisme.

Chaine respiratoire et oxydations
phosphorylantes
Plan :
Introduction
Définition ;
Localisation ;
La chaine respiratoire :
Les constituants ;
Enchainement des transporteurs mitochondriaux d’électrons ;
Fonctionnement de la chaine ;
Mécanisme de la phosphorylation oxydative :
ATP synthase ;
Théories expliquant la phosphorylation oxydative ;
– Théorie chimio-osmotique
Bilan énergétique :
Rendement énergétique de la chaine respiratoire/phosphorylation oxydative ;
Différence du rendement entre les molécules matricielles et cytosoliques – notion de navettes ;
Les inhibiteurs et agents de découplage de la chaine respiratoire et la phosphorylation oxydative ;
Conclusion.
Introduction :
Les différentes réactions du catabolisme des lipides, glucides et parfois les protéines (glycolyse, β oxydation des acides gras, catabolisme des acides aminés, cycle de Krebs) enlèvent aux substrats des atomes d’hydrogène (protons+ électrons) qui sont pris en charge par les coenzymes NAD et FAD.
La réoxydation des NADH, H+ et FADH2 produits, est indispensable à l’entretien du catabolisme.
Cette reoxydation est couplée à la synthèse de l’ATP par un processus appelé phosphorylation oxydative ou oxydations phosphorylantes (dénomination plus appropriée car les oxydations précèdent la phosphorylation).
Définition :
La phosphorylation oxydative est le processus permettant la phosphorylation de l’ADP en ATP grâce à l’énergie libérée par l’oxydation de donneurs d’électrons par la chaîne respiratoire.
Au cours de la phosphorylation oxydative, des électrons sont transférés des coenzymes réduits jusqu’ à l’oxygène le long d’une chaîne de transport d’électrons libérant progressivement de l’énergie qui est utilisée pour la synthèse de l’ATP.
Localisation :
Le transport des électrons provenant des coenzymes réduits jusqu’à l’oxygène couplé à la phosphorylation de l’ADP en ATP se produit à l’intérieur de la mitochondrie.
La mitochondrie :
Définition :
– Organite intracellulaire qui constitue le siège de la respiration, son rôle principal est la production d’ATP ;
Structure :
Elle est constituée de :
La membrane externe :
Perméable aux ions et aux petites molécules,
Des canaux transmembranaires (porines) facilitent le passage de molécules de PM <10 kDa.
La membrane interne
Elle se replie pour former de nombreuses crêtes, ce qui a pour conséquence d’augmenter sa surface totale ;
Elle est imperméable, sauf pour les molécules qui disposent d’un transporteur spécifique ;
Elle comporte les composants de la chaine respiratoire et le complexe enzymatique responsable de la synthèse d’ATP.
Les deux membranes sont séparées par un espace appelé espace inter membranaire. La Matrice mitochondriale :
Contient l’ADN, les ribosomes, l’ATP, l’ADP, les enzymes de la B- oxydation, du cycle de Krebs
et les enzymes de l’oxydation des acides aminés.
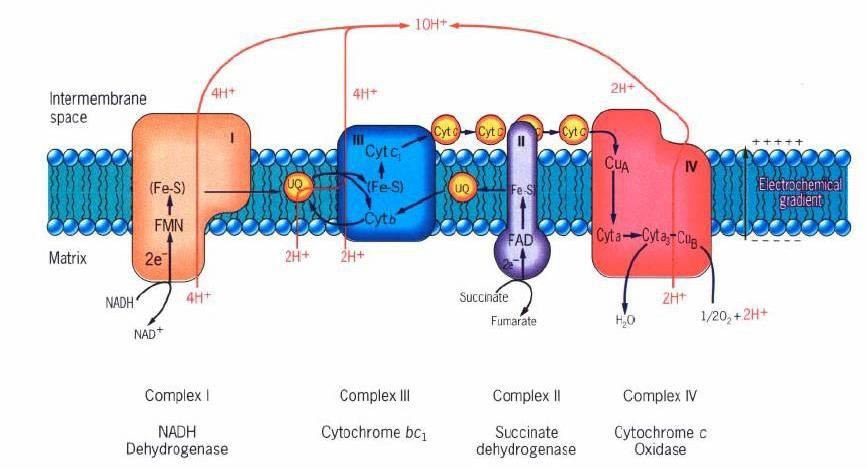
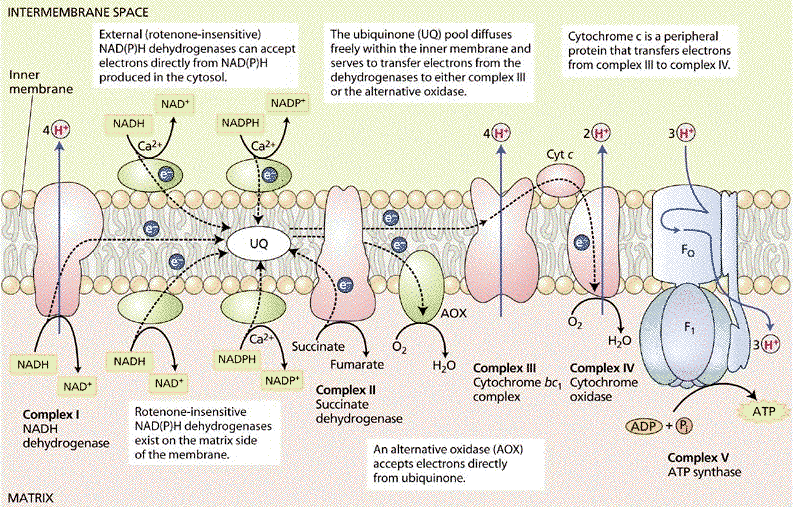
La chaine respiratoire :
Constituants :
La chaîne respiratoire correspond à une association de complexes protéiques présents au sein de la membrane interne de la mitochondrie.
Ils sont responsables, avec l’ATP synthétase, de la phosphorylation oxydative.
Il s’agit d’un transport d’électrons de haute énergie chimique, provenant du cycle de l’acide citrique (NADH, et FADH2), à travers les complexes de la chaine respiratoire jusqu’à l’oxygène.
Tout au long de la chaîne respiratoire les électrons provenant du NADH et du FADH2, vont perdre de l’énergie qui sera utilisée pour former le gradient électrochimique de proton entre l’espace inter-membranaire et la matrice mitochondriale.
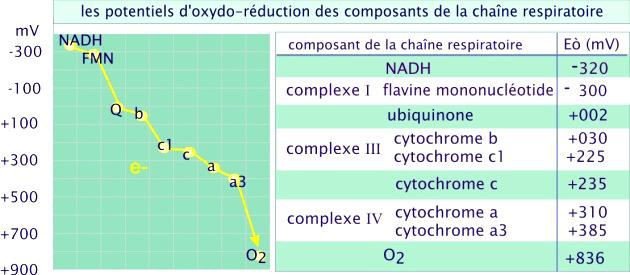
Les électrons seront transportés successivement via les différents complexes :
Le complexe I :
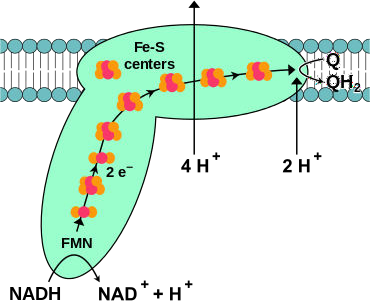
Il a une action NADH coenzyme Q réductase ;
Il comprend un coenzyme : FMN et plusieurs protéines
Fer-soufre ;
Il récupère les électrons du NADH et permet le transport de 4 protons de la matrice mitochondriale vers l’espace inter-membranaire.
Le complexe II :
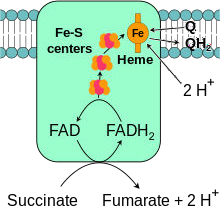
Il a une action Succinate coenzyme Q réductase,
Il comprend succinate déshydrogénase à coenzyme FAD (6eme réaction du cycle de Krebs) et plusieurs protéines fer-soufre
Il récupère les électrons du FADH2 et ne permet le transport d’aucun proton.
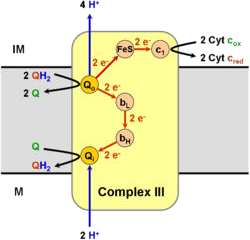
Le complexe III :
Il a une action Coenzyme Q cytochrome C réductase ;
Il comprend deux cytochromes b, et une protéine fer soufre et le cytochrome c ;
Il permet le transport de 4 protons de la matrice mitochondriale vers l’espace inter-membranaire.
Le complexe IV :
Il a une action Cytochrome C oxydase ;
Il comprend les cytochromes a et a3 et 2 ions cuivres ;
Il permet le transport de 2 protons de la matrice mitochondriale à l’espace inter-membranaire.

En plus de ces 4 complexes, qui sont des protéines intégrales insérées dans la membrane interne il existe deux transporteurs d’électrons qui sont dits mobiles :
37
Le coenzyme Q (ou ubiquinone) :
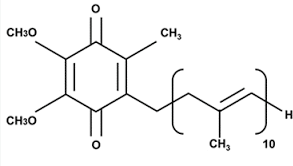
Molécule liposoluble, qui diffuse librement dans la bicouche lipidique.
Il permet la transition entre le complexe I ou II et le complexe III.
Le cytochrome C :
Petite hémoprotéine liposoluble ;
Permet la transition entre le complexe III et le complexe IV.

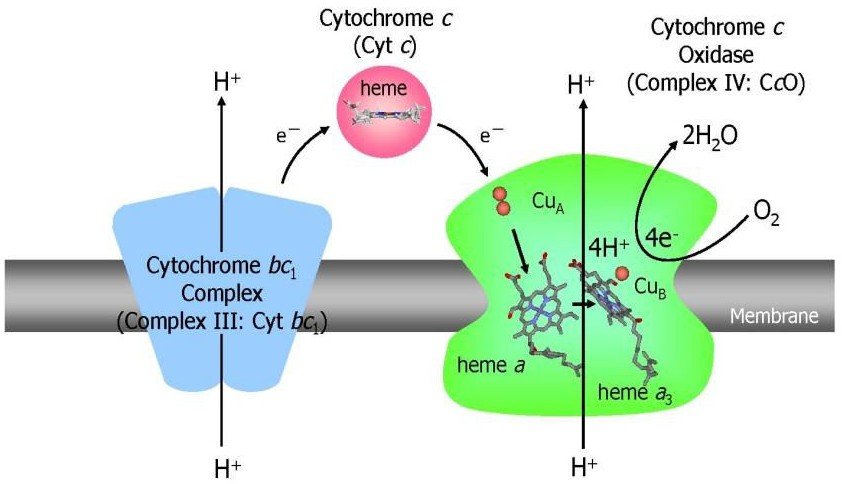
Enchainement des transporteurs mitochondriaux d’électrons :
L’ordre des transporteurs de la chaine respiratoire a pu être déterminé grâce à la détermination de leurs potentiels standards d’oxydoréduction.
Les transporteurs fonctionnent dans un ordre de potentiel de réduction croissant car les électrons ont tendance à passer spontanément d’un transporteur de bas potentiel E’0 vers un autre transporteur dont le potentiel E’0 est plus élevé.
Fonctionnement de la chaine :
Complexe I : NADH coenzyme Q oxydoréductase
Il catalyse le transfert de 2 électrons du NADH (d’origine mitochondriale (β.
Oxydation, CK)
et cytosolique (glycolyse)) au coenzyme Q via la FMN et un ensemble de centres Fe – S ;
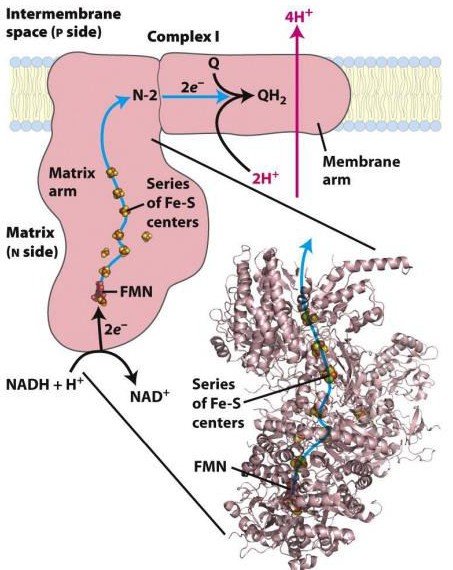
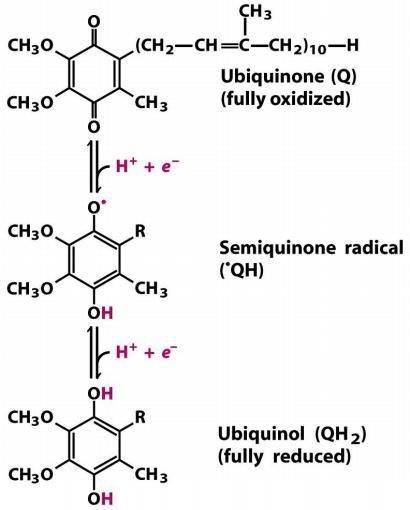
NADH, H+ + Coenzyme Q NAD + + Coenzyme QH2
Cette réaction d’oxydoréduction est exergonique, ce qui permet d’expulser 4 protons (4H+)
de la matrice vers l’espace intermembranaire.
Complexe II : Succincte coenzyme Q oxydoréductase
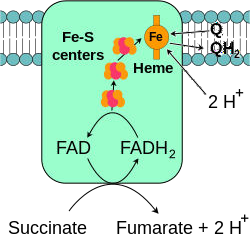
Ce complexe reçoit 2 électrons du FADH2 produit par le cycle de Krebs et les passe au coenzyme Q via les protéines Fer-soufre.
– Ne permet le transport d’aucun proton.
FADH2 + Q FAD+ + UQH2
Complexe III : Coenzyme Q – cytochrome C oxydoréductase
Il comprend : 2 cytochromes b, une protéine Fer- soufre et le cytochrome c.
Il reçoit les équivalents réducteurs du coenzyme QH2 et les passe au cytochrome c via les cytochromes b et la protéine Fer-soufre.
Il permet également d’expulser 4 protons (4H+) de la matrice vers l’espace intermembranaire.
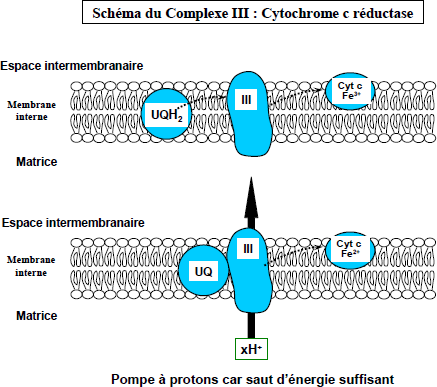
Complexe IV: Cytochrome c oxydase
Comprend : les cytochromes a et a3 et 2 ions cuivre.

Il reçoit les équivalents réducteurs du cytochrome c et les passe à l’oxygène moléculaire via les cytochromes a et a3.
2 cyt c (Fe++) + ½ O2 + 2H+ 2 cyt c (Fe+++) + H2O
Ce flux d’électrons du cyt c à l’O2 entraine un mouvement de 2 protons de la matrice vers l’espace intermembranaire.
AH2 NAD+ FpH2 2Fe3+ H2O
Flavoprotéines cytochromes
A NADH, H+ Fp 2Fe2 ½ O2
Transport des équivalents réducteurs à travers la chaine respiratoire
Mécanisme de la phosphorylation oxydative :
La phosphorylation oxydative (ou oxydations phosphorylantes) désigne le processus par lequel l’ATP est formé lorsque des électrons sont transférés du NADH ou du FADH2 au dioxygène par une série de transporteurs d’électrons.
ATP synthase :
Parfois appelée complexe V ;
C’est le complexe enzymatique qui clos la phosphorylation oxydative.
Il est impliqué dans la synthèse de l’ATP ;
Il est localisé au niveau de la membrane interne mitochondriale ;
Il a une forme de sphère pédonculée ;
Il comprend deux sous unités F1 et F0.
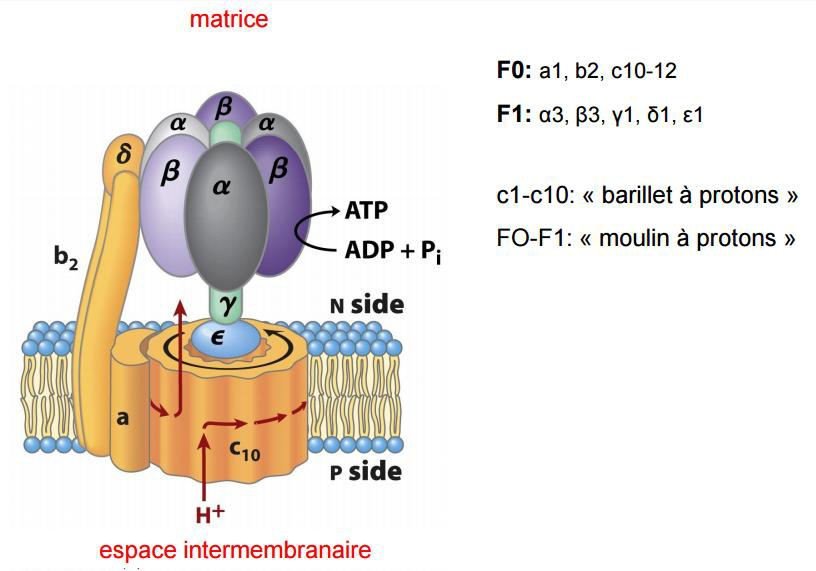
La sous –unité F1 :
Constituée de plusieurs types de sous –unités qui forment les protubérances de la membrane interne de la mitochondrie
Elle est située sur la face matricielle ;
Constitué de 5 types de chaines polypeptidiques α , β, ɣ, δ et ɛ ;
Les sous-unités β possèdent l’activité catalytique permettant la synthèse de l’ATP.
La sous –unité F0 :
Elle est transmembranaire ;
Constituée de trois types de sous-unités hydrophobes a, b, c ;
Contient le canal protonique qui permet le passage des protons à travers la membrane.
Théories expliquant la phosphorylation oxydative :
Plusieurs hypothèses ont été formulées pour expliquer la manière dont l’ATP synthase pouvait phosphoryler l’ADP en ATP :
Hypothèse du couplage chimique :
Cette théorie suppose la présence d’un intermédiaire dont l’hydrolyse ultérieure fournie l’énergie nécessaire pour la phosphorylation.
Hypothèse du coupelage conformationnel :
Cette théorie suppose un changement de la conformation de certaines protéines de la membrane interne de la mitochondrie.
Hypothèse chimio-osmotique :
Le potentiel électrochimique créé par le gradient de protons à travers la membrane interne mitochondriale est couplé à la synthèse de l’ATP.
C’est cette dernière qui a été admise par l’ensemble de la communauté scientifique (Mitchell a obtenu le Prix Nobel en 1978).
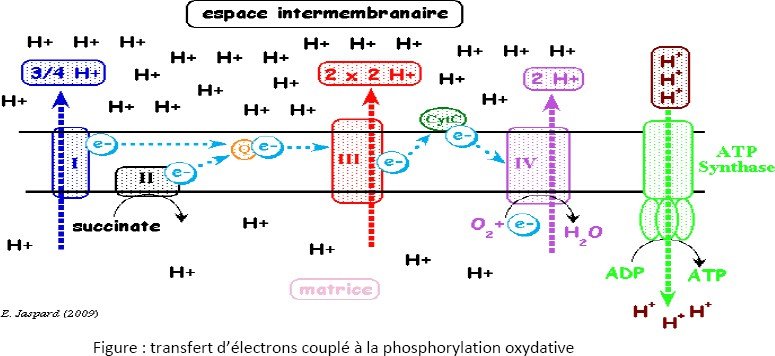
Théorie chimio-osmotique :
Cette théorie postule que le transfert des électrons le long de la chaine respiratoire est accompagné d’un pompage de protons à travers la membrane interne des mitochondries qui aboutit à un gradient de protons (de pH) : la matrice devient basique par rapport à l’espace intermembranaire.
Il se crée alors une force proton motrice qui est utilisée pour la synthèse de l’ATP : En effet, il y’a dissipation du gradient de protons par la sous unité F0 (les protons retournent de l’espace transmembranaire à la matrice mitochondriale par ce canal) couplée à la phosphorylation de l’ADP et Pi en ATP par la sous unité F1.
43
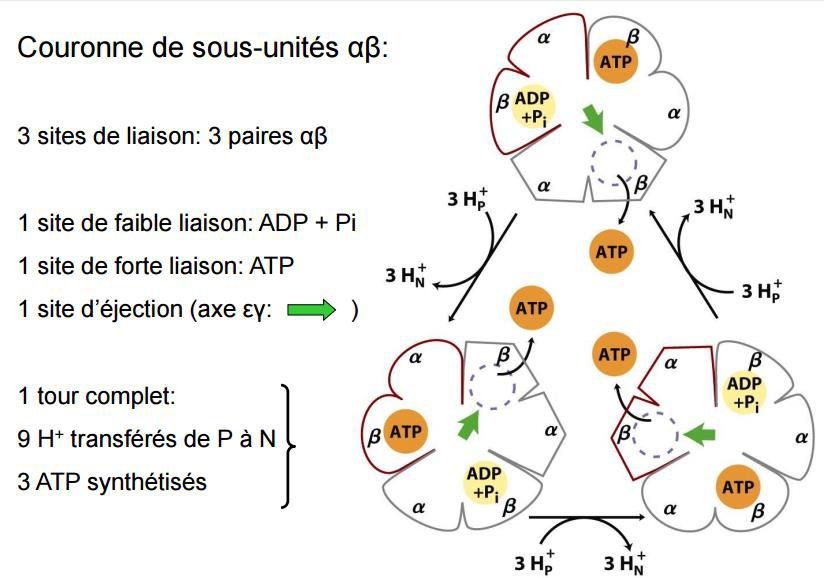
La synthèse de l’ATP repose sur une conversion énergétique, via des changements de conformation des sous-unités.
Les protons traversent la bicouche lipidique au niveau des rotors F0 (seuls points de passage) ;
Ce flux provoque la rotation de F0 (due à la neutralisation par les protons des charges négatives portées par la protéine), ce qui entraîne des changements de conformation des sous unités de F1 ;
Il y a donc conversion de l’énergie osmotique de gradient électrochimique en énergie mécanique de transconformation ;
Les sous-unités β peuvent prendre trois conformations qui se succèdent :
lâche (L) : grande affinité pour l’ADP et le Pi, ce qui provoque leur fixation ;
serrée (S) : le site actif se resserre sur les substrats et les condense en ATP pour lequel il a une très grande affinité : l’énergie mécanique de contraction du site actif provoque la formation d’une liaison ester phosphorique entre l’ADP et le Pi ;
ouvert (O) : détente du site actif, donc une moindre compatibilité tridimensionnelle avec la molécule d’ATP, permet la libération de celle-ci.
Fonctionnement de l’ATP SYNTHASE
44

Le pompage de 3 protons est nécessaire à la synthèse d’une molécule d’ATP.
Le bilan énergétique :
45
Rendement énergétique de la chaine respiratoire/phosphorylation oxydative
Pour le NADH : 10 protons sont pompés (complexe I, III et IV)
3 molécules d’ATP sont synthétisées.
Pour le FADH2 : 6 protons sont pompés (complexe III et IV)
2 molécules d’ATP sont synthétisées.
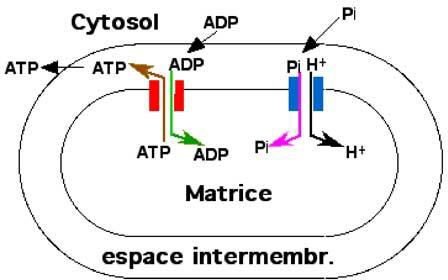
NB : l’ATP formé est transporté hors de la mitochondrie par l’ADP-ATP translocase pour couvrir les besoins de la cellule.
Différence du rendement entre les molécules matricielles et cytosoliques (notion de navettes) :
Le NADH, H+ mitochondriale (formé dans les réactions d’oxydation du pyruvate, des acides gras et du cycle de Krebs) est directement réoxydé par la chaîne respiratoire avec un rendement de 3 ATP ;
Le NADH, H+ cytosolique (formé essentiellement lors de la glycolyse) ne peut pas traverser la membrane mitochondriale, il nécessite un système de navettes.
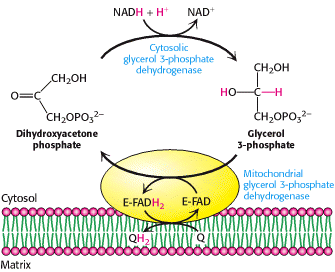
Navette glycérol 3 phosphate :
Retrouvée au niveau du muscle squelettique et du cerveau.
Elle met en jeu 2 enzymes : une glycérol 3-phosphate déshydrogénase (G3PDH) cytosolique et un complexe G3PDH membranaire (mitochondriale) à FAD.
Le NADH, H+ donne ses équivalents réducteurs directement au complexe II :
1 NADH, H+ 2 d’ATP
Navette malate-aspartate :
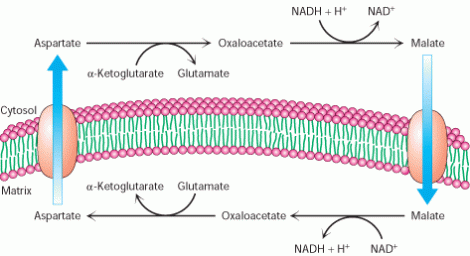
Retrouvée au niveau du foie, cœur et
rein ;
Elle met en jeu 2 enzymes : la malate déshydrogénase et l’aspartate transaminase.
Ces deux enzymes sont présentes à la fois dans le cytosol et dans la mitochondrie.
1 NADH H+ 3ATP
Les inhibiteurs et agents de découplage de la chaine respiratoire et la phosphorylation oxydative :
Plusieurs médicaments et toxines bien connus sont des inhibiteurs de la chaîne respiratoire :
| Mode d’interférence | composé | Mode d’action/cible | ||
| Inhibiteur du transfert d’électrons | Cyanure CN–Cobalt CoAntimycineA | Inhibent la cytochrome oxydase (a, a3).Bloque le transfert des | ||
| électrons du Cyt b vers | ||||
| le Cyt c1 | ||||
| Roténone | – Du centre Fe-S vers l’Q | |||
| Inhibition synthase | de | l’ATP | OligomycineVenturocidineCarbodiimide | Inhibent F1Bloque le flux via F0 |
| Agents découplants | Dinitrophénol | – Transport de protons au travers de la MI desmitochondries | ||
Conclusion : en résumé :

ANNEXE
Quelques constantes physiques et unités fréquemment utilisées en thermodynamique
Nombre d’Avogadro : N = 6.0022 1023 mole-1.
Constante de Faraday : F = 96500 J/ V. mole (Coulombs).
Constante des gaz parfaits: R = 8.315 J/ mole. °K.
R = 1.987 cal/ mole. °K.
L’unité de ∆G et ∆H est J/mole ou cal/mole.
L’unité de ∆S est J/mole.°K ou cal/mole.°K,
– 1cal = 4.184 J
L’unité de la température absolue T est le degré Kelvin (°K) avec 25°C= 298°K.
A 25°C, RT = 2.479 KJ/mole = 0.592 Kcal/mole
Ln x (logarithme népérien)= 2.3 log x (logarithme décimale).

