LA CHROMATOGRAPHIE D’EXCLUSION STERIQUE
INTRODUCTION
La séparation chromatographique des molécules de tailles différentes, en se fondant sur leur possibilité de pénétrer ou pas à l’intérieur des phases stationnaires, était connue depuis longtemps.
Il a cependant fallu attendre 1959 que Porath et Rodin proposent l’utilisation d’un gel de dextrane artificiellement réticulé pour que cette chromatographie par tamisage prenne son extension.
Réservée au début à la séparation des protéines et polypeptides, elle est devenue une méthode d’analyse permettant d’effectuer non seulement la séparation mais également la purification et l’analyse de mélanges complexes
Elle repose sur le comportement de molécules vis-à-vis des grains poreux d’une phase stationnaire constituée par un gel : les molécules diffusent à l’intérieur des grains du gel ou en sont exclues.
Ce terme général regroupe :
— Filtration sur gel (phase mobile aqueuse) — Perméation de gel (phase mobile organique)
I.PRINCIPE
Le matériau servant de base à cette séparation est un gel →milieu d’aspect homogène formé par deux phases :
— une phase dispersée: le substrat du gel
— une phase dispersante: le solvant
Le solvant pénètre à l’intérieur de chaque particule et provoque leur gonflement.
Si dans ce solvant des substances sont dissoutes, celles dont les molécules sont de tailles inférieures aux diamètres des mailles du réseau diffusent à l’intérieur des grains de ce gel, alors que les molécules plus volumineuses restent à l’extérieur (séparer chromatographiquement les molécules en fonction de leur taille).
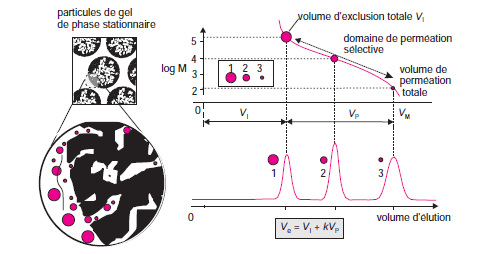
II.ETUDE THEORIQUE
1-Coefficient de diffusion
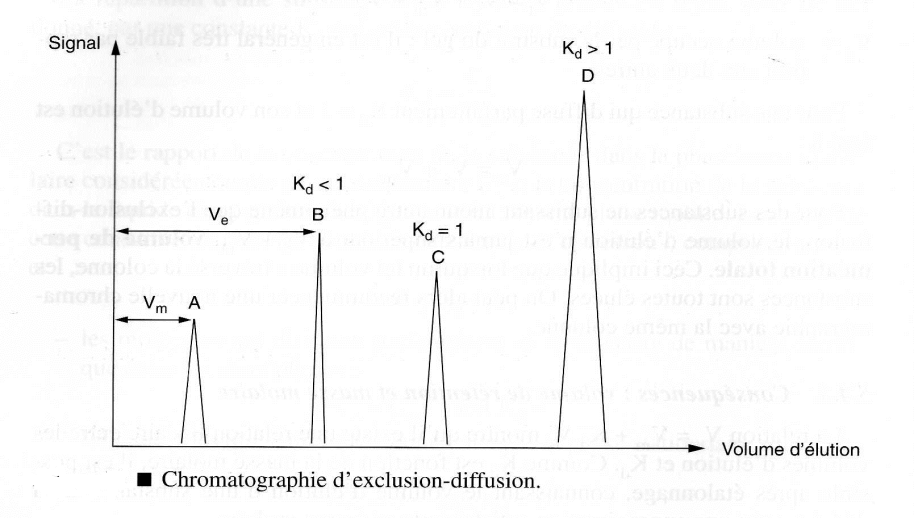
C’est le rapport de la concentration de la substance dans la phase intra-granulaire considérée comme phase stationnaire Cs et la concentration de la substance dans le liquide extra-granulaire Cm. considéré comme phase mobile
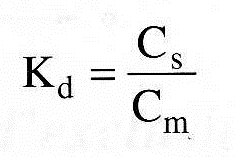
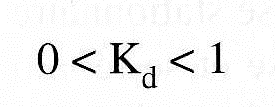
– Kd = 1 → Cs = Cm → les molécules diffusent parfaitement et se répartissent de manière identique entre les deux phases
– Kd = 0 → Cs = 0 → les molécules sont totalement exclues de la phase stationnaire
– Entre ces deux valeurs théoriques extrêmes → molécules ne sont pas totalement exclues et ne peuvent diffuser totalement dans la totalité du réseau de pores.
Remarque : Il peut se faire que Kd soit supérieur à 1.
Ceci signifie que les phénomènes d’adsorption ou d’échange d’ions se superposent au phénomène d’exclusion/diffusion.
2- Volume de rétention ou volume d’élution
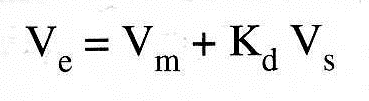
Vm = volume de phase mobile libre entre les grains ou volume interstitiel.
Vs = volume de phase stationnaire c’est-à-dire volume de liquide se trouvant à l’intérieur des grains.
Il dépend surtout de leur porosité.
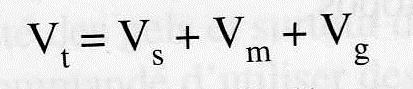
Vg = volume occupé par le substrat du gel ; il est en général très faible par rapport aux deux autres.
une substance qui diffuse parfaitement Kd = 1 et son volume d’élution est égal à:
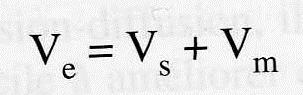
des substances ne subissant aucun autre phénomène que l’exclusion-diffusion :
volume de perméation totale.
lorsqu’un tel volume a traversé la colonne, les substances sont toutes éluées →On peut recommencer une nouvelle chromatographie avec la même colonne.

FACTEURS INFLUENÇANT LA SÉPARATION
1.Le facteur de sélectivité α :
dépend de la porosité des gels et surtout de leur uniformité → gels dont les diamètres sont proches de ceux des molécules à séparer et dont la porosité est uniforme.
2.
Le facteur de rétention k’B
0,5 <k’B < 2 Kd est au plus égal à 1 → Ne peut pas varier entre des limites très différentes → difficile à améliorer
3.
Le nombre de plateaux théoriques
– allongeant la longueur de la colonne →Recyclage
-modifiant le débit de la phase mobile → Influence sur H (Plus la vitesse linéaire est faible, meilleure est la séparation des solutés puisque ceux-ci ont ainsi le temps de diffuser dans le volume disponible).
III.ETUDE PRATIQUE
Phases stationnaires
1- Le diamètre des pores:
Fixé par le degré de réticulation du gel qui correspond à la proportion du substrat dans la PS
La taille des pores définit le volume de PS et domaine d’application
2- Capacité de gonflement:
la quantité de solvant capable d’être adsorbée par gramme de gel sec.
Sephadex G 10: absorbe 1 ml d’eau g/ gel sec (très réticulé et a des mailles très étroites)
Sephadex G 200 : absorbe 20 ml / g gel sec (mailles sont très lâches)
3- La taille et la forme des particules:
petites, sphériques dont la granulométrie est variable selon la nature des gels et les buts recherchés
chromato classique ( 40- 300 um) chromato HP (20-80 um )
4-Inertie:
– Ne doivent pas réagir avec les solvants (solutions aqueuses ou salines, légèrement basiques ou acides 2<pH<8 )
– Gels plus résistants capables de gonfler en milieu organique (aujourdh’ui)
5-Affinité des gels pour les substances dissoutes:
Doit être extrêmement réduite → Eviter les phénomènes : adsorption, échange d’ions
6- Consistance :
Varie selon leur nature et leur degré de réticulation.
– Xérogels ( gels mous, gels semi-rigides ) – Aérogels (gels rigides)
gels mous : (polystyrène)
Capacité de gonflement et les porosités sont les plus grandes
Utilisés avec des solutions aqueuses (sauf les polystyrènes qui sont hydrophobes).
Ne sont utilisables que sous de très faibles pressions (< 2 bars) et à faible débit
Se déforment en colonne sous leur propre poids et sous l’effet des vitesses élevées ( ne permettent pas toujours d’obtenir des chromatographies reproductibles)
K ‘ peuvent aller jusqu’à 3
gels semi-rigides (dextran, polyacrylamide)
Sont les plus couramment utilisés
Taux de pontage plus élevé (propriétés différentes des gels mous.)
Gonflement est plus faible (facteur de capacité allant de 0,8 à 1,2.)
Peuvent être utilisés avec des débits importants car ils supportent des pressions élevées
Nature aromatique hydrophobe ( la phase mobile est souvent un solvant organique : perméation sur gel).
aérogels
– Matériaux rigides (ne gonflent pas au contact de la phase dispersante → débits élevés ou sous forte pression.)
– Verres poreux et des silices poreuses éventuellement désactivées par silanisation des groupements OH pour supprimer les phénomènes d’adsorption.
– Surtout utilisés en HPLC . – Leur domaine d’utilisation va de 3.104 à 2.107 daltons.
– Permettent d’obtenir de meilleures résolutions que les gels précédemment cités.
-Il est possible d’utiliser des gels mixtes acrylamide – agarose ou acrylamide-dextran.
Choix de la phase stationnaire
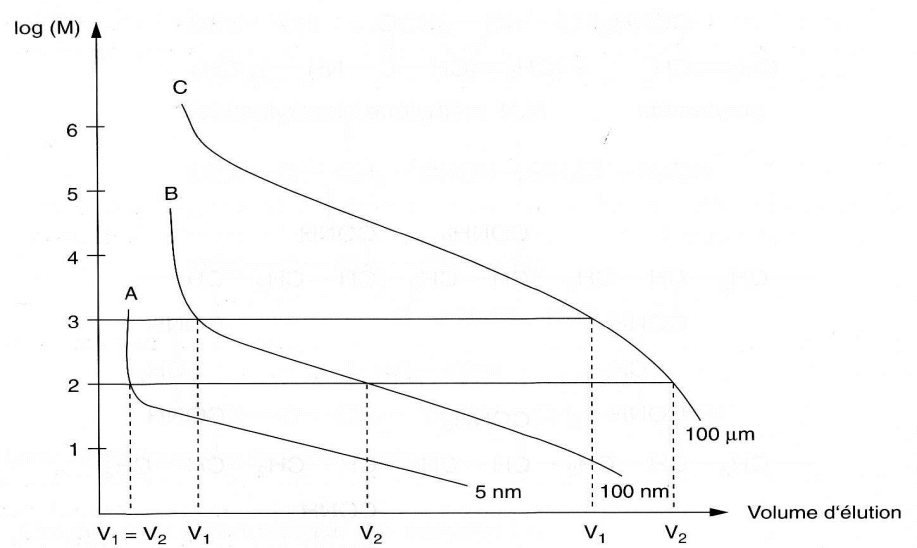
-Avec la phase A : la différence entre les volumes d’élution V1 et V2 de chacune des substances est faible.
– Avec la phase C : les deux substances sont éluées avec une très faible différence de volume.
-Avec la phase B : une différence maximale entre les volumes d’élution.
On choisit donc la phase dont la partie linéaire de la courbe correspond au domaine des masses moléculaires des constituants à séparer (le meilleur résultat).
Choix de la phase mobile:
dissoudre l’échantillon – imprégner el gonfler le gel – être compatible avec le système de détection
Ne pas détériorer les PS: Styragel (solvant polaires)
IV.INSTRUMENTATION
Matériel comparable à celui de HPLC
Les colonnes ont des volumes plus importants.
mettre en série deux ou trois colonnes aux porosités complémentaires (améliorer la résolution)
Le détecteur le plus employé est le réfractomètre différentiel (universel).
D’autres détecteurs : détecteur UV, diffusion de la lumière laser et la viscosimétrie (mesure de ∆P).
V.APPLICATIONS
Séparation de petites et macromolécules:
Élimination des ions d’une solution de macromolécules comme par exemple le facteur VIII antihémophilique
Analyse d’un mélange de macromolécules :
Purification de fractions plasmatiques (immunoglobulines M) pour la préparation de médicaments
Fractionnement de petites molécules :
Analyse de peptides (en analyse alimentaire dans les fromages)
Séparation de cellules:
Les lymphocytes peuvent être isolés des monocytes par chromatographie sur gel de dextran.
Détermination des masses moléculaires
a) L’étalonnage direct des colonnes avec des étalons de masses molaires connues tels que:
cytochrome C 12 600 – myoglobine 17 500 – albumine 68 000
Le Ve est une fonction directe de la taille d’une molécule et indirectement de la masse molaire.
Etalonner avec: – molécules de même nature – Le même solvant.
B) Etalonner à partir du volume hydrodynamique:
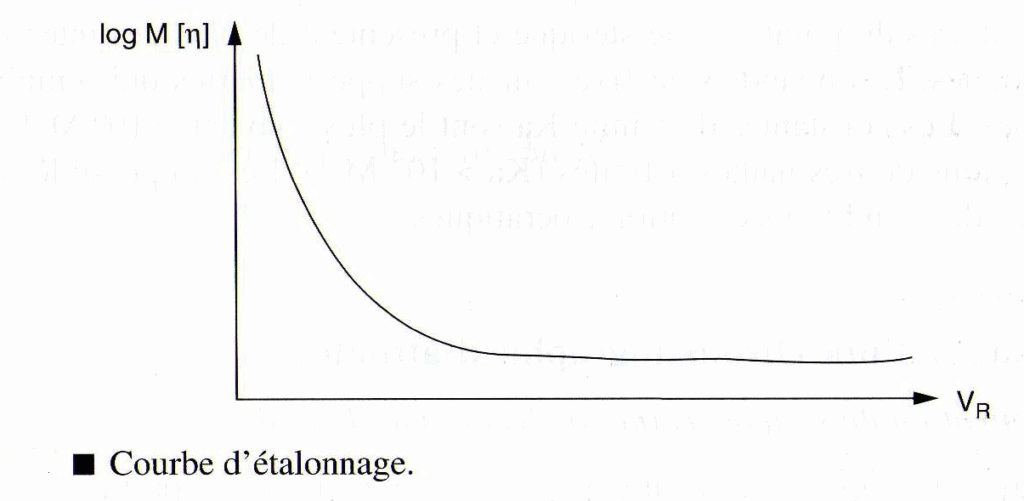
Cette méthode d’étalonnage universelle est fondée sur le fait que les molécules se séparent en fonction de leur volume hydrodynamique qui est le produit de la masse molaire par la viscosité intrinsèque.
CONCLUSION
La chromatographie d’exclusion stérique (CES) permet de séparer les molécules suivant leur taille en utilisant des phases stationnaires comportant des pores dans lesquels les composés vont pouvoir diffuser, plus ou moins suivant leur volume.
La vitesse de migration dépend, pour une même famille de molécules, de sa masse moléculaire.
Bien que l’efficacité des séparations n’atteigne pas celle de HPLC, la CES est devenue irremplaçable aussi bien dans le domaine de la séparation des macromolécules naturelles que dans l’étude de la répartition en masses des polymères de synthèse

