GROUPE 16
Le groupe 16 est le 4e groupe du bloc P ;c’est le groupe de l’oxygène .
Ce groupe forme la famille des chalcogenes (éléments qui forment des minerais )car de nombreux minerais métalliques sont des oxydes ou des sulfures . le Sélénium et le tellure accompagne en général le cuivre dans ses minerais soufrés .
Le groupe VI est constitué de l’oxygène (8O) le soufre (16 S) le sélénium( 34Se) le tellure (52Te) le polonium (84Po)
| ELEMENT | SYMBOLECHIMIQUE | N ATOMIQUE | CONFIGURATIONELECTRONIQUE | ETAT DOXYDATION |
| oxygène soufre sélénium tellurepolonium | O SSe TePo | 816345284 | 2s2 2p4 3s2 3p43d104s2 4p4 4d105s2 5p44f14 5d106s2 6p4 | 22-4-62-4-62-4-62-4-6 |
ETAT NATUREL
Oxygène :c’est le plus abondant des éléments ; L’ O2 est le 2eme constituant de l’atmosphère terrestre
après le diazote ; l’ ozone O3 est présent en quantité variable faible Il existe aussi sous forme liée dans les eaux de mers et des océans
Au niveau des roches sous forme d’oxydes ,carbonates , sulfates et silicates
Soufre c’est un élément très abondant aussi bien à l’état natif que combiné
A l’état natif c’est un solide de coloration jaune citron appelé “fleur du soufre” ; on le trouve
généralement dans les régions volcaniques ( états unis , Sicile , japon )
A l’état combiné sous forme de
Sulfures métalliques ( FeS:pyrite ; PbS : galène ;ZnS : blende )
Sulfates : CaSO4,2H2O : gypse
H2S:dans les gaz naturels, industrie pétrolières .
Sélénium à l’état natif il est rare , c’est un solide rouge vif quand la T augmente il devient gris noir
Il accompagne le soufre dans les sulfures naturels : pour des raisons d’analogie de taille ; quelques ions sulfures sont remplacés par des ions séléniures .
Les minerais de sélénium sont très rares : citons la berzélianites Cu2Se.
Tellure solide blanc a caractère métallique ou parfois sous forme d’une poudre brune , a l’état natif il accompagne le soufre et le sélénium, l’un de ses minerais les plus importants est la nagyagite ( mélange de sulfures et de tellurures iso structuraux de Pb, Au, Cu, Ag et Sb .
Polonium il est radioactif, découvert par P.et M Curie 1898.
PREPARATIONS
Oxygène
Distillation fractionnée de l’air liquide
Electrolyse de l’eau en utilisant des électrodes en fer
Au labo par décomposition thermique des composes très oxygénés (KCLO4, KMnO4 ou les nitrates )
KCLO4 (T,MnO2) → 1/2 O2 + KClO3 2KClO3 →3 O2 + 2KCl
2KMnO4 → 2 MnO2 + K2O + 5/2 O2
Chauffage de l’eau oxygénée : H2O2 →H2O + 1/2 O2
Décomposition thermique des composes métalliques :
2HgO→2Hg +O2
Hydrolyse du peroxyde de Na
2Na2O2 + 2H2O→O2 + 4 NaOH
Soufre : 2 procédés sont utilisés procédé de Frash et le procédé de Claus :
Procédé de Frash : Il permet l’extraction a partir des dépôts naturels : le soufre est fondu par injection d’une vapeur d’eau surchauffée .
Poussé par la vapeur et de l’air comprimé, le soufre liquide est remonté en surface par des tubes . il est ensuite déversé dans de vastes bassines en terre ou il se solidifie
Procédé de Claus : Récupération a partir de H2S contenu dans certains gaz naturels.
Il s’agit d’une oxydo-réduction entre H2S et dioxyde de soufre :
Oxydation partielle au tiers de H2S , à 100°C selon H2S +3/2 O2 → H2O + SO2.
Cette réaction s’accompagne partiellement de la formation du S°.
Oxydation catalytique vers 300°C , en présence d’alumine Al2O3 ou de rutile TiO2du reste (2/3) de H2S par SO2 : SO2 + 2H2S → 2H2O +3 S°.
Ce procédé est utilisé pour l’épuration de certains gaz naturels riches en H2S .
Sélénium et tellure : sont prépare a partir des minerais sulfurés qui sont oxydés a l’état d’acide sélénieux ( H2SeO2) et tellureux ( H2TeO2 ); qui sont ensuite réduits par l’anhydride sulfureux (SO2) Le sélénium et le tellure précipitent
PROPRIETES PHYSIQUES GENERALES
Structure électronique et état d’oxydation
Les éléments du groupe VI ont une structure électronique de type ns2np4 et tendent vers la structure des gaz inertes par gain ou mise en commun de 2 électrons
Le S ,Se ,Te ayant des orbitales disponibles peuvent former 4 ou 6 liaisons par partage d’ électrons ( avec l’oxygène on trouve des éléments tétravalents; avec le fluor on trouve des éléments hexavalents )
L’oxygène ne présente jamais une valence supérieure a 2 car sa couche externe est limitée a 8 e ( il présente un nombre d’oxydation de -1 dans le H2O2 ) par contre S, Se, Te et Po ayant des orbitales d disponibles peuvent former 4 ou 6 liaisons par partage d’électrons .
Par conséquent les états d’oxydation les plus retrouvés sont 2-4 et 6
| Etat fondamental : | s | p | d | ||||||||
| ↑↓ | ↑↓ | ↑ | ↑ | ||||||||
| Etat excité: | s | p | d | ||||||||
| ↑↓ | ↑ | ↑ | ↑ | ↑ | |||||||
| Etat plus excité : | s | p | d | ||||||||
| ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ||||||
L’état +4 possède des propriétés oxydantes et réductrices
L’état +6 possède des propriétés oxydantes uniquement
Les dimensions des atomes et des ions sont croissantes
Les points de fusion et d’ébullition augmentent de l’oxygène au tellure
L ’électronégativité décroit de l’oxygène qui est fortement électronégative au tellure qui l’est
peu
Caractère métallique : les 4 premiers éléments ont un caractère non métallique accentué ;
ce caractère est très prononcés pour O et le S ;
le Se et Te sont des semi métaux
le polonium qui est radioactif et a courte durée de vie est nettement métallique
Conductibilité électrique :
Le soufre et l’oxygène sont des isolants
Le Se et Te sont des semi conducteurs
Le Po est conducteur
Polymorphisme : c’est la propriété que possède certaines substances de présenter plusieurs formes cristallines différentes, Tous les éléments du groupes sont polymorphes
L’oxygène présente 2 formes non métalliques : O2 et O3( ozone)
Les soufre possède aussi 2 formes non métallique : la forme α rhombique stable à température ambiante , et la forme β monoclinique , stable au-dessus de 95.5°C
Le sélénium présente 2 formes : une rouge vif non métallique et une autres grise métallique
Dans le cas de tellure la variété métallique est plus stable que la variété non métallique .
Le polonium possède 2 formes métalliques α et β
Structures moléculaires
Oxygène est stable comme molécule diatomique ce qui explique son état gazeux
S, Se ,Te et Po sont solides a température ordinaire ( formés de molécules poly atomiques complexes)
Les atomes de soufre ont tendance a s’unir les uns aux autres pours former des chaines
ou des anneaux
les liaisons formées avec ces éléments sont généralement ioniques mais des liaisons covalentes peuvent exister dans certains composes
PROPRIETES CHIMIQUES GENERALES
Action de l’hydrogène
Tous les éléments forment des hydrures divalents volatils H2O ; H2S ; H2Se ; H2Te et H2Po
Les composés les plus importants sont pour l’oxygène ( H2O et H2O2 ) et pour le soufre H2S
L’eau a un comportement exceptionnel par rapport a ses homologue de groupe H2S , H2Se , H2Te qui forment un ensemble cohérent
Les hydrure de S ,Se ,Te s’obtiennent par action des acides sur les sel métalliques Exemple : FeS +H2SO4→ H2S + FeSO4
En parcourant le groupe par n croissant on observe pour les espèces H2M que:
Leur stabilité diminue
Leur pouvoir réducteur augmente
Leur aptitude a former une liaison de coordination par don d’une paire libre
diminue
La liaison O-H est iono-covalente alors que Te—H est covalente
Ces hydrures se dissocient a des degrés divers en donnant l’ion H+, ce sont des acides tres faibles et leurs forces augmentent de H2O au H2Te
L’O et S différent du reste du groupe par l’aptitude a former des chaines poly oxydes et polysulfures moins stables
H2O2(H-O-O-H) H2S2( H-S-S-H) H2S3( H-S-S- S-H)
H2S4( H-S-S- S- S-H)
Action des halogènes tous les halogènes réagissent avec les éléments du groupe
| Fluor | Chlore | brome | Iode | ||||
| Oxygène | O2F2 ; OF2 | Cl2O ; ClO2 ; | Br2O ; BrO2 ; | I2O2 ; I4O9 ; | |||
| Cl2O6 ; Cl2O7 | BrO3 | I2O5 | |||||
| Soufre | S2F2 SF6 g | SF4 S2F10 | S2Cl2 SCl2 | SCl4—- | S2Br2—— | ———- | ———– |
| Sélénium | Se2F2 SeF6 | SeF4—– | Se2Cl2——- | SeCl4—- | Se2Br2—– | SeBr4—– | ———— |
| Tellure | ——-TeF6g | TeF4 Te2F6 | ——TeCl2 | TeCl4—- | —-TeBr2 | TeBr4 | TeI4 |
| Polonium | ——- | —–PoCl2 | PoCl4—– | —-PoBr4 PoBr2 | — | PoI4 | |
– Fluor : fait apparaitre des valences de +6 pour S,Se,Te ;On obtient MF6 par combinaison directe
SF6 est inerte
SeF6 est légèrement plus réactif
TeF6 est réactif ; il est hydrolysé par l’eau: TeF6+6H2O→6 HF +H6TeO6
Chlore : les tétrachlorure de S,Se,Te se forment par réaction direct avec le chlore
Brome : on connait des tétrabromure de Se,Te,Po
SeBr4 est instable et s’hydrolyse facilement en Se2Br2
Iode : seul le Te et Po forment des tetraiodures
Action de l’oxygène les éléments du groupe donnent de nombreux oxydes
On connait le monoxyde de S (S2O )qui se forme quand on soumet le mélange S+SO2 à une décharge électrique
La décomposition thermique des sulfites forme : TeO et PoO : TeSO3 → TeO + SO2
Le chauffage des éléments a l’air donne les dioxydes ( SO2, SeO2, TeO2, PoO2)
Il existe des trioxydes de S et Se qui sont des anhydrides d’acides
SO3+H2O→H2SO4 acide sulfurique SeO3+H2O→H2SeO4 acide sélénique
les oxyacides de soufre sont les plus nombreux et les plus importants que ceux du Se et de Te
les oxydes les moins oxygènes et leurs sels sont des réducteurs
les oxydes les plus oxygènes et leurs sels sont des oxydants
| Elément | Oxydes | ||||
| S | S2O | (S2O3) | SO2 | SO3 | SO4 |
| Se | SeO2 | SeO3 | |||
| Te | TeO | TeO2 | TeO3 | ||
| Po | PoO | PoO2 | |||
Etude de l’eau oxygénée
Préparations :
Les plus anciennes préparations sont basées sur l’action des acides sur des peroxydes ou des superoxydes
2HCl + Na2O2→NaCl + H2O2
H2SO4+BaO2 →BaSO4 + H2O2
L’oxydation par l’air de l’ethylhydroanthraquinone: Il se forme de l’éthyle anthraquinone et de l’eau oxygénée, on retourne à l’éthyle hydro-anthraquinone par réduction par H2/Pd.
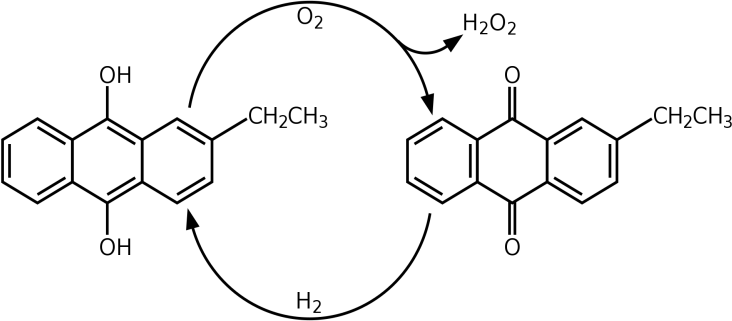
Le peroxyde d’hydrogène est ensuite extrait avec de l’eau ; dans une seconde étape, il est séparé par distillation fractionnéede l’eau.
L’anthraquinone agit comme un catalyseur, la réaction générale de l’équation est donc :
H2 + O2 → H2O2
Un autre procédé (Schell) repose sur l’oxydation de l’iso-propanol en acétone et H2O2 en phase liquide ou gazeuse à 100°C sous pression (15à20 bars).
CH3 O2 CH3 CH3
CH3 C H
CH3 C OOH
CH3 C O + H2O2 OH OH
Le mélange obtenu est fractionné par distillation.
On concentre les solutions par distillation sous pression réduite
Les solutions courantes sont a 30% ; elle sont dites a 100 volumes et a 3%sont dites a 10 volumes
Def : une solution d’H2O2 est dite a 10 volumes quand 1 litre de cette solution libère 10 litres de O2
Propriétés physiques :
Le peroxyde d’hydrogène H2O2 est à l’état pur un liquide bleu pale légèrement visqueux en
raison d’association par liaison hydrogène miscible à l’eau en toute proportions.
Température d’ébullition : -150.2°C
Température de fusion -0.43°C
Masse volumique : 1.44gcm-3 à 25°C
H2O2 est un bon solvant ionisant mais son instabilité et son fort pouvoir oxydant limitent ses possibilités dans ce domaine.
Propriétés chimiques :
Stabilité : H2O2 est un compose endothermique peu stable H2O2 →H2O +1/2O2
Cause de décompositions :
La basicité du verre ordinaire
Certains catalyseurs (Ag et Pt )
Poussières
Sels des métaux de transition (Fe,Cu,Mn)
Lumière du soleil
Pour éviter cette décomposition on utilise
Des solutions avec des stabilisants (ac sulfurique, ac urique)
Pyrophosphate de Na qui diminue la basicité et complexe les catalyseurs
Du verre brun pour diminuer la basicité et éviter l’action de la lumière
Pouvoir oxydant : H2O2 peut capter 2 e .H2O2 +2 e → 2 H2O + 1.77 volt
c’est ainsi qu’il oxyde en milieu acide
Le fer ferreux en fer ferrique
Les sels stanneux en stanniques
Le chlore , le brome et l’iode sont libérés de leurs sels en milieu acide
Pouvoir réducteur : mais seulement en présence d’un oxydant puissant
H2O2 →O2 + 2 H+ + 0.68 volt
M4O4 +8 H+ 5 e → M4 + 4 H2O
c’est ainsi qu’il réduit les sel d’or en or métallique et l’oxyde mercurique en mercure .
Formation des peroxyhydrates : l H2O2 peut se fixer sur certaines molécules comme l’eau de cristallisation , on obtient des composés qui possèdent les propriétés de l’eau oxygénée.
Exp : Métasilicate peroxy hydrate (Na2 SiO3, H2O,2H2O2).
Dérivés de L’H2O2: par substitution de 1 ou 2 H on obtient des dérivés importants ( peroxyde)caractérisés par la liaison –O—O—
Les peroxydes vrais libèrent H2O2 en milieu acide .
Il sont formés avec les éléments du groupe 1 et 2 (Li2O2, Na2O2, CaO2, BaO2 )
Les peroxyacides sont formés en remplaçant l’un des 2 hydrogènes par un reste acide
. exp HSO3.
Etude de l’acide sulfurique :
Connu depuis longtemps, c’est un composé important de la chimie.
Préparations
H2SO4 est uniquement fabriqué dans l’industrie par méthode de contact :
Le SO2 est produit par combustion du soufre fondu.
SO2 formé est traité par l’air déshydraté en présence du pentoxyde de vanadium ou du platine ; on obtient SO3
On fait réagir SO3 formé avec H2O : SO3+ H2O →H2SO4 ( le rendement de cette
réaction est faible)
Pour l’augmenter on fait réagir H2SO4 avec SO3 : SO3+ H2SO4 →H2S2O7 H2S2O7 + H2O →2 H2SO4
Propriétés physiques :
C’est un liquide, incolore, dense (1.827g/cm3), visqueux les molécules étant associées par liaison hydrogène, fumant à l’air, fondant à 10.37°C et bouillant avec décomposition vers 280°C.
L’acide sulfurique est miscible à l’eau en toute proportion (très avide d’eau) la dissolution est très exothermique et il est conseillé de toujours mélanger lentement et en ajoutant l’acide dans l’eau mais pas l’inverse.
Le liquide pur est auto ionisé en première approximation selon :
2H2SO4 → H3SO4+ + HSO4-
k=2.7*10-4 et peut être utilisé comme solvant non aqueux.
Propriétés chimiques
L’acide sulfurique possède essentiellement quatre propriétés : Diacide fort, oxydant, agent sulfonant, agent déshydratant.
Propriétés acide
En solution aqueuse H2SO4 est un acide fort.
C’est un diacide. ( la seconde acidité est plus faible
que la première).
Il se combine aux bases, aux métaux en donnant des sulfates acides.
Il déplace de leurs sels la plupart des acides.
Le plomb n’est que peu attaqué par l’acide dilué.
En solution dilué H2SO4 attaque les métaux.
Propriétés oxydantes
L’acide concentré peut jouer un rôle oxydant.
Il cède alors de l’oxygène et se réduit à l’état d’anhydride sulfureux SO2.
L’acide fumant est un oxydant encore plus énergique.
En chauffant H2SO4 avec réducteurs comme le soufre, le carbone, le cuivre.
Il se réduit en anhydride sulfureux.
Concentré et chaud l’acide sulfurique est un oxydant.
Pour le couple SO42-/SO2 (aq), E=0.17V.
Cette valeur positive permet à l’acide sulfurique de réagir sur des métaux nobles tels que Cu, Pb, Hg avec dégagement de SO2, par exemple :
2H2SO4 + Cu → SO2 + CuSO4 + 2H2O.
Bien entendu dilué et froid H2SO4 réagit sur les métaux réducteurs (E°<0) avec dégagement
d’hydrogène.
Propriétés sulfonantes (sulfonation):
L’acide fumant est utilisé en chimie organique pour fixer le groupement sulfoné SO3H à la place
d’un hydrogène.
C6H6 + H2SO4 → C6H5SO3H + H2O.
L’acide sulfurique a la propriété de sulfonation des composés aromatiques :
ArH + 2H2SO4 → ArSO3H + H3O+ + HSO4-
L’agent de sulfonation électrophile semble être SO3, acide de Lewis, présent dans les oléums et
dans l’acide concentré :
2H2SO4 → SO3 + H3O+ + HSO4-
Propriétés déshydratantes :
H2SO4 concentré très avide d’eau sert souvent à dessécher les gaz.
En fin l’acide sulfurique peut jouer un rôle d’agent déshydratant.
Il peut de ce fait carboniser les glucides (anciennement : hydrates de carbone).
D’où le danger de projections d’acide sulfurique notamment sur la peau (laver abondamment).
L’utilisation de mélanges sulfonitriques pour la nitration de composés aromatiques par NO2+ peut être rattachée à cette action déshydrante :
2H2SO4 + HNO3 → 2HSO4- + H3O+ + NO2 +
Usages :
Usages industriels : 1- L’oxygène et ses dérivés
Le dioxygène O2 :
Sidérurgie : c’est le principal secteur d’utilisation de l’O2.
O2 est utilisé pour la déphosphoration et la désulfuration des aciers par, insufflation de dioxygène dans la fonte.
La chaleur de combinaison de l’oxygène avec l’hydrogène ou avec l’acétylène est utilisée dans l’industrie de la soudure et du découpage des métaux.
Oxydation directe de l’éthylène et du propylène en leurs oxydes respectifs.
Blanchiment de la pate à papier.
Traitement des eaux, oxygénation des eaux afin de créer des zones de refuge (appelées ilots de survie) pour les poissons en cas de pollution brutale.
O2 liquide : explosifs, comburant de propulsion spatiale.
L’ozone O3 :
Par ses propriétés oxydantes c’est un décolorant (blanchiment du textile et de la pate à papier),
Désinfectant et stérilisant ayant des propriétés antiseptiques exceptionnelles: il détruit les bactéries, les virus et les champignons et est, de ce fait, utilisé pour la désinfection, par exemple dans la préparation d’eau potable ou le traitement des eaux des piscines ou encore dans la stérilisation du matériel médical.
Le peroxyde d’oxygène H2O2 :
Employé pour décolorer les fibres textiles.
Le soufre et ses dérivés :
Le soufre :
Utilisé comme fongicide pour traiter les vignes contre les champignons (contre l’oïdium de la vigne) sous forme de CuSO4,
Il entre dans la fabrication d’explosifs et d’allumettes et d’insecticides.
Il intervient dans l’industrie de H2SO4, dans la batterie automobile et dans la vulcanisation du caoutchouc.
L’anhydride sulfureux SO2 :
Utilisé dans le blanchiment des textiles : soie, laine.
Il sert à préparer l’acide sulfurique.
L’acide sulfurique H2SO4 :
Le soufre principalement sous forme d’acide sulfurique, est un produit chimique d’une importance considérable.
La quantité d’acide sulfurique consommée par une nation donnée est un indicateur du développement industriel du pays.
H2SO4 a de nombreuses débouchées actuellement dans l’industrie :
Industrie des engrais superphosphates et fabrication de l’acide phosphorique.
Fabrication des sulfures et des sulfates d’ammonium, de potassium et de cuivre….
Sulfonation des colorants, explosifs et détergents.
Utilisé dans le désherbage .
Fabrication du dioxyde de titane TiO2, principal pigment blanc utilisé dans les peintures.
Fabrication de l’acide fluorhydrique HF aq utilisé notamment pour l’élaboration de AlF3 et de la cryolithe Na3AlF6 qui entrent dans la composition du bain d’électrolyse de l’alumine pour produire l’aluminium.
Utilisé dans la synthèse de H2O2, HCl et HNO3.
Textiles artificiels : fabrication du caprolactame, intermédiaire de la synthèse du nylon 6.
Décapage des métaux, traitement des minerais et détartrage.
Séchage et purification des gaz.
Raffinage des huiles
Détartrage des aéro-réfrigérants à tirage naturel des centrales électriques thermiques classiques ou nucléaires.
Industrie des sucreries.
Le sélénium: le sélénium est très utilisé dans l’industrie :
Utilisé dans les cellules photoélectriques (transforme la lumière en électricité).
Utilisé dans l’industrie du verre :
Neutralise la teinte verte du aux impuretés ferreuses du verre sodo-calcique.
Réduit la transmission de la chaleur solaire du verre plat architectural.
CdSXSe1-X pigment rouge dans les verres et les céramiques.
Le tellure : le tellure est également très utilisé dans l’industrie :
Additif <0.1% dans les aciers à faible teneur en carbone pour améliorer les qualités d’usinages du
métal. (cela représente environs la moitié de la consommation mondiale du tellure).
Applications catalytiques.
Le polonium :
Utilisé dans les systèmes de chauffage ultralégers pour les capsules spatiales.
Usages médicaux :
L’oxygène et ses dérivés :
Le Dioxygène O2 :
Mécanisme d’action
La fraction en oxygène de l’air ambiant est de l’ordre de 21 %.
L’oxygène est un élément indispensable à l’organisme, il intervient dans le métabolisme et le catabolisme cellulaire, et permet la production d’énergie sous forme d’adénosine triphosphate (ATP).
La variation de la pression partielle en oxygène du sang retentit sur le système cardiovasculaire, le système respiratoire, le métabolisme cellulaire et le système nerveux central.
La respiration d’oxygène sous une pression partielle supérieure à 1 atmosphère (oxygénothérapie hyperbare) a pour but d’augmenter de façon importante la quantité d’oxygène dissout dans le sang artériel approvisionnant directement les cellules.
Cas d’usage
L’oxygène est utilisé dans la prise en charge de :
Algies vasculaires de la face,
Alimentation des respirateurs en anesthésie-réanimation,
Hypoxies d’étiologies diverses nécessitant une oxygénothérapie normobare ou hyperbare,
Vecteur des médicaments pour inhalation administrés par nébuliseur.
En association avec le protoxyde d’azote, l’oxygène est utilisé dans la prise en charge d’analgésies.
L’ozone :
L’ozonothérapie ou cure d’ozone est une technique de médecine non conventionnellequi prétend traiter de différentes affections et symptômes par l’insufflation dans l’organisme d’un mélange d’ozone et d’oxygène.
Cette « thérapie » autoproclamée est utilisée en dentisterie, chirurgie, rhumatologie, cardiologie, gynécologie, urologie, dermatologie, orthopédie, etc
L’ozone est le plus puissant oxydant connu et possède de ce fait :
Des propriétés antiseptiques exceptionnelles: il détruit les bactéries, les virus et les champignons et est donc utilisé en dentisterie pour l’hémostase et pour le traitement des plaies et des infections gingivales.
En usage interne, l’ozone stimule l’irrigation sanguine en améliorant l’oxygénation et la circulation sanguine jusqu’aux plus petits capillaires.
De plus, en dosages faibles à moyens, l’ozone pourrait stimuler le système immunitaire.
NB : Aucune des variantes de l’ozonothérapie n’est agréée par les grandes agences gouvernementales de régulation des pratiques thérapeutiques (FDA ou EMEA).
Soluté de peroxyde d’hydrogène ou eau oxygénée (H2O2) :
MECANISME D’ACTION
Le peroxyde d’hydrogène est un antiseptique local utilisé principalement au niveau buccal.
L’action principale est le résultat du contact du peroxyde d’hydrogène et des peroxydases et catalases présentes dans les tissus et la salive, ce qui permet une libération rapide de l’oxygène.
Il s’agit d’une action mécanique de nettoyage qui, par l’élimination des débris alimentaires, aide à soulager certaines irritations mineures de la sphère buccale.
L’eau oxygénée à 10V grâce à l’oxygène qu’elle libère, possède donc les propriétés thérapeutiques suivantes :
Lavage des plaies : l’oxygène libéré lors de la réaction de décomposition, aide les souillures à remonter à la surface de la plaie, puis ses dernières sont éliminées par l’eau formée parallèlement,
Action bactéricide : sur les germes anaérobies
Action hémostatique : grâce au pouvoir coagulant de l’oxygène.
CAS D’USAGE
Le peroxyde d’hydrogène est utilisé dans la prise en charge des :
Antisepsies des plaies,
Hémorragies capillaires,
Hygiène buccodentaire.
Le Soufre :
MECANISME D’ACTION
Le soufre est un élément minéral trace.
Le soufre ou sulfosilicoaluminate de sodium est à visée antiseptique et décongestionnante.
Par voie locale, le soufre a une action antiacnéique.
CAS D’USAGES
Le soufre est utilisé dans la prise en charge d’inflammations des voies aériennes supérieures.
Le soufre est utilisé, en oligothérapie, dans la prise en charge des :
affections cutanées,
affections rhumatismales,
affections otorhinolaryngologiques.
Par voie locale, en association au zincet au cuivre, le soufre est utilisé dans la prise en charge
d’acnés mineures.
NB : Il est à noter que le soufre existe naturellement dans les eaux thermales des stations hydrominérales, destinées au traitement des maladies des voix respiratoires.
Le Sélénium :
Mécanisme d’action
Le sélénium est un élément minéral trace (oligoélément).
Le sélénium est un élément du système enzymatique glutathion-peroxydase, qui protège les composants cellulaires de l’oxydation due aux peroxydes produits par le métabolisme cellulaire.
Il semble jouer un rôle essentiel dans les défenses immunitaires et dans le fonctionnement de la thyroïde
Par voie injectable, des patients sous nutrition parentérale totale ont montré des symptômes de déficit en sélénium incluant douleur et fatigabilité musculaire ou des cardiomyopathies semblables à celles rencontrées dans la maladie de Keshan (déficit en sélénium endémique).
Il a été observé qu’une supplémentation en sélénium faisait régresser ces symptômes.
Par voie locale, le sulfure de sélénium est actif sur pityrosporon orbiculaire, levure lipophile, agent responsable du pityriasis versicolor.
Cas d’usages
Par voie injectable, le sélénium est utilisé dans la prise en charge des :
Apports de sélénium en nutrition parentérale,
Carences en sélénium.
Par voie orale, le sélénium est utilisé, en oligothérapie, dans la prise en charge des :
Affections cutanées,
Affections musculaires.
Par voie locale, le sélénium est utilisé dans la prise en charge des :
Dermites séborrhéiques du cuir chevelu,
Pityriasis versicolor.
PRECAUTIONS A PRENDRE AVEC LE SELENIUM
Ingéré en excès, le sélénium peut se révéler toxique.
Lorsque la dose quotidienne est supérieure à 1000 µg par jour, les cheveux deviennent cassants, les ongles sont friables et présentent des stries horizontales, la peau s’infecte facilement, l’haleine devient aigre et la fatigue s’installe.
La dose maximale à ne jamais dépasser en administration continue est estimée à 400 µg par jour pour les adultes et à 280 µg par jour pour les adolescents.
Les femmes enceintes et celles qui allaitent doivent limiter leur consommation de sélénium à 70 µg par jour.
Les personnes qui souffrent de goitre doivent éviter les compléments de sélénium.
Les hommes en âge de développer un cancer de la prostate devraient éviter de prendre des compléments alimentaires contenant du sélénium.
Les aliments contenant du sélénium peuvent être consommées, avec modération dans le cadre d’une alimentation équilibrée.( Suite à une grande étude, appelée SELECT (2001-2008) qui a démarré pour évaluer les effets de compléments alimentaires contenant deux substances antioxydantes, le sélénium et la vitamine E, sur le risque de survenue de maladies chez l’homme.
Cette étude devait durer jusqu’en 2013, en 2008, l’étude fut arrêtée lorsque les chercheurs réalisèrent que les hommes recevant la vitamine E et le sélénium couraient un risque plus élevé de développer un cancer de la prostate (risque augmenté de 17%)).
Le tellure :
Toutefois les utilisations de Te sont limitées en partie parce que les composés de Te sont facilement absorbés par l’organisme et excrétés par l’expiration et la transpiration sous forme de dérivés organiques à odeur fétide.
