LES SOLUTIONS TAMPONS COURS DE CHIMIE ANALYTIQUE DEUXIEME ANNEE PHARMACIE.
LES SOLUTIONS TAMPONS
Introduction 1-Définition et rôle 2- Origine des solutions tampons 3-Calcul du pH d’une solution tampon 4-Equation d’HENDERSON HASSELBALCH 5-Propriétés des solutions tampons 6-Limites de l’effet tampon
7-Prévision de l’effet tampon grâce aux courbes de neutralisation 8-Evaluation de l’effet tampon (capacité tampon) 9-Notion de pouvoir tampon 10- Effet tampon aux pH extrêmes 11- Applications Conclusion
INTRODUCTION
Plusieurs réactions chimiques requièrent un pH constant :
Le pH du sang d’un individu en bonne santé doit être de 7,3 à 7,5.
L’hydrolyse des protéines dans l’estomac requiert un pH de 1,5 à 2,5.
Le pH de l’estomac est maintenu par une grande concentration de l’acide fort HCl.
Si le pH requis se situe entre 3 et 11, on utilise un mélange d’un acide faible et de sa base Conjuguée : c’est un système tampon.
DEFINITION ET ROLE :
Ce sont des solutions qui contiennent dans un solvant dissociant comme l’eau:
Soit un acide faible et un sel de cet acide faible (sa base conjuguée) : le pH de la solution est en zone acide
Soit une base faible et le sel de cette base faible (son acide conjuguée) : le pH de la solution est en zone alcaline
ORIGINE DES SOLUTIONS TAMPONS
Ha + H2O↔ H3O+ + a- ….… (1)
Naa ↔ Na+ + a-
Selon le principe de Le Chatelier, l’excès de a- provenant du sel fait déplacer l’équilibre (1) vers la gauche.
Ce déplacement est appelé effet d’ion commun et a pour but de maintenir le Ka constant.
[H3O+] [a–]
Ka=
[Ha]
Il en résulte donc que le pH dépend des proportions relatives en acide faible et en sel.
CALCUL DU PH D’UNE SOLUTION TAMPON
Tampon acide faible/ base conjuguée
Ha+ H2O ↔ H3O+ + a–
a– + H2O ↔ OH– + Ha
Naa ↔ Na+ + a–
On doit exprimer la [Ha] et [a–] à l’équilibre en fonction de CiHa et CiNaa. (Ci : concentration initiale)
BE: [Na+] + [H3O+] = [OH–]+ [a– ]
BM: [Ha] = CiHa – [H3O+] + [OH–]
[a–] = CiNaa + [H3O+] – [OH–]
H3O+ et OH– : relation inverse et forte recombinaison [H3O+] et [OH–]<< CHa + CNaa
BE: [Na+] = [a– ].
BM: [a– ] = CiNaa et [Ha] = CiHa .
En remplaçant ces valeurs dans l’équation de dissociation (1) de l’acide faible :

Tampon base faible/ acide conjugué:
Le système tampon comprend la base faible b (Cib) et son acide conjugué bH+ (CibH+Cl–) b + H2O ↔ OH– + bH+
bH+ + H2O ↔ H3O+ + b
Donc : BM: [ b ] = Cib et [ bH+ ]= CibH+Cl– BE : [ bH+ ] = [Cl–] .
– Si l’on remplace dans l’équation (¤) :
EQUATION D’HENDERSON HASSELBALCH

PROPRIETES DES SOLUTIONS TAMPONS
Effet de dilution :

Effet de l’addition d’acide fort : c-Effet de l’addition de base forte :


LIMITES DE L’EFFET TAMPON

PREVISION DE L’EFFET TAMPON GRACE AUX COURBES DE NEUTRALISATION
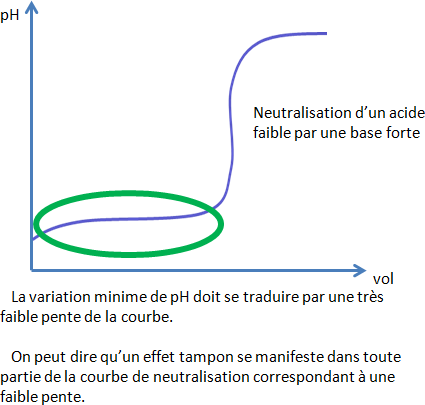
EVALUATION DE L’EFFET TAMPON (CAPACITE TAMPON)
Capacité tampon : la possibilité de céder ou de capter des protons sans que s’en suive une variation importante de pH.
Si la concentration en base est 10 fois supérieure àcelle de l’acide : pH =pKa +1
Si la concentration en base est 10 fois inférieure à celle de l’acide : pH=pKa – 1
La capacité tampon est donc exprimée par : pH= pKa ± 1 9-NOTION DE POUVOIR TAMPON
C’est le nombre de mole d’acide fort (base forte) que l’on peut ajouter à 1l de solution avant qu’elle ne subisse une variation de 1 unité de pH.
On peut également le définir comme correspondant à la variation de pH résultant de l’addition (ou la rupture) d’une quantité (ΔQ exprimée en moles) donnée d’ions H+.
EFFET TAMPON AUX PH EXTREMES
la courbe est aplatie entre PH= 0 et PH=2 : il y a donc un effet tampon.
Si l’acide est fort la base est quasi nulle.
Mais même dans le cas d’un acide idéalement fort, l’effet tampon existe car il met en œuvre le couple du solvant lui- même : H3O+/H2O.
Le PH est donnée par :
[H2O]
pH= pKa + log
[H3O+]
APPLICATIONS
Choix du couple: acide⁄base conjugués :
On choisit le couple Ha/a– ou b/bH+ selon le pH désiré….domaine de pH déterminé par la capacité du tampon.
Si on dispose de plusieurs couples dont l’intervalle de pH inclut le pH désiré : pKa le plus proche.
En industrie pharmaceutique : B- Formulation des médicaments :
A- ANALYSE DE ROUTINE/ RECHERCHE :
Analyse qualitative.
la séparation des éléments minéraux par précipitation.
Ex : Zn2+ des autres cations du groupe III (Co, Ni)
Analyse quantitative:
Electrophorèse
Extraction par les solvants.
Les dosages compléxométriques : On utilise donc le tampon phosphoammoniacal NH3/NH4Cl pour maintenir le pH constant.
Double rôle du tampon
Assure la stabilité du complexe et empêche la précipitation des alcalino-terreux qui pourraient échapper au dosage.
Le pH joue un rôle important dans la fabrication des médicaments; deux objectifs doivent être primordialement atteints:
Le médicament doit être toléré par l’organisme: compatibilité entre son pH le pH physiologique.
Le médicament doit être stable: son pH doit permettre sa conservation ainsi que le maintien de son efficacité et de son activité.
La préparation d’un tampon à usage industriel obéit aux étapes suivantes :
Effectuer le meilleur choix du couple acide/base conjugués: pKa le plus proche possible du pH désiré (stabilité et tolérance).
Avoir la capacité du système tampon la plus importante: le plus grand intervalle de PH.
En biologie.
Dans les domaines biologiques: on doit répondre aux mêmes objectifs que ceux du domaine industriel.
En effet; le dosage de certains paramètres biochimiques sensibles aux variation du pH doit se faire en milieu tamponné afin de ne pas dénaturer le paramètre et de satisfaire à la stabilité du réactif adapté.
Exemples :
1.
Tampon TRIS-EDTA pour le dosage de la G6PD.
3.
Tampon Acétate pour le dosage de la céruloplasmine.
Conclusion :
Les mélanges tampons sont largement utilisés dans la pratique de l’analyse, aussi bien qualitative que quantitative, on s’en sert lorsqu’une opération d’analyse quelconque exige de maintenir une valeur déterminée du pH de la solution.
De même leur utilisation en biologie ainsi qu’en industrie nécessite leur parfaite connaissance afin de métriser et d’élargir leur domaine d’utilisation future.
