LES ELEMENTS DU GROUPE 2 – LES METAUX ALCALINO-TERREUX –
INTRODUCTION :
| Elément | Symbole | Z |
| Béryllium | Be | 4 |
| Magnésium | Mg | 12 |
| Calcium | Ca | 20 |
| Strontium | Sr | 38 |
| Baryum | Ba | 56 |
| Radium | Ra | 88 |
Les métaux alcalino-terreux sont les éléments du 2e groupe du tableau périodique.
Leurs propriétés sont homogènes et relativement proches de celles des métaux alcalins.
Toutefois, l’augmentation du potentiel ionique de ces éléments, influe sur les propriétés de leurs composés, notamment leur solubilité et leur tendance à former des hydrates.
I -ETAT NATUREL :
| Elément | Symbole | Z | Abondance (%) |
| Béryllium | Be | 4 | 2 x 10-4 |
| Magnésium | Mg | 12 | 2.76 |
| Calcium | Ca | 20 | 4.66 |
| Strontium | Sr | 38 | 0.0384 |
| Baryum | Ba | 56 | 0.390 |
| Radium | Ra | 88 | 10-10 |
Le magnésium et le calcium sont les deux éléments les plus abondants du groupe.
Ils constituent également deux métaux essentiels majeurs.
Comparable à celle des métaux alcalins, leur réactivité ne permet pas leur existence à l’état libre.
Le béryllium existe principalement dans des minerais silicatés.
Les autres métaux existent sous diverses formes salines (dissoutes ou cristallisées), principalement des chlorures, des carbonates ou des sulfates.
Le radium est un élément radioactif (T1/2 = 1600 ans) qui accompagne l’uranium dans ses minerais.
Minerai : Minéral dont on peut extraire industriellement des substances chimiques.
| Emeraude [Be3(Al,Cr)2(SiO3)6] | Strontianite (SrCO3) |
II.
PROPRIETES :
II.1.
PROPRIETES ELECTRONIQUES :
| Configuration électronique | Ei1 (kJ/mol)(M/M+) | Ei2 (kJ/mol)(M+/M2+) | |
| Be | [He] 2s2 | 899.5 | 1757.1 |
| Mg | [Ne] 3s2 | 737.7 | 1450.7 |
| Ca | [Ar] 4s2 | 589.8 | 1145.4 |
| Sr | [Kr] 5s2 | 549.5 | 1064.2 |
| Ba | [Xe] 6s2 | 502.9 | 965.2 |
Les alcalino-terreux ont une couche de valence de type ns2.
Leurs énergies de 1re et 2e d’ionisation sont du même ordre et relativement faibles.
Ils cèdent facilement leurs 2 électrons de valences pour former des cations divalents « M2+ ».
II.2.
PROPRIETES PHYSIQUES :
A.
Aspect : dans les C.N.T.P., Be et Mg sont des métaux grisâtres.
Les autres métaux présentent un éclat argenté.
Ils sont malléables, ductiles et assez cassants.





| Métal alcalino-terreux | RayonAtomique (pm) | RayonIonique (pm) | Densité | Pointde fusion (°C) | Point d’ébullition (°C) | Emissionde flamme |
| Be | 105 | 47 | 1.85 | 1278 | 2970 | – |
| Mg | 150 | 72 | 1.738 | 651 | 1107 | – |
| Ca | 180 | 100 | 1.54 | 843 | 1487 | Rouge orangé |
| Sr | 200 | 118 | 2.64 | 769 | 1366 | Pourpre |
| Ba | 215 | 135 | 3.594 | 725 | 1637 | Vert pomme |
B.
Rayon atomique et rayon ionique : Les métaux alcalinoterreux, chacun dans sa période respective, sont les éléments les plus volumineux après les métaux alcalins.
C.
Densité, point de fusion et point d’ébullition : ils sont substantiellement plus élevés que ceux des métaux alcalins.
La liaison métallique est plus forte que celle des alcalins à cause de la participation de deux électrons de valence et du rayon plus petit des atomes.
D- ils sont conducteurs d’électricité et de chaleur.
E.
Emission de flamme : Ca, Sr et Ba émettent des couleurs au test de flamme.
I.3.
PROPRIETES CHIMIQUES :
| Electronégativitéde Pauling | Potentiel standardde réduction (V) | |
| Be | 1.57 | – 1.85 |
| Mg | 1.31 | – 2.37 |
| Ca | 1.0 | – 2.87 |
| Sr | 0.96 | – 2.89 |
| Ba | 0.89 | – 2.90 |
A.
Electronégativité : les métaux alcalino-terreux sont des éléments peu électronégatifs.
Leurs composés sont généralement ioniques.
Toutefois, certains composés de Be et de Mg présentent un caractère covalent marqué (les cations Be2+ et Mg2+ présentant des potentiels ioniques relativement élevé).
B.
Pouvoir réducteur : avec des électronégativités et des énergies de 1re et de 2e ionisation faibles, les alcalino-terreux sont des réducteurs forts.
Néanmoins, les réactions avec les substances oxydantes sont moins violentes que celles des métaux alcalins.
C.
Réactivité : les alcalino-terreux sont moins réactifs que les métaux alcalins.
Comme chez ces derniers, la réactivité augmente dans le groupe.
a. avec les non-métaux : dans des conditions de température et de pression favorables, les métaux alcalino-terreux forment des composés binaires avec la majorité des non-métaux :
| Ex. | 2M + 2C → M2C2 | 8M + S8 → 8MS |
| 3M + N2 → M3N2 | M + X2 → MX2 |
b.
Avec O2 : Ils se combinent avec l’oxygène pour former des oxydes :
| Be, Mg, Ca, Sr | Be + ½ O2 → BeO | Oxyde (O2-) |
| Ba | Ba + O2 → BaO2 | Peroxyde (O22-) |
Be, Mg, Ca et Sr forment des oxydes normaux tandis que Ba, en raison de son rayon élevé, forme un peroxyde.
Be et Mg sont passivés par l’oxygène.
Passivation : processus naturel se traduisant par la formation d’un film protecteur autour d’un métal ce qui ralentit sa corrosion.
Le film protecteur est souvent le produit de l’oxydation de la surface du métal et est constitué de l’oxyde de ce dernier.
Ex. Be + O2 → 2BeO / Be + H2O → BeO + H2 ↗
c.
Avec H2O : la réaction avec l’eau produit un hydroxyde et libère de l’hydrogène.
M+ 2H2O → M(OH)2 + H2↗
| Be | Passivation : Be + H2O → BeO + H2 ↗BeO + H2O → pas de réaction |
| Mg | Réaction avec l’eau chaude ou la vapeur d’eau |
| Ca, Sr, Ba | Réaction avec l’eau à T° ambianteRéaction de plus en plus violente |
II.4.
PROPRIETES PARTICULIERES DU BERYLLIUM : avec un potentiel ionique élevé (charge = 2+, Ri = 47 pm), Be présente des propriétés diagonales avec les éléments du groupe 13, notamment l’aluminium (Al).
Ainsi :
L’oxyde de Be est amphotère (≡ Al2O3) tandis que les oxydes des autres alcalinoterreux sont basiques.
Certains sels de béryllium (ex. halogénures) ont un caractère covalent marqué.
III.
PRÉPARATION DES MÉTAUX ALCALINO-TERREUX :
Parmi tous les alcalino-terreux, seul le Mg est utilisé en tant que métal à grande échelle, notamment pour la fabrication d’alliages.
Alliage : produit métallique obtenu en incorporant à un métal un ou plusieurs éléments ex.
Acier : Fe-C, Bronze : Cu-Zn.
Ils sont obtenus par électrolyse ou réduction de leurs sels :
Préparation du magnésium :
Elle se fait par réduction de la dolomite (minerai) par Ferro silicium :
2MgO+2CaO+FeSi →2Mg+Ca2SiO4 +Fe
Le magnésium est ensuite séparé par distillation fractionnée sous vide
On produit le Calcium par l’électrolyse d’un mélange fondu de CaCl2 et de CaF2.
Sr et Ba sont extraits par réduction des oxydes correspondants ou électrolyse chlorures fondus MCl2 .
IV.
LES CORPS COMPOSES :
IV.1. LES OXYDES (MO)
A.Préparation : pardécomposition thermique du carbonate MCO3 ou de l’hydroxyde de l’alcalino-terreux M(OH)2
Ex. MCO3 🡪 MO + CO2
M(OH)2 🡪 MO + H2O
B. Propriétés :
Solides ioniques
PF° très élevée (ex.
MgO : PF° : 2800°C)
Application : l’oxyde de magnésium MgO ou magnésie est utilisé comme matériau réfractaire (qui résiste à de très hautes températures).
BeO : oxyde amphotère
Réaction avec un acide : donne le cation Be2+ hydratée :
BeO(s) + 2H3O+(aq) + H2O(l) 🡪 [Be(OH2)4]2+(aq)
Réaction avec une base : donne l’anion beryllate :
BeO(s) + 2OH–(aq) + H2O(l) 🡪 [Be(OH)4]2-(aq)
MgO, CaO, SrO et BaO : oxydes basiques
IV.2. LES HYDROXYDES (M(OH)2)
A. Préparation : Hydratation des oxydes des alcalino-terreux MO :
Ex. CaO + H2O 🡪 Ca(OH)2
B. Propriétés : solubilité moins marquée que celle des hydroxydes alcalins :
| Be(OH)2 | Mg(OH)2 | Ca(OH)2 | Sr(OH)2 | Ba(OH)2 |
| Peu soluble | Solubilité ↗ | Très soluble | ||
Application :
Ba(OH)2 : est utilisé comme base alcaline (source d’ion OH–) en raison de sa solubilité comparable à celle des hydroxydes alcalins.
Mg(OH2) (Lait de magnésie) se présente sous forme d’une suspension blanche, utilisée à faible dose comme un antiacide (pH : 9,5 et 10,5) et permet la neutralisation de HCl stomacal :
Mg(OH2) + HCl 🡪 MgCl2 + H2O
IV. 3. LA SOLUBILITE DES SELS EN MILIEU AQUEUX :
Contrairement aux sels des métaux alcalins qui sont généralement solubles, de nombreux sels d’alcalino-terreux sont peu ou très peu solubles.
Les sels des alcalino-terreux se distinguent aussi de ceux des alcalins par leur aptitude à cristalliser avec leur eau d’hydratation pour donner des hydrates n.H2O.
Règle générale de solubilité :
| Anion | OH– | F– | IO3– | CO32- | SO42- | CrO42- | ||
| Cation | RayonIonique (pm) | 140 | 136 | 182 | 185 | 230 | 240 | |
| Mg2+ | 65 | T. PeuSoluble | T. PeuSoluble | Soluble | Peusoluble | Soluble | Soluble | |
| Ca2+ | 99 | |||||||
| Sr2+ | 113 | |||||||
| Ba2+ | 135 | Soluble | Peusoluble | T. Peusoluble | T. Peusoluble | T. Peusoluble | T. Peusoluble | |
Dans un groupe, Le sel le moins soluble est l’association de :
Le cation le plus volumineux avec un anion volumineux
Le cation le moins volumineux avec un anion peu volumineux
Le sel le plus soluble est l’association de :
Le cation le plus volumineux avec un anion peu volumineux
Le cation le moins volumineux avec un anion volumineux
Importance de la solubilité des sels :
Règle de Berthollet : « La faible solubilité d’un des produits est la force motrice qui permet de réaliser de nombreuses réactions ». Autrement dit, certaines réactions ne sont possibles que si un des sels formés est insoluble ou moins soluble que les sels engagés comme réactifs :
Réaction de double décomposition :
Ex. : CaCl2 🡪 Ca2+ + 2Cl– / 2KF 🡪 F– + 2K+
| CaCl2 + 2KF 🡪 | CaF2 | + | K+ + Cl– |
| insoluble | soluble |
Réaction de déplacement : Ex. : Synthèse de l’acide chlorique HCLO3
Ex. : Ba(ClO)3🡪 Ba2+ + 2ClO3– / H2SO4 🡪 SO42- + 2H+
| Ba(ClO)3 + H2SO4 🡪 | BaSO4 | + | 2H+ + 2ClO3– |
| insoluble | soluble |
Application :
Ba(OH)2 : est utilisé comme base alcaline (source d’ion OH–) en raison de sa solubilité comparable à celle des hydroxydes alcalins.
Mg(OH)2 (Lait de magnésie) : se présente sous forme d’une suspension blanche, utilisée à faible dose comme un antiacide (neutralise l’acidité stomacale) :
Mg(OH) 2 + HCl → MgCl2 + H2O
Il est également utilisé comme laxatif : sa faible solubilité diminue l’absorption de Mg au niveau gastrique.
Parallèlement, le volume intestinal d’eau augmente par osmose.
IV. 4. FORMATION D’HYDRATES :
Avec un potentiel d’ionisation plus élevée que ceux des métaux alcalins, les métaux alcalino-terreux présentent une plus grande aptitude à s’hydrater et par conséquent à cristalliser avec leur eau d’hydratation pour donner des hydrates n.H2O.
Ex.
MgCl2.6H2O, Mg(NO3)2.6H2O, MgSO4.7H2O, CaCl2.6H2O, BaCl2.6H2O, etc.
Application :
Certains sels anhydres peuvent absorber les molécules d’eau présentes dans l’atmosphère sans se liquéfier.
Ses composés sont dits hygroscopiques :
Ils doivent être conservés à l’abri de l’air s’ils sont utilisés sous forme anhydre.
Certains sels (ex. MgCl2, CaCl2.) sont utilisés comme un agent de séchage.
V- ETUDES DES COMPOSEES DU MAGNESIUM :
V.1. L’OXYDE DE MAGNESIUM (LA MAGNESIE ANHYDRE ) MgO :
A. Préparation :
Elle se fait par calcination de l’hydroxyde ou du carbonate
MgCO3 🡪 MgO + CO2
Mg (OH)2 🡪 MgO + H2O
B. Propriétés :
Solides ioniques (poudre blanche)
TF° très élevée PF° : 2800°C→ excellent réfractaire
V .2. L’HYDROXYDE DE MAGNESIUM Mg(OH)2:
A. Préparation au laboratoire :
L’hydroxyde est précipité par de la soude ou de la potasse
Mg2+ + 2OH–→Mg (OH)2
B. Propriétés :
L’hydroxyde fixe à froid le gaz carbonique et est souvent carbonaté.
La magnésie anhydre et l’hydroxyde de magnésium sont des bases peu solubles dans l’eau, solubles dans les acides.
V .3. LES SILICATES :
Les silicates de Mg se trouvent à l’état naturel
Formules brutes complexes
Le Talc Mg3 (Si4O10) (OH)2 :
– Blanc, onctueux, facile à pulvériser
– Insoluble dans l’eau et les acides
Application :
– Utilisé comme excipient dans certains médicaments (lubrifiant).
– Utilisé en cosmétologie, principalement pour ses propriétés absorbantes, comme poudre à talquer
– utilisé dans l’agroalimentaire comme anti-agglomérant, principalement dans les colorants
L’amiante Mg3 (Si2O5) (OH)4:
– Désigné ss le nom d’asbeste est un minéral fibreux
– Elle est calorifuge et isolante
Application avant 1997 (date de son interdiction) :
– Des matériaux de construction
– Des vêtements de protection thermique et ignifuges.
Dangers de l’amiante : elle est à l’origine de l’asbestose (maladie professionnelle), elle est hautement cancérogène : provoque des cancers des poumons, des cancers digestifs, le cancer de l’ovaire et le cancer du larynx …etc .
VI- ETUDES DES COMPOSES DU CALCIUM :
VI.1. OXYDE ET HYDROXYDE : LA CHAUX VIVE CaO ET LA CHAUX ETEINTE
Ca (OH)2
A. Obtention :
Industrielle : Décomposition thermique du calcaire (pierre à chaux) :
T˃800 °C : CaCO3s+43Kcal → CaOs+CO2 gaz
B. Propriétés :
– À T normale : la réaction inverse est favorisée
– L’extinction de la chaux : résulte de l’absorption de l’humidité de l’air ou de l’adjonction de faible quantité d’eau
CaO +H2O → Ca (OH) 2+15 Kcal
Application : l’eau de chaux (solution saturée de Ca (OH)2):
L’eau de chaux se trouble en présence de dioxyde de carbone CO2, qu’elle met en évidence.
Le précipité blanc ainsi formé est du carbonate de calcium CaCO3 selon la réaction d’identification suivante:
Ca(OH)2 + CO2 → CaCO3 + H2O
VI.2. LES SULFATES DE CALCIUM CaSO4 :
A. Préparation : Action de l’acide sulfurique (H2SO4) sur le carbonate ou l’hydroxyde de calcium
CaCO3 + H2SO4 🡪 CaSO4 + CO2 + H2O
B. Propriétés :
Cristallisent avec une ou plusieurs molécules d’eau
CaSO4 : est présent dans la nature sous forme de gypse dihydraté : CaSO4. 2H20
T : 150°C
T : ˃200°C
CaSO4. 2H2O → CaSO4. ½ H2O→CaSO4
Plâtre gypse anhydre
Application : Le plâtre est un liant : au contact de l’eau, il reprend son eau de cristallisation et durcit rapidement en donnant des cristaux de gypse
VI.3.
LES CARBONATES ET BICARBONATES :
Les carbonates ont une formule : MCO3
Les bicarbonates : M(HCO3)2
A. Préparation :
Carbonates : action du CO2 à faible taux sur l’hydroxyde :
M(OH)2 + CO2 🡪 M(CO3) + H2O
Bicarbonates : action du CO2 en excès sur l’hydroxyde :
M(OH)2 +2 CO2 🡪 M(HCO3)2
B. Propriétés :
Les carbonates des alcalino-terreux sont insolubles
Les bicarbonates sont solubles
Dureté de l’eau : ensemble de propriétés liées à la présence d’ions Ca2+ et Mg2+ dans l’eau.
Elle peut être temporaire ou permanente.
Origine :
Elle est principalement due à la présence de bicarbonates (Ca(HCO3)2, Mg(HCO3)2) provenant de la dissolution des carbonates (CaCO3 : calcaire, MgCO3) dans les eaux contenant l’acide carbonique (H2CO3 : CO2 + H2O) :
CaCO3 + CO2 + H2O 🡪 Ca(HCO3)2
Soluble : Ca2+ + HCO3–
Elle est dite temporaire : si elle peut être éliminée par chauffage :
Ca(HCO3)2 🡪 CaCO3 + CO2 + H2O
Insoluble : précipite
Elle est dite permanente : si elle ne peut être éliminée par chauffage en raison de la présence de sels ne se décomposant pas ex. Chlorures (MgCl2), nitrates (MgNO3) ,des sulfates (CaSO4).
La dureté peut être éliminée par traitement avec du carbonate de de sodium (Na2CO3) ou passage de l’eau par une résine échangeuse d’ion.
MgSO4 + Na2CO3 🡪 MgCO3 + Na2SO4
Insoluble : précipité
VI.4. OXALATE DE CALCIUM CaC2O4:
L’oxalate de calcium Ca (COO)₂ ou CaC2O4.est un cristal ionique très peu soluble dans l’eau.
On le retrouve dans certains minerais (exp: la whewellite ) ,dans des plantes et dans divers aliments notamment ceux qui sont riches en sels et en proteines .
L’oxalate de calcium est aussi le constituant de 80⁒ des calculs rénaux (concretion ou piérre formée dans la cavités des reins).
Environ 70 % des calculs s’évacuent spontanément et ce d’autant plus facilement qu’ils sont petits et non compliqués.
Il est alors conseillé :
– De boire 2 à 3 litres par 24 heures.
– D’Adopter un régime alimentaire adapté :
Augmenter l’apport en vitamines et minéraux (exp : la vitamine B6 et le Mg : solubilisent les cristaux d’oxalate, l’acide citrique : augmente le pH des urines il réduit donc la formation des calculs, le calcium : se lie aux oxalates au niveau de l’estomac diminuant ainsi leur absorption…etc .)
Diminuer l’apport protéique.
Limiter la consommation des oxalates et de sodium .
– Dans certains cas le recours au traitement chirurgical s’avère nécessaire.
VII. ASPECTS BIOLOGIQUES ET PHARMACEUTIQUES :
VII. 1. ASPECTS BIOLOGIQUES DU MAGNESIUM ET DU CALCIUM : le magnésium et le calcium font partie des éléments essentiels.
Chez un homme de masse moyenne (70Kg) ils représentent respectivement 0.35% et 1.5% de la masse corporelle.
Le calcium est le l’élément métallique le plus abondant dans le corps humain.
A. Propriétés physicochimiques du Mg2+ et Ca2+ :
| Mg2+ | Ca2+ | |
| Charge | 2 | 2 |
| Rayon ionique (A°) | 0.72 | 1 |
| Potentiel ionique | 2.78 | 2 |
Mg2+ et Ca2+ existent autant en milieu intracellulaire qu’extracellulaire.
Leur potentiel ionique étant relativement élevé (liaison avec les groupes nucléophiles des molécules biologiques), ils existent dans divers compartiments (os, plasma, milieu intracellulaire) et sous différentes formes.
Ils se lient avec les molécules d’eau (sous forme de cations libres) mais également avec les structures protéiques (albumine, enzymes) ou moléculaires (ATP, ADN, anion phosphate, anion citrate, etc.).
B. Rôle physiologique de Mg2+ et Ca2+ :
a. Rôle du calcium : La concentration en calcium extracellulaire est de l’ordre de 99% dont la majeure partie (90%) est stockée sous forme d’hydroxyapatite Ca5(PO4)3OH.
Elle constitue la partie minérale du tissu osseux et de l’émail dentaire.
Le déficit en calcium est à l’origine de l’ostéoporose (Fragilité pathologique des os).
Caries dentaires : les bactéries présentes dans la cavité buccale sont à l’origine du métabolisme des sucres ingérés et la production d’acide lactique.
L’acidité provoque la déminéralisation de l’émail dentaire :
Ca5(PO4)3OH+ 4H30+(aq) → 5Ca2+(aq) + 3HPO42-(aq) + 5H2O
Application : l’introduction de l’ion fluorure (F–) dans l’eau potable ou les dentifrices permet le renforcement de la structure osseuse par substitution de l’anion (OH–) et formation de fluorapatite Ca5(PO4)3F plus résistante à l’acidité.
Ca5(PO4)3OH + F– → Ca5(PO4)3F + OH–
Le calcium intracellulaire (1%) intervient dans plusieurs processus biologiques notamment comme messager de signalisation cellulaire :
Dans l’étape primaire de la coagulation sanguine (formation de caillot) ;
Application : les chélateurs du calcium comme l’EDTA-Na2 ont un effet anticoagulant.
Dans l’initiation des phénomènes électriques et mécaniques : dépolarisation, contraction des muscles lisses ou striés, sécrétions hormonales, activation d’enzymes.
b. Rôle du magnésium : environ 50% du magnésium se trouve dans l’os.
Le reste de magnésium est essentiellement intracellulaire où il joue deux principaux rôles : Activateur enzymatique et antagoniste du calcium.
Activateur enzymatique : il forme des complexes avec les molécules portant un groupe phosphate (ATP, ADP, ADN, etc.) en s’intercalant par des liaisons électrostatiques entre deux atomes d’oxygène du groupe.
Ce qui lui permet d’activer les enzymes impliquées dans le transfert d’un groupe phosphate.
Mg intervient dans 300 processus enzymatique.
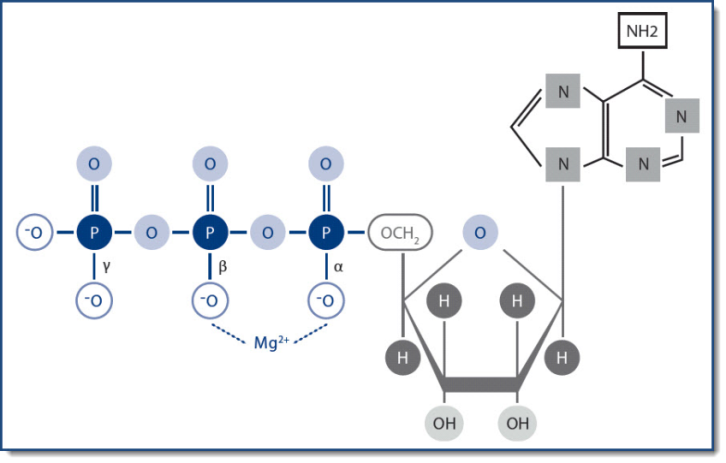
L’ATP (Adénosine triphosphate) doit être liée au magnésium pour être biologiquement active.
Elle forme des complexes [ATP-Mg]2- stables.
Antagoniste du calcium : par inhibition des canaux calciques (responsables de la pénétration du calcium dans la cellule), le magnésium joue le rôle d’un antagoniste (opposant fonctionnel) du calcium :
Inhibe la transmission neuromusculaire (relâchement des muscles) ;
Diminue l’excitabilité neuronale ;
Inhibe l’agrégation plaquettaire lors de la coagulation.
VII. 2. ASPECTS PHARMACEUTIQUES :
A. Calcium : il existe diverses préparations contenant du calcium comme principe actif essentiel.
Elles sont administrées par voie buccale ou injectable.
Par voie orale (ex.
Carbonate de calcium CaCO3, citrate de calcium) : prévention/traitement du rachitisme et de l’ostéoporose.
CaCO3 réagit avec HCl gastrique : CaCO3 + 2HCl → CaCl2 + CO2 + H2O
CaCl2 étant soluble, libère le cation Ca2+ qui sera absorbé.
Par voie parentérale (ex.
Chlorure de calcium CaCl2, gluconate de calcium) : traiter les hypocalcémies aigües (spasmes et crampes musculaires, tétanie, convulsions et défaillance cardiaque) et l’hyperkaliémie associée à un trouble cardiaque (bradycardie).
B. Magnésium :
Par voie orale : pour traiter les déficiences en magnésium (sulfate de magnésium).
Il est également utilisé comme antiacide (hydroxyde de magnésium) ou en association avec des sels d’aluminium.
Par voie parentérale (ex.
Sulfate de magnésium, Pidolate de magnésium) : pour le traitement des crises convulsives et la prévention de l’accouchement prématuré (inhibition des contractions utérines) et des troubles du rythme cardiaque.
| C. Baryum : étant un élément très lourd, Ba absorbe les rayons X, rendant possible son utilisation comme agent de contraste (ou opacifiant) en radiologie par rayons X. Le sulfate de baryum est administré au patient per os ou par voie rectale sous forme de suspension fluide il est sous forme de microparticules solides non ioniques non solubles dans l’eau. Il tapisse et délimite le tube digestif. Les fines particules de sulfate de baryum permettent de tapisser les moindres replis de la muqueuse, ce qui permet l’exploration de tout l’appareil digestif qui apparait en blanc. Permettant ainsi la mise en évidence de très petites lésions.Propriétés pharmacocinétiques : Le sulfate de baryum est un produit minéral qui se présente sous la forme d’une poudre blanche, opaque aux rayons X et insoluble. Il n’est donc ni digéré, ni absorbé. | |
| Radiographie avec du sulfate de Baryum comme produit de contraste |
