L’HYDROGENE
INTRODUCTION :
L’hydrogène, du grec hydro : eau et génos : engendrer, est le premier élément du tableau périodique.
C’est l’élément le plus léger et le plus simple
Il possède des propriétés particulières qui rendent difficile son classement. :
| Arguments pour son classement avec : | Arguments contre son classement avec : | |
| Métaux alcalins(G1) | Forme un ion H+ ≡ M+Configuration électronique (ns1) | Non-métalNe réagit pas avec l’eau |
| Halogènes(G17) | Non-métal ≡ XForme une molécule diatomique (H2) ≡ X2 | Forme rarement un ion H–Non réactif par rapport aux halogènes |
I- ETAT NATUREL :
L’hydrogène est l’élément le plus abondant dans l’univers.
Il est le troisième élément le plus abondant sur terre, après l’oxygène et le silicium :
Forme combinée : Eau, hydrocarbures, matière organique.
Forme libre (H2) : il constitue 1 % de l’atmosphère terrestre (gaz naturel : volcans, gisements pétrolifères ou dans les inclusions gazeuses : roches, minerais)
L’hydrogène est un élément essentiel à la vie.
Il représente 10 % de la masse d’un corps humain.
On distingue 2 types :
| HYDROGENE MOLECULAIRE | HYDROGENE ATOMIQUE |
| – 2 atomes d’hydrogène liés par une liaison covalente : l’Energie d’association est inférieure à la somme des energies des deux atomes pries séparément- L’hydrogène moléculaire existe sous 2 formes isomériques :Parahydrogène : spin antiparallèleOrthohydrogène : spin parallèleDifférences dans les propriétés physiquesLes formes ortho et para sont en équilibrePH2 +ΔH˃OOH2Aux conditions normales de T et de P le H2 contient un ¼ PH2 et ¾ OH2 | – Dans les conditions convenables de T et de P2H +ΔH˂0H2– L’hydrogène atomique est chimiquement plus actif que l’hydrogène moléculaire |
II. PROPRIÉTÉS :
II.1. PROPRIETES ELECTRONIQUES :
Configuration électronique : 1s1
Énergie d’ionisation : 1312 kJ/mol
Isotopes : l’hydrogène possède 3 isotopes : protium, deutérium et tritium.
Tableau : propriétés des isotopes de l’hydrogène
| Isotope | Symb. | N | Abondance(%) | Masse molaire (g/mol) | PE°(C) | Enthalpie de dissociation (kJ/mol) | Radioactivité | |
| Protium | H | 0 | 99.985 | H2 | 2.02 | – 252.55 | 436 | – |
| Deutérium | D | 1 | 0.015 | D2 | 4.03 | – 249.25 | 443 | – |
| Tritium | T | 2 | 10-15 | T2 | 6.03 | – 247.95 | 447 | T½ = 12.3 ans |
| Les propriétés physiques (ex. masse molaire, PE° et PF°) des isotopes sont différentes. Par conséquent, les propriétés de leurs composés respectifs (ex. l’eau : H2O, D2O, T2O) seront différentes.Les propriétés chimiques des isotopes sont similaires. Absorbé par l’organisme, un composé contenant du protium, du deutérium ou du tritium subira un même métabolisme. |
Tableau : propriétés physiques des oxydes des isotopes (H2O, D2O, T2O )
| Composé (eau) | Symb. | Massemolaire (g/mol) | Massevolumique (g/ml) | PF (C°) | PE (C°) |
| Eau ordinaire | H2O | 18 | 1 | 0 | 100.0 |
| Eau deutérée | D2O | 20 | 1.11 | 3.8 | 101.4 |
| Eau tritiée | T2O | 22 | 1.21 | 4.5 | 101.5 |
| Radioactivité du Tritium : Le tritium est un isotope radioactif avec un Tl/2 =12 ans est formé naturellement par l’impact des rayons cosmiques (particules de neutrons) sur l’atmosphère (azote) :Il est également obtenu à partir du lithium (6Li) par réaction nucléaire :Réaction de désintégration : la radioactivité du tritium est de type β– (émission d’électron) : |
Application : le tritium est un produit radiopharmaceutique qu’on utilise comme traceur* en médecine ou en recherche biologique.
Le tritium présente les avantages suivants :
Les électrons émis étant de faible énergie, les tissus biologiques ne sont donc pas endommagés.
Une bonne capacité de pénétration dans les tissus ce qui offre une bonne résolution de l’image
Il ne s’accumule pas dans les tissus (élimination rapide) et il n’est pas toxique.
*Définition : un traceur radioactif est un élément ou un composé dont la radioactivité permet le suivi de sa distribution à travers un système.
II.2. PROPRIETES PHYSIQUES DU DIHYDROGENE (H2) :
| Point de fusion | -259.1°C (14.01 K) |
| Point d’ébullition | -252.9°C (20.28 K) |
| Masse volumique (20°C) | 0.09 g/cm3 |
| Densité relative (à l’air) | 0.07 |
| Rayon atomique | 25 pm |
| Distance interatomique | 74 pm |
L’hydrogène forme une molécule diatomique H2.
C’est un gaz incolore, inodore et très léger.
Sa très petite taille lui permet de diffuser à l’intérieur des métaux (voir hydrures métalliques).
II.3. PROPRIETES CHIMIQUES :
A. Electronégativité de l’hydrogène et polarité de la liaison « E – H » :
L’électronégativité de l’hydrogène χH = 2.2 (échelle de Pauling).
Une liaison E – H (où E = tout élément) peut être ionique ou covalente, polaire ou apolaire :
| Liaison E – H | Polarité | Electronégativité | E |
| Ionique | / | χE ˂ ˂ χH | Métaux du bloc s (sauf Be et Mg) |
| Covalente | Polaire : E δ+ – Hδ- | χE ˂ χH | Métaux bloc d et bloc p |
| Polaire : E δ- – Hδ+ | χE ˃ χH | Eléments du bloc p (ex. N, O, F, Cl) | |
| Apolaire | χE ≈ χH | Eléments du bloc p (ex. B, C, Si, P, I) |
B. Réactivité chimique :
Dans les conditions ambiantes, l’hydrogène est non réactif.
L’enthalpie de la liaison* H – H (436 kJ/mol) constitue une barrière énergétique importante.
La non-réactivité de l’hydrogène est cinétique et non thermodynamique.
Enthalpie de liaison (kJ/mol) : énergie nécessairepour rompre 1 mole d’une liaison covalente.
La présence d’un catalyseur (diminution de l’énergie d’activation) ou d’un amorçage (apport d’une énergie d’activation : étincelle, irradiation UV, température et pression) provoque la rupture homolytique de la liaison H – H qui produit l’hydrogène radicalaire (H●) extrêmement réactif :
H2 → 2H●
a.
Avec l’oxygène : la réaction est amorcée par une étincelle. L’eau est formée avec libération d’une grande quantité de chaleur :
| étincelle | |||||
| H2 | + | ½ O2 | → | H2O | ΔH = – 244 kJ/mol |
Application : source d’énergie propre (H2O est le produit de la réaction) et pratiquement inépuisable (H2 et O2 sont obtenus par électrolyse de H2O).
La réaction de l’hydrogène avec l’oxygène est une réaction en chaine :
Réaction en chaine : une réaction durant laquelle un ou plusieurs réactifs intermédiaires (fréquemment des radicaux) sont continuellement régénérés, généralement dans un cycle répétitif d’étapes élémentaires (l’étape de propagation).
| H2 → 2H● | Amorçage : provoquée par l’étincelle, elle conduit à la formation du radical dit porteur de chaîne. |
| H● + O2 → OH● + ●O● | Ramification : augmentation du nombre des porteurs de chaînes (H●, OH● et ●O●) |
| ●O● + H2 → OH● +H● | |
| OH● +H2 → H2O +H● | Propagation : la réaction se reproduit en plusieurs cycles conduisant à la formation de H2O avec régénération du radical. |
| OH● +H●→ H2O | Rupture : réaction prend fin après consommation des réactifs. |
b. réaction avec les halogènes (X) : H2 réagit avec les halogènes (F, Cl, Br, I) en formant des halogénures d’hydrogène HX :
| Réaction | Conditions | ΔH (kJ/mol) | ||
| H2 + F2 → 2HF | Spontanée | -537 | Spontanéité de la réaction diminue | |
| H2 + Cl2 → 2HCl | Lumière (U.V.) : Cl2 2Cl● | -247 | ||
| H2 + Br2 → 2HBr | T° élevée : Br2 2Br● | -104-9.5 | ||
| H2 + I2 → 2HI | ||||
C. Pourvoir oxydoréducteur :
Le potentiel standard d’oxydoréduction (H+/H2) = 0 V.
Il s’agit de la valeur de référence utilisée dans l’électrode standard à hydrogène (E.N.H.) pour les mesures électrochimiques. Ex. potentiométrie, pHmétrie.
Le pouvoir réducteur de l’hydrogène se manifeste en présence d’un catalyseur (métal : ex.
Fe, Ni, Pt, Pd).
Ex. Réduction des liaisons multiples des composés organiques : l’éthylène (C2H4) est réduit en éthane (C2H6).
H2C = CH2(g) + H2(g) → H3C – CH3(g)
III. PREPARATION :
III.1. INDUSTRIELLE :
Pour ces utilisations industrielles, H2 est produit in situ (contraintes de transport), par la réaction du carbone ou d’un hydrocarbure (ex.
CH4) avec la vapeur d’eau (1) suivie d’un traitement partiel du CO produit par la vapeur d’eau (2) :
| CH4(g) + H2O(g) | 500°C, Ni | CO(g) + 3H2(g) | (1) |
| CO(g) + H2O(g) | Δ | CO2(g) + H2(g) | (2) |
N.B. L’hydrogène obtenu contient des impuretés (CO, CO2).
III.2. LABORATOIRE :
A. Electrolyse : on peut produire H2 (très pur) par électrolyse de l’eau dans laquelle on a ajouté un électrolyte (ex.
NaOH, H2SO4), l’eau pure étant très peu conductrice.
L’électrolyse se produit selon les réactions :
| Cathode (-) : | 2 H2O(l) + 2e– → 2 OH–(aq) + H2(g) |
| Anode (+) : | 3 H2O(l) → 2 H3O+(aq) + ½ O2(g) + 2 e– |
| Bilan : | H2O(l) → H2(g) + ½ O2(g) |
B. Réactions chimiques : réaction entre un acide dilué (HCl, H2SO4) et un métal (ex.
Zn, Fe) :
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
IV. COMPOSES DE L’HYDROGENE : LES HYDRURES BINAIRES :
Il n’est appelé « hydrure » qu’un composé binaire formé d’hydrogène et d‘un élément moins électronégatif que lui.
Ex.
NaH : hydrure de sodium, CaH2 : hydrure de calcium, SbH3 : hydrure d’antimoine, NH3 : nitrure d’hydrogène, H2O : oxyde d’hydrogène, HCl : chlorure d’hydrogène, etc.
Définition : un hydrure est un composé binaire de formule « ExHy » issu de la combinaison d’un élément E et de l’hydrogène.
En fonction de l’élément « E » (caractère métallique et électronégativité), un hydrure peut être : ionique, métallique ou covalent.

Distribution des trois types d’hydrures communs
| IV. 1. LES HYDRURES IONIQUES (SALINS) : sont issus de la combinaison entre l’hydrogène et un métal du bloc s (sauf Be et Mg). | |
| Propriétés physiques : solides, points de fusion et d’ébullition élevées, solubles dans l’eau avec la libération de l’anion hydrure (H–).Propriétés chimiques : découlent de la réactivité de l’anion H–. Les hydrures ioniques sont :Des bases fortes : la réaction avec l’eau forme l’hydroxyde correspondant et libère H2 :NaH + H2O → NaOH + H2 ↗De puissants réducteurs : 2LiH + O2 → H2O + LiO | |
IV. 2. HYDRURES METALLIQUES (INTERSTITIELS) : se forment entre certains métaux du bloc dou du bloc f et l’hydrogène.
| Propriétés : les atomes d’hydrogène diffusent dans le métal (M) et occupent les sites interstitiels du réseau cristallin.Les hydrures métalliques ont la particularité d’être non-stœchiométriques (ex. TiH1.7 : 1 mole de Ti pour 1.7 mole de H).Chauffés, les hydrures métalliques libèrent H2 (ex. Le palladium peut absorber réversiblement 900 fois son propre volume de H2). | |
| IV. 3. HYDRURES COVALENTS : sont issus de la combinaison avec les éléments du bloc pPropriétés : volatils ou liquides (PF et PE faibles), ils existent sous forme de molécules discrètes (ex. CH4, NH3, H2O, H2S) reliées par des forces intermoléculaires (Van der Waals, pont hydrogène). | |
V. LIAISON HYDROGENE :
V.1. DEFINITION : une liaison hydrogène (ou pont hydrogène) est une liaison non covalente, de type dipôle-dipôle.
Elle se forme entre un atome H lié (par liaison covalente) à un atome très électronégatif (X = N, O, F) et un atome électronégatif ayant au moins un doublet électronique libre (Ȳ = N, O, F ).
X δ- – Hδ+ ●●● ȲOù : X est le donneur de liaison
Y est l’accepteur de liaison
Exemples :
| Liaison hydrogèneentre deux molécules d’eau | Liaison hydrogène entredeux molécules d’acide carboxylique |
V.2. CARACTERISTIQUES :
A. Force de la liaison hydrogène : les enthalpies des liaisons d’hydrogènes varient en fonction des éléments X et Y (électronégativité, position dans une molécule) et des conditions de températures et de pression.
On considère que les liaisons hydrogène sont plus fortes que les forces de Van Der Waals et plus faibles que les liaisons covalentes.
| Liaison hydrogène | Enthalpie de liaison (kJ/mol) | Liaison covalente | Enthalpie de liaison (kJ/mol) |
| H2N – H … NH3 | 17 | N – H | 390 |
| HO – H … OH2 | 22 | O – H | 464 |
| F – H … FH | 29 | F – H | 567 |
| F – H … F– | 155 |
B.
Longueur : les liaisons hydrogène sont plus courtes que les forces de Van Der Waals et plus longues que les liaisons covalentes.
Exemple : Longueur de la liaison covalente « O – H » = 96 pm
Longueur de la liaison hydrogène « O – H ●●● O » = 260 pm
| C. Direction : la liaison hydrogène est directionnelle. Elle estalignée sur l’axe de la liaison covalente X – H.Ex. dans la liaison « O – H ●●● O », les atomes O, H et O sont alignés. |
V. 3. IMPLICATIONS DE LA LIAISON HYDROGENE :
A. Points d’ébullition et de fusion :
| en général, plus une molécule possède une masse élevée plus ses points d’ébullition et de fusion sont élevés. Toutefois, on remarque que les composés formant des liaisons hydrogène présentent des points d’ébullition et de fusion anormalement élevées.Exemple : sur la figure ci-contre :H2O, HF et NH3 possèdent des points d’ébullition anormalement élevés par rapport aux hydrures de leurs groupes respectifs.La liaison C – H étant apolaire, le point d’ébullition du CH4 est le plus bas des hydrures du groupe 14. |
B.
Viscosité* : la viscosité est due aux forces intermoléculaires, notamment à la liaison hydrogène, qui maintiennent ensemble les molécules.
*La viscosité d’un liquide est sa résistance à l’écoulement : plus la viscosité est élevée, plus l’écoulement est lent.
| Les liquides constitués de molécules qui ne peuvent pas former de liaisons hydrogène (ex. éther diéthylique (C4H10O), benzène (C6H6), etc.) sont, en général, moins visqueux que ceux qui forment des liaisons hydrogène (ex. éthanol (C2H6O), glycérol (C3H8O3), acide phosphorique (H3PO4), etc.)C. Solubilité et hydrophobie :Les composés qui forment des liaisons hydrogène sont solubles dans les solvants polaires et sont miscibles à l’eau. Ex. Ammoniac/eau, acide phosphorique/eau, éthanol/eau, glycérine/eau.Les composés qui ne peuvent pas former de liaisons hydrogènes sont insolubles dans les solvants polaires et sont hydrophobes. Ex. Benzène/eau, éther diéthylique/eau. |
VI. ASPECTS BIOLOGIQUES ET MEDICAUX :
VI.1. ASPECTS BIOLOGIQUES :
L’hydrogène est un élément majeur essentiel représentant 10 % de la masse corporelle.
Elément constitutif de la majorité des biomolécules
Son rôle Il y exerce des fonctions en tant que proton (H+) ou via les liaisons de l’hydrogène.
A. Le proton (H+) :
– le proton est l’acidifiant de l’organisme : dont la concentration (pH) détermine l’acidité du milieu physiologique (ci-dessous quelques exemples).
| Milieu physiologique | pH |
| Estomac | ≈ 1.5 |
| Lysosome | ≈ 5.5 |
| Sang | ≈ 7.4 |
Le proton H+ est libéré à partir des aliments acides, mais surtout, sécrété par des protéines transmembranaires (pompe H+/K+-ATPase, échangeur Na+/H+) qui participent, avec les systèmes tampons physiologiques, au maintien de l’équilibre acido-basique dans les différents milieux.
L’équilibre acido-basique d’un milieu physiologique est nécessaire aux processus qui y évoluent.
Les troubles de cet équilibre se traduisent par un syndrome d’acidose (diminution du pH) ou d’alcalose (augmentation du pH).
– Potentiel électrochimique et synthèse de l’ATP :
L’oxydation des substrats au cours de la respiration conduit à l’expulsion des protons (H+) hors de la mitochondrie, créant le potentiel électrochimique nécessaire à la synthèse de l’ATP par l’ATP-synthase mitochondriale.
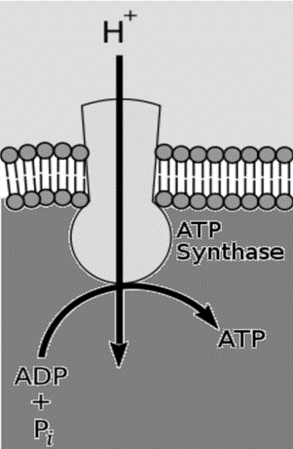
B. Les liaisons de l’hydrogène :
a. Liaison « C – H » : la liaison C – H est apolaire (χC = 2.5, χH = 2.2) et constitue les portions hydrophobes des molécules biologiques (ex. acides gras, lipides, protéines, etc.).
Dans un environnement essentiellement aqueux (l’eau représente environ 65 % du corps humain), l’hydrophobie des molécules biologiques empêche leur dissolution et permet le maintien de leurs structures.
b. Liaison hydrogène « X – H … Y » : (à relier avec les caractéristiques des liaisons hydrogène)
Etant relativement forte, la liaison hydrogène permet la formation de macromolécules biologiques ex. structures secondaires des protéines, les deux brins de l’ADN (liaisons AT, CG). Etant directionnelle, elle leur impose une structure définie (ex. feuillet, hélice, etc.) et fonctionnelle.
| Structures secondaires de protéines | Bases puriques et pyrimidiques de l’ADN |
La liaison hydrogène étant relativement faible, elle permet aux biomolécules d’évoluer et d’interagir : formation et rupture de ponts hydrogène, par exemple, lors de la réplication de l’ADN ou des interactions protéine/ligand, à température corporelle (37° C).
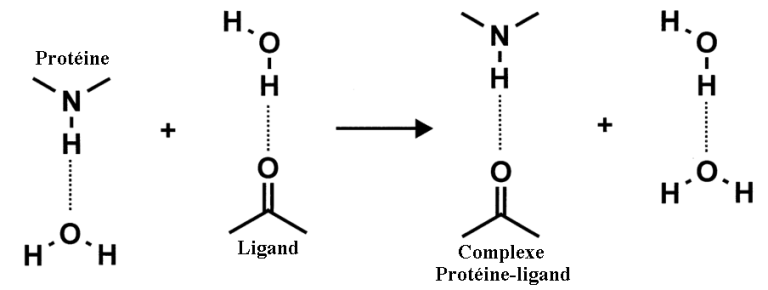
Interaction Protéine/Ligand
Interaction Protéine/ligand : cette interaction, conduisant à l’activation ou l’inhibition d’un site consiste souvent à la formation d’une liaison hydrogène.
Application : les médicaments sont conçus pour se fixer sur des récepteurs spécifiques, notamment via des liaisons hydrogènes.
Dans le schéma ci-dessous, le médicament2forme des ponts hydrogène avec le site actif enzymatique grâce aux atomes de fluor (accepteur de liaison hydrogène).
Le médicament1 en est dépourvu et ne se fixe pas sur le site actif.
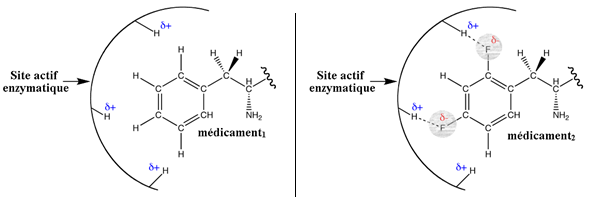
VI.2. ASPECTS MEDICAUX :
A. I.R.M. (Imagerie par Résonance Magnétique) : technique d’imagerie permettant de visualiser les tissus mous (système nerveux, cœur, etc.) et les tumeurs.
Principe : Elle se base sur la résonnance magnétique nucléaire des noyaux atomiques possédant un spin nucléaire (ex. 1H, 13C, 19F, etc.).
L’abondance du proton 1H dans le corps humain (eau, molécules biologiques) en fait le noyau de prédilection.
Chaque noyau (soumis à un champ électromagnétique) absorbe une radiofréquence caractéristique puis relâche une énergie qui varie en fonction de l’environnement chimique du noyau.
Le signal (énergie) est ensuite traduit en une image.
| Image IRM de la tête | Appareil IRM |
B. Protonthérapie : technique de radiothérapie* qui utilise un faisceau de protons accélérés (par un accélérateur de particules) et dirigé vers la tumeur à traiter.
*Radiothérapie : technique utilisant un rayonnement ionisant pour détruire des cellules cancéreuses

Protonthérapie d’une tumeur de l’oeil
La protonthérapie permet le traitement de tumeurs localisées au niveau d’un tissu sensible (ex. œil, cerveau, etc.)La faible dispersion des protons par rapport à un rayonnement classique (rayon X) permet d’épargner les tissus sains en limitant l’action à la tumeur.
