Nomenclature des ions monoatomiques
INTRODUCTION
Tout au long de l’histoire, on a donné à de nombreux composés des noms informels, des noms courants, avant de connaitre leur composition, exemple l’eau, le sel, le sucre, l’ammoniac et le quartz.
En revanche, le nom systématique d’un composé chimique indique la nature des éléments présents et, dans certains, cas la disposition des atomes.
La dénomination systématique des composés est appelée nomenclature chimique.
La nomenclature chimique est développée et mise à jour par l’Union internationale de chimie pure et appliquée (UICPA).
I. NOMENCLATURE DES IONS MONOATOMIQUES
I.1. Nomenclature des cations
Le nom d’un cation monoatomique est le nom de l’élément précédé du mot « ion ».
Ex.Na+ est l’ion sodium
Ca2+ est l’ion calcium
Lorsqu’un élément « A » peut former plusieurs cations (An+), on écrit le nombre d’oxydation (la charge du cation, « n »), sous forme de chiffres romains entre parenthèses à la suite du nom de l’élément.
Ex.Cu+ est l’ion cuivre (I) et Cu2+ l’ion cuivre (II).
Fe2+ estl’ion fer (II) et Fe3+ l’ion fer (III)
Certains anciens systèmes de nomenclature sont encore utilisés.
Par exemple, on désignait certains cations par la terminaison « –eux » et « –ique » pour nommer les ions ayant respectivement le degré d’oxydation le plus faible et le plus élevé.
Pour compliquer les choses, ces terminaisons étaient dans certains cas accolées à la forme latine du nom de l’élément.
Ex.
| Ion | Nomenclature actuelle | Nomenclature ancienne |
| Sn2+ | Ion étain (II) | Etain stanneux |
| Sn4+ | Ion étain (IV) | Etat stannique |
I.2. Nomenclature des anions
Un anion monoatomique est nommé en ajoutant le suffixe « –ure » à la première partie du nom de l’élément (la racine de son nom) le tout précédé du mot « ion ».
Ex.Cl–, anion de l’élément chlore, est l’ion chlorure
Br–, anion de l’élément brome, est l’ion bromure
S2-, anion de l’élément soufre, est l’ion sulfure
Se2-, anion du sélénium, est l’ion séléniure
N.B.
L’ion O2-est une exception importante à cette règle : on l’appelle « ion oxyde »
En général, il n’est pas nécessaire de préciser la charge, dans la mesure ou la plupart des éléments qui donnent des anions monoatomiques n’ont qu’un type d’anion.
II.
NOMENCLATURE DES IONS POLYATOMIQUES
II.1 Nomenclature des cations polyatomiques
Citons deux cations polyatomiques : NH4+ion ammonium et H3O+ ion hydronium
Si un composé polyatomique contient de l’hydrogène comme cation, le nom se termine par « d’hydrogène ».
Ex.
Hl chlorure d’hydrogène
II.2. Nomenclature des anions polyatomiques
Les règles de nomenclature des anions peuvent différer selon que l’anion est monoatomique (un seul atome) ou polyatomique (plusieurs atomes).
II .2 .1 Nomenclatures des oxanions
Les ions polyatomiques comprennent les oxoanions, anions qui contiennent de l’oxygène.
S’il n’existe qu’un seul oxoanion d’un élément, on forme son nom en ajoutant le suffixe « –atte » au radical du nom de l’élément.
Ex.
L’oxoanion du carbone CO32- est l’ion carbonate.
Certains éléments peuvent former deux types d’oxoanions avec des nombres différents d’atomes d’oxygène.
Alors :
On ajoute le suffixe « –atte » à l’ion qui a le plus grand nombre d’atomes d’oxygène.
On ajoute le suffixe « –ite » à l’ion qui a le plus petit nombre d’atomes d’oxygène.
| Elément | Oxoanion au plus grand nombre d’atomes d’oxygène | Oxoanion au plus grand nombre d’atomes d’oxygène |
| Azote (N) | NO3– | NO2– |
| Ion nitrate | Ion nitrite | |
| Soufre (S) | SO42- | SO32- |
| Ion sulfate | Ion sulfite |
Certains éléments, en particulier les halogènes, forment plus de deux oxoanions :
Le nom de l’oxoanion qui a le plus petit nombre d’atome d’oxygène se forme en ajoutant le préfixe « hypo- »à la forme en « –ite » du nom.
On ajoute le préfixe « per- » au nom de l’oxoanion qui a le plus d’atomes d’oxygène que l’oxoanion en « –ate ».
| Oxoanion | |
| ClO– | ion hypochlorite |
| ClO2– | ion chlorite |
| ClO3– | ion chlorate |
| ClO4– | ion perchlorate |
II .2.2. Nomenclature des anions hydrogénés
L’hydrogène est présent dans certains anions, par exemple dans HS– et HCO3–.
Le nom de ces ions commence par le préfixe « hydrogéno ».
Ex. HS– est l’ion hydrogénosulfure
HCO3– est l’ion hydrogénocarbonate
S’il y a deux atomes d’hydrogène dans un ion, comme H2PO4–, le préfixe est « dihydrogéno », ici l’ion dihydrogénophosphate.
Si l’hydrogène est lui-même l’anion, sa terminaison est –ure.
Ex.
NaH hydrure de sodium
III.
NOMENCLATURE DES CORPS COMPOSES
III.1.
Nomenclature des composés ioniques :
Pour nommer un composé ionique, on donne le nom de l’anion suivi de la préposition « de », puis du nom du cation ; le mot « ion » est omis dans les deux cas.
On indique le nombre d’oxydation du cation s’il y a plusieurs charges possibles.
Sinon, on l’omet.
Ex. KCl, (K+, Cl–) chlorure de potassium
NH4NO3 (NH4+, NO3–) nitrate d’ammonium
CoCl2 (Co2+, Cl–) chlorure de cobalt (II)
CoCl3 (Co3+, Cl–) chlorure de cobalt (III)
Cas des sels hydratés : Certains composés ioniques forment des cristaux qui incorporent, outre les ions du composé lui-même une proportion bien définie de molécules d’eau.
Ces composés sont appelés hydrates.
Ex.
Sulfate de cuivre (II) CuSO4.5H2O
Dans cette formule le point « . » sépare l’« eau d’hydratation » du reste de la formule et le chiffre avant H2O indique le nombre de molécules H2O dans chaque formule-unité.
On nomme les hydrates en faisant suivre le nom du composé de l’adjectif « hydraté », avec un préfixe grec qui donne le nombre de molécules d’eau par formule-unité.
Par exemple, le nom de CuSO4.5H2O est « sulfate de cuivre pentahydraté » tandis que le nom « sulfate de cuivre anhydre » est donné à CuSO4 exempt de molécules d’eau.
| Tableau : Préfixes utilisés pour nommer les composés | |||
| Préfixe | Signification | Préfixe | Signification |
| mono- | 1 | hepta- | 7 |
| di- | 2 | octa- | 8 |
| tri- | 3 | nona- | 9 |
| tétra- | 4 | déca- | 10 |
| penta- | 5 | undéca- | 11 |
| hexa | 6 | dodéca | 12 |
III.2. Nomenclature des composés moléculaires inorganiques :
On écrit : l’élément le moins électronégatif en premier suivit de l’élément le plus électronégatif.
On nomme beaucoup de composés moléculaires inorganiques simples en utilisant les préfixes grecs pour indiquer le nombre de chaque type d’atome.
En général on n’utilise pas de préfixe s’il n’y a qu’un atome d’un élément.
Ex.
NO2 dioxyde d’azote / CO monoxyde de carbone
Pour nommer les composés moléculaires binaires (les composés moléculaires contenant deux éléments), on nomme en premier l’élément le plus électronégatif avec la terminaison –ure (sauf pour l’oxyde) :
Ex.
PCl3 trichlorure de phosphore / SF6 hexafluorure de soufre / N2O oxyde de diazote / N2O5 pentoxyde de diazote
Certains composés moléculaires binaires comme H2O et NH3 ont des noms courants utilisés par tous respectivement : eau et ammoniac.
IV.
NOMENCLATURE DES ACIDES ET DES BASES
IV.1.
Acides binaires des groupes 16 et 17 :
Lorsqu’on dissout le sulfure d’hydrogène ou un halogénure (fluorure, chlorure, bromure ou iodure) d’hydrogène dans l’eau, la plupart réagissent comme des acides et sont nommés comme tels.
On nomme les acides binaires en ajoutant au radical du nom de l’élément le suffixe « hydrique » et en faisant précéder le nom du mot « acide ».
Ex. HCl dans l’eau est l’acide chlorhydrique
H2S dans l’eau est l’acide sulfhydrique.
La solution acide est symbolisée par l’ajout de « (aq) » (pour aqueux) après la formule.
Ex. L’acide chlorhydrique est symbolisé par HCl(aq)
IV.2.
Oxacides :
Un oxacide est un composé moléculaire acide qui contient de l’oxygène.
Les oxacides sont les correspondants des oxoanions.
En général, les oxacides en « –ique » correspondent aux oxoanions en « –ate » et les oxacides en « –eux » aux oxoanions en « –ite ».
| Oxoanion | Oxacide correspondant | Oxoanion | Oxacide correspondant |
| NO2– | HNO2 | NO3– | HNO3 |
| Ion nitrite | Acide nitreux | Ion nitrate | Acide nitrique |
| SO32- | H2SO3 | SO42- | H2SO4 |
| Ion sulfite | Acide sulfureux | Ion sulfate | Acide sulfurique |
IV.3.
Bases :
Une base ou l’hydroxyde est une substance libérant l’anion OH– dans l’eau (ion hydroxyde). La formule des hydroxydes contient un multiple entier de OH– et des ions positifs, le plus souvent métalliques.
M(OH) « Hydroxyde de + nom de l’ion positif ».
Ex. NaOH est l’hydroxyde de sodium (soude caustique)
KOH est l’hydroxyde de potassium (potasse caustique)
Ca(OH)2 est l’hydroxyde de calcium (chaux éteinte)
V. ECRITURE DES FORMULES CHIMIQUES :
Dans les formules chimiques neutres contenant des ions, la somme des valences positives et négatives des atomes dans un composé doit être égale à zéro.
Afin de nommer ces composés, on recourt à la règle de la somme nulle comme suit :
Exemple 01 : Chlorure de Magnésium (MgCl2)
Étape 1 : Écrire la formule non-équilibrée : Mg Cl
Étape 2 : Placer la valence de chaque élément au-dessus du symbole chimique :
| +2 | +1 |
| Mg | Cl |
Étape 3 : Abaisser les nombres sans les signes en effectuant un croisement :
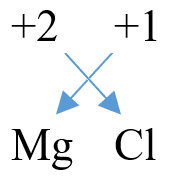
Étape 4 : Vérifier les indices en enlevant les indices « 1 », soit : MgCl2
Exemple 02 : Phosphate d’ammonium (NH4)3PO4
Étape 1 : NH4 / PO4
Étape 2 :
| +1 | -3 |
| NH4 | PO4 |
Étape 3 : (NH4)3(PO4)1
Étape 4 : soit : (NH4)3PO4
ANNEXE : Ci-après, les ions les plus communément rencontrés
| CATIONS | |
| ION | NOM |
| Valence = +1 | |
| H3O+ | Hydronium |
| NH4+ | Ammonium |
| Li+ | Lithium |
| Na+ | Sodium |
| Ag+ | Argent |
| Cu+ | Cuivre I |
| Hg22+ | Mercure I |
| Valence = +2 | |
| Mg2+ | Magnésium |
| Sr2+ | Strontium |
| Cu2+ | Cuivre II |
| Pb2+ | Plomb II |
| Sn2+ | Etain II |
| Valence = +3 | |
| Al3+ | Aluminium |
| Fe3+ | Fer III |
| Cr3+ | Chrome III |
| Valence = +4 | |
| Sn4+ | Etain IV |
| Pb4+ | Plomb IV |
| ANIONS | |||
| ION | NOM | ION | NOM |
| Valence= -1 | Valence = -2 | ||
| H– | Hydrure | O2- | Oxyde |
| OH– | Hydroxyde | O22- | Peroxyde |
| F– | Fluorure | S2- | Sulfure |
| Cl – | Chlorure | SO32- | Sulfite |
| ClO– | Hypochlorite | SO42- | Sulfate |
| ClO2– | Chlorite | S2O32- | Thiosulfate |
| ClO3– | Chlorate | S4O62- | Tetrathionate |
| ClO4– | Perchlorate | S2O82- | Peroxodisulfate |
| Br– | Bromure | CO32- | Carbonate |
| BrO3– | Bromate | C2O42- | Oxalate |
| I– | Iodure | CrO42- | Chromate |
| IO3– | Iodate | Cr2O72- | Dichromate |
| NO2– | Nitrite | SiO32- | Silicate |
| NO3– | Nitrate | HPO32- | Hydrogenophosphite |
| CN– | Cyanure | HPO42- | Hydrogenophosphate |
| OCN– | Cyanate | Valence= -3 | |
| SCN– | Thiocyanate | BO33- | Borate |
| CH3COO– | Acétate | PO33- | Phosphite |
| Al (OH4) – | Aluminate | PO43- | Phosphate |
| MnO4– | Permanganate | AsO33- | Arsénite |
| HS– | Hydrogénosulfure | AsO43- | Arséniate |
| HSO3– | Bisulfite | Valence= -4 | |
| HSO4– | Bisulfate | P2O74- | Diphosphate |
| HCO3– | Bicarbonate | ||
| H2PO3– | dihydrogénophosphite | ||
| H2PO4– | dihydrogénophosphate | ||
