Solvants et solutions
I/Introduction :
Les réactions chimiques envisagées en chimie analytique :
Concernent les mélanges (homogènes ou hétérogènes)
Ont lieu en phase liquide (milieu aqueux) … pour la plupart
Etude des solvants Etude des solutions
II/Définition :
A. Solvants:
Des substances organiques ou minérales le plus souvent volatils, capables de dissoudre d’autres substances sans modification ni du composant dissout ni du solvant lui-même. (Le solvant est le Composé majoritaire en solution).
B.Moment dipolaire : unité debeye (D)
Une molécule possède un moment dipolaire non nul lorsque le barycentre des charges positives (q+) n’est pas confondu avec celui des charges négatives (q-).
On notera que ׀q+׀ = ׀ q- ׀= q . soit « d » la distance entre ces deux barycentres.
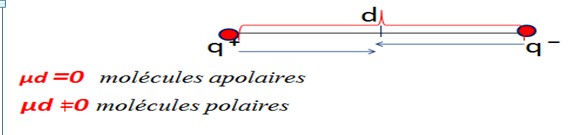
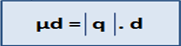
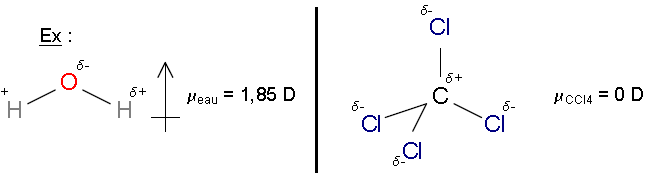
Les molécules polaires : µd ±0
Ex: H2O, HCl, (CH3)2O.
Les molécules apolaires: µd = 0
Ex: O2, CO2, CCl4.
Les molécules polarisables:
Les molécules apolaires qui peuvent posséder un µd induit par le voisinage d’une autre molécule polaire
Ex: I2 .
Tableau(1) : valeur du moment dipolaire µd de quelques solvants à 25°C.
| Solvant | Eau | NH3 | Ethanol | Acétone | Ether | CCl4 | hexane |
| µd (D) | 1,86 | 1,50 | 1,70 | 2,90 | 1,15 | 0 | 0 |
Plus le moment dipolaire des molécules du solvant est élevée, plus celui-ci favorise la formation et le maintien des charges.
On dit qu’il augmente son pouvoir ionisant.
C. Constante diélectrique ou permittivité diélectrique « ξ »:
Loi de coulomb:
La force électrostatique F qui s’exerce entre deux charges q1 et q2 distante de r.
ξ : permittivité du solvant
Plus la constante diélectrique du solvant est élevée, plus le solvant favorise la séparation des atomes voire empêche les molécules de réagir.
On dit qu’elle augmente sont pouvoir dissociant.
D. solution : Une solution est un mélange homogène (constitué d’une seule phase) résultant de la dissolution d’un ou plusieurs soluté(s) dissoute dans un solvant.
Les particules de soluté sont alors solvatées et dispersées dans le solvant.
E. soluté : Corps (gaz, liquide, solide) à dissoudre dans le solvant.Formé d’un ensemble de particules (ions, molécules) associées entre elles par des liaisons : covalentes, ioniques ou datives.
III/Classifications des solvants : 1/Selon leur polarité : 1.1.Solvant polaire: μd ≠0 Selon sa structure il agit comme accepteur ou donneur et transforme les liaisons entre atomes du corps dissous de la forme covalente vers la forme ionique. Ex : H2O, acides, bases, alcools, cétones ou amines ….
1.2. Solvant apolaire: μd =0 Présente un partage égal d’électrons entre deux atomes ou présente une disposition symétrique des liaisons polaires.ils sontVolatils, toxiques, inflammables, liposolubles, hydrophobes. Ex: Hydrocarbures aliphatiques, aromatiques, halogénés… 1.3.
Solvant amphiphile (tensio-actifs): présentent une partie polaire et une partie apolaire dans leur molécule.Utilisés pour dissoudre des produits incompatibles avec le milieu. Ex : Ethers de glycol, stéarates, … 2/ Selon la proticité : 2.1.solvant protique : Qui peut former des liaisons hydrogène. 2.2. solvant aprotique: Qui ne peut pas former des liaisons hydrogène. Ex : H2O est polaire protique. CCl4 est apolaire et aprotique.
3/Selon le pouvoir diélectrique :
3.1.Solvants dissociants ℰ> 40: ℰ très élevé, les liaisons ioniques sont brisées totalement. H2O → 80,1 ; H2SO4 → 101
3.2.Solvants peu dissociants 15<ℰ <40: La concentration des ions négligeable par rapport à l’état de molécules. Acétone → 20,7 ; Acétonitrile → 36 3.3.Solvants très peu dissociants : Pyridine→ 12.5 ; Acide acétique → 6.2 ; Chloroforme → 5.
4/Selon la nature chimique :
4.1.Les solvants inorganiques : Le minéral le plus populaire (ne contenant pas de carbone) des solvants sont de l’eau (H2O)
4.2.Les solvants organiques: A/Hydrocarbures:
A.1/Hydrocarbures aliphatiques : a/Aliphatiques saturés: Hexane, Cyclohexane
b/Aliphatiques insaturés: Oléfines (peu utilisées, terpènes)
A.2/Hydrocarbures aromatiques : comportent un seul cycle benzénique avec une ou plusieurs chaines latérales comme toluène et les xylène
A.3/Hydrocarbures halogénés : les solvants chlorés plus répondus suivis par les fluorés . Trichloréthylène, 1-bromopropane, 1,1,2-trichlorotrifluoréthane(CFC).
B/Solvants hydroxylés Alcools : méthanol, éthanol, isopropanol. C/Solvants oxygénés : Glycols : Ethers de glycol : Ethers : éther éthylique,Tétrahydrofuranne(THF). Esters: Lactate d’éthyle, Acétate d’éthyle.
Cétones : acétone ,méthyléthylcétone(MEK) ou butanone ,méthylisobutylcétone(MIBK).
D/Dérivés nitrés :
Les amides : à la fois oxygénés et azotés, les plus utilisés sont :
Le diméthyle formamide DMF
L’acétamide
Les amines : la plus utilisée est la pyridine
Les nitriles : l’Acétonitrile.
IV. Etude de la dissolution
1. Définition de la Dissolution : Consiste à diviser une substance à l’état moléculaire au sein d’un liquide, le résultat de cette opération est appelé solution qui est donc constitué par le soluté et par le solvant. On distingue deux sortes de dissolutions : -la dissolution simple ou complète -la dissolution extractive dite partielle qui laisse un résidu ou marc. 2.
Mécanisme de la dissolution : L’énergie des liaisons des interactions solvant – soluté est supérieure à celle du réseau cristallin du soluté, par conséquent, ce dernier se disperse dans le solvant à l’état d’ions, de molécules ou de groupes de molécules solvatées . 1- Dispersion du soluté 2- Expansion du solvant 3- Interaction du solvant et du soluté Au final il en résulte la rupture de l’édifice cristallin. Aspects réactionnels de la dissolution : 2.1.Solvatation: il s’agit d’un phénomène «obligatoire» aboutissant à l’insertion du soluté parmi les molécules du solvant avec formation de liaisons plus ou moins faibles C’est le seul phénomène obligatoire mais n’est pas le seul possible NB :quand le solvant est de l’eau ce phénomène porte le nom d’Hydratation 2.2.
Ionisation: C’est un phénomène «observable» lors de la mise en solution; lorsque le solvant modifie la structure du soluté et engendre l’apparition d’une polarité voire la coupure de liaison covalente Le pouvoir ionisant du solvant provient de sa capacité d’agir comme accepteur ou donneur d’électrons transformant ainsi une liaison covalente en liaison ionique. La liaison intramoléculaire est rompue. (A+, B–) forme une paire d’ions. Cette réaction d’ionisation porte le nom de solvolyse. À cet équilibre correspond une constante de solvolyse Ks
2.3. La Dissociation ionique Dans certains solvants les ions A+ et B– solvatés sont séparés, c’est la dissociation. [A+, B –] 🡪 A+ + B– À cet équilibre correspond une constante de dissociation Kd :
Cette constante est d’autant plus grande que la constante diélectrique du solvant est élevée. L’importance de la dissociation ionique est fonction du pouvoir dissociant du solvant .Ce pouvoir pouvant être caractérisé par la constante diélectrique ℰ. Plus ℰ est grande, les interactions électrostatiques entre ions de charges opposéesvont diminuées. V/L’équilibre chimique :
Les concepts de réaction chimique et de stœchiométrie mènent au concept d’équilibre chimique.
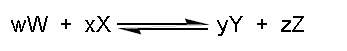
Les majuscules représentent les molécules (atomes) qui sont mises en présence.
Les minuscules représentent les coefficients stœchiométriques nécessaires à équilibrer la réaction chimique.
L’équilibre chimique est atteint lorsqu’il y a autant de molécules wW + xX qui réagissent pour donner yY + Zz qu’il y a de molécules yY + zZ qui réagissent pour donner wW + xX.
- La constante d’équilibre K: Permet de quantifier les facteurs influençant la position d’un équilibre chimique. 2.
La loi d’action de masse:
Si Z dans l’équation est un solvant H2O K devient
Les unités de K dépendent de la réaction envisagée
3. Le principe de Le Châtelier :
Définition:
La position d’un équilibre évolue toujours dans la direction qui s’oppose à la contrainte appliquée au système.
Ce principe fondamental en chimie permet de prévoir dans quel sens une réaction tend à évoluer.
VI/Facteurs influençant la solubilité :
La solubilité est la quantité maximale de soluté qui peut se dissoudre dans un volume donné de solution (g/l). Produit de solubilité :
Ksp= [A–] ×[C+] pks = – log Ks les facteurs influençant la solubilité sont 1.structure : Détermine la polarité des molécules. -Les substances polaires sont solubles dans les solvants polaires. -Les substances non polaires sont solubles dans les solvants non polaires.
2.
La pression : cas des gaz, son augmentation accroît la solubilité des gaz. 3.La température : son élévation augmente la solubilité des solides, diminue la solubilité des gaz.
4.
Effet du pH a un rôle sur les précipitations qui font intervenir un agent acide-base comme les acides organiques, les sulfures ex : FeS, Fe(OH)2 VII.
Solution idéale : Loi de RAOULT : une Solution idéale est régie par la loi de RAOULT.
Elle concerne la pression de vapeur d’une solution contenant des solutés non volatils. Loi de Raoult :
P° solution = X solvant. P° solvant pur P° solution = Pression exercée par la solution. X solvant = Fraction molaire du solvant. P° solvant pur = Pression exercée par le solvant pur.
Les conditions de formation d’une solution idéale s’expriment comme suit : -La formation de la solution se fait sans absorption ni dégagement de chaleur: ΔH Solution≈ 0. -Les énergies d’interactions entre les molécules de solvant et les molécules de soluté sont identiques. Solution non idéale : Les solutions non idéales sont non régies par la loi de Raoult. La non-idéalité d’une solution est la conséquence du fait que les forces inter- moléculaires entre les molécules de solvant (solvant – solvant) et entre les molécules de solvant et de soluté sont inégales. Dans le cas des solutions non idéales, on parle de déviation de la pression.
Les déviations observées par rapport à la loi de Raoult sont de deux sortes :
Déviation positive : La P° totale de la solution est supérieure à la valeur calculée selon la loi de Raoult.
Déviation négative : La P° totale de la solution est inférieure à la valeur calculée selon la loi de Raoult.
VIII/Les solutions d’électrolytes : des solutions conductrices du courant électrique par présence d’ions libres.
Ex: sels, acides ,bases …
-Les électrolytes vrais (ionophores): contiennent déjà à l’état pur des ions dans la maille cristalline.
Exemple : NaCl
-Les électrolytes potentiels A-B (ionogène): ne forment des ions que par dissolution. Exemple : acide acétique.
IX/L’expression de la composition des solutions (aspect quantitatif) :
n: nombre de moles de substance contenues dans un échantillon (mole).
Composition molaire ou la molarité: (mol. l ). NB : solution molaire: 1M.
La molalité : ( mol.
Kg -1 ) Nombre de mole de solutés par kilogramme de solvant pur. « mi ». la fraction molaire : x:le rapport du « n »de soluté et du « n » total de solution.
/ Xi : soluté.
/ X0 : solvant.Fraction massique :Soit la masse(i) ,la masse de tout constituant i de la solution.
La fraction massique wi s’exprime par le rapport de sa masse à la masse totale m :
Wi :sans dimension Masse(i) et m de même unité . Normalité (N) ; C’est le nombre d’équivalent-grammes de soluté par litre de solution.l’équivalent-gramme est liée au type de réaction. Dans les réactions acide-base:Varié en fonction de nombre de H+.Dans les réactions d’oxydoréduction: variation du nombre d’oxydation que subit une mole de substance. NB: un équivalent-gramme est La quantité de substance comprenant 1 mole des particules considérées. Pourcentages (ou compositions centésimales): -le pourcentage en masse par volume (m/v): Nombre de grammes d’un soluté dans 100 ml de solution –le pourcentage en masse (P/P) : Nombre de grammes d’un soluté dans 100g de solution –le pourcentage en volume (v/v) : : Nombre de ml d’un soluté dans 100ml de solution partie par million (ppm):
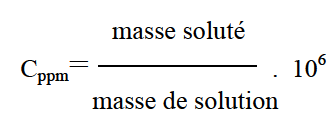
partie par billion (ppb):
X/Concept d’activité : A.La force ionique :
l’effet d’un électrolyte ajouté à un système à l’équilibre, est indépendant de sa nature chimique mais dépend sa force ionique( I ) de la solution. I = ½ ([A] ZA2 + [B]ZB2 +[C] Z C 2 +…..) [A], [B], [C] … concentrations molaires ZA ,ZB , Z C … charges. I= [ ] quand les charges unitaires HCl . I> [ ] quand les charges multiples H2SO4 .B.
L’activité « a » concentration effective: L’activité de l’espèce X dépend de la force ionique (I ≤ 0,1M) du milieu et définie par ax = [X] γx
[X]: concentration de l’espèce X.
γx: coefficient d’activité (écart à l’idéalité), γ≤1, il varie selon « I » et indépendant de la nature d’élctrolyte.
plus « I » augmente, plus l’ion perd de son efficacité et plus diminue γ.
solutions diluées: γ est indépendant de la nature de l’électrolyte et ne dépend que I .
I→0 , γx → 1 , ax→ [X] I ≈ C d’une molécule non chargée. Calcul d’activité :
1/Les espèces non chargées :
I<0,1M ax ≈[X].
2/des ions :
la théorie de Debye-Hückel:
prend en compte la charge portée par chaque ion ainsi que sa concentration , A: constante dépend de la T° et de ℰr du solvant pur. (A= 0,504 à 25˚C ) I <0,02M Équation élargie (extended) de Debye-Hückel : 0,02 M ≺ I ≺0,2M
XI/CONCLUSION :
Les les solutions sont très largement utilisées dans les méthodes analytiques en l’occurrence les méthodes volumétriques, chromatographiques et spectrophotométriques.
Elles sont importantes par leur :
-Influence sur les réactions chimiques.
-Influence sur la qualité et la fiabilité des résultats.
-Influence sur le choix des méthodes analytiques de dosage.
-Ce sont des auxiliaires incontournables, dans l’industrie pharmaceutique bien sûr, mais également dans une majorité de secteurs industriels.
